Cuidados Perioperatórios em Cirurgia Hepatobiliar
A cirurgia hepatobiliar apresenta desafios únicos devido à complexidade e importância do fígado na homeostase do organismo. Pacientes com disfunção hepática correm um risco elevado de complicações cirúrgicas e anestésicas, exigindo uma abordagem meticulosa no manejo perioperatório. Este texto visa fornecer uma visão abrangente sobre os cuidados essenciais, dirigido a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Avaliação Pré-operatória
Uma história clínica detalhada e exame físico são cruciais para identificar sinais de disfunção hepática. A hepatite aguda, independentemente da etiologia (viral, medicamentosa, autoimune, relacionada à obesidade, etc.), requer diagnóstico, avaliação e manejo adequados. Doenças hepáticas crônicas, como fibrose e cirrose, impactam significativamente o planejamento operatório e os desfechos pós-operatórios.
Fatores de Risco
Os fatores de risco para doenças hepáticas crônicas incluem:
- Comportamentos sociais (uso de drogas intravenosas, consumo significativo de álcool).
- Obesidade de longa data.
- Histórico familiar de doenças hepáticas crônicas.
Os achados clínicos como prurido, icterícia, ascite e ginecomastia, bem como sinais físicos como telangiectasias aracniformes, cabeça de medusa, icterícia, esplenomegalia e onda de fluido, são frequentemente encontrados em pacientes com cirrose avançada.
Estratificação do Risco Cirúrgico
A estratificação do risco cirúrgico em pacientes com doença hepática pode ser feita por meio de cenários clínicos e medidas objetivas. Hepatite aguda ou fulminante e hepatite alcoólica são contraindicações para cirurgia eletiva. A fibrose sem cirrose geralmente permite cirurgia eletiva com baixa morbidade, embora ajustes nos agentes anestésicos sejam necessários.
Anestesia em Pacientes com Doença Hepática
Agentes anestésicos comuns, como propofol, cetamina, etomidato, benzodiazepínicos e opioides, passam por metabolismo hepático. Bloqueadores neuromusculares não despolarizantes representam um desafio farmacodinâmico, pois pacientes com doença hepática frequentemente apresentam maior volume de distribuição e uma taxa de eliminação mais lenta.
Medidas Objetivas de Risco
Escore Child-Turcotte-Pugh (CTP)
O escore CTP, desenvolvido nos anos 80, classifica a cirrose em:
- Classe A: 5-6 pontos (bem compensada)
- Classe B: 7-9 pontos (compromisso significativo)
- Classe C: 10-15 pontos (descompensada)
As taxas de mortalidade variam amplamente conforme o procedimento, com estimativas gerais de mortalidade para operações abdominais de 10%, 20% e 60% para CTP A, B e C, respectivamente.
Escore MELD
O escore MELD, originalmente desenvolvido para seleção de transplante, prevê a mortalidade em pacientes com cirrose:
- MELD <8: 6% de mortalidade em 30 dias
- MELD >20: mais de 50% de mortalidade em 30 dias
Embora haja debates sobre a superioridade do MELD sobre o CTP, ambos os escores são úteis na estratificação do risco cirúrgico, especialmente em operações urgentes.
Manejo Perioperatório
A otimização médica pré-operatória é essencial para pacientes com doença hepática crônica. Função sintética deve ser avaliada por meio do tempo de protrombina (TP), níveis de albumina e fibrinogênio. Creatinina e bilirrubina total são necessárias para completar a avaliação de risco MELD. Malnutrição é comum em pacientes com cirrose e está associada a desfechos perioperatórios ruins. Suplementação nutricional pré-operatória, incluindo a reposição de vitaminas lipossolúveis, pode ser indicada.
Lesões do Ducto Biliar
As lesões do ducto biliar (LDB) são complicações graves e problemáticas associadas à colecistectomia, com uma incidência de 3/1000 procedimentos. Tais lesões são mais complexas em cirurgias laparoscópicas devido à localização proximal e associação frequente com lesões vasculares. A técnica “visão crítica de segurança” é preferida para a identificação dos ductos, e a colangiografia é frequentemente utilizada como complemento.
Diagnóstico e Tratamento
Menos de um terço das LDBs são detectadas durante a colecistectomia laparoscópica. A maioria é diagnosticada posteriormente, com sintomas inespecíficos como dor abdominal vaga, náuseas, vômitos e febre baixa. A colangiografia é o padrão-ouro para avaliação das LDBs, enquanto ultrassom e tomografia computorizada são úteis na detecção de coleções de fluido intra-abdominais e dilatações ductais. O manejo inclui a reparação precoce ou tardia, dependendo da extensão da lesão, experiência do cirurgião e equipe, inflamação e estabilidade hemodinâmica do paciente. A reparação imediata está associada a melhores desfechos, visando restaurar um conduto biliar durável e prevenir complicações como fístulas biliares, abscessos intra-abdominais, estenoses biliares, colangite recorrente e cirrose biliar secundária.
Considerações Finais
A cirurgia hepatobiliar exige uma abordagem cuidadosa e multidisciplinar para otimizar os resultados perioperatórios. Como dizia o grande cirurgião William Halsted: “A única maneira de alcançar a excelência na cirurgia é através de prática incansável e estudo contínuo.”
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#CirurgiaHepatobiliar #CuidadosPerioperatórios #DoençasHepáticas #EducaçãoMédica #SaúdeDigestiva
A Complexidade Oculta da Colecistectomia Laparoscópica: Morbimortalidade e Desafios Persistentes
A colecistectomia laparoscópica é um dos procedimentos cirúrgicos mais comuns nos Estados Unidos, com mais de 750.000 operações realizadas anualmente, das quais 55% ocorrem em ambiente ambulatorial. Embora considerada um procedimento rotineiro, a colecistectomia laparoscópica continua a apresentar uma morbidade significativa, chegando a quase 10% em análises nacionais que incluem procedimentos ambulatoriais e hospitalares. No Brasil, estima-se que aproximadamente 300.000 colecistectomias sejam realizadas anualmente, com uma crescente adoção da técnica laparoscópica devido aos seus benefícios clínicos.
Benefícios e Riscos Inerentes
Quando introduzida, a laparoscopia trouxe benefícios evidentes em comparação à colecistectomia aberta, com reduções imediatas em infecções de feridas e complicações graves como pneumonia e sepse. No entanto, o aumento na incidência de lesões de ducto biliar (LDB) também foi rapidamente reconhecido, com uma taxa inicial de aproximadamente 0,5%. Embora avanços no treinamento laparoscópico e medidas de segurança tenham reduzido essa incidência, os dados mais recentes indicam que a taxa de LDB tem se mantido estável em cerca de 0,1% a 0,3%, conforme relatado por grandes bases de dados nacionais como a GallRiks.
Impactos na Qualidade de Vida e Mortalidade
As lesões de ducto biliar são responsáveis por significativa morbidade e custos elevados de saúde. Estudos demonstram que pacientes com LDB apresentam piores índices psicológicos e de qualidade de vida a longo prazo. Uma análise retrospectiva revelou um aumento na mortalidade geral, de 8,8% para 20%, em pacientes com LDB no estado de Nova York. Outros estudos corroboram esses achados, mostrando uma maior taxa de mortalidade em um ano para aqueles que sofrem essa complicação. No Brasil, dados indicam que a taxa de mortalidade pós-colecistectomia laparoscópica é inferior a 0,1%, alinhando-se às estatísticas internacionais, mas ainda há variações regionais que necessitam de atenção e padronização.
Custos Econômicos e Implicações Legais
Além do impacto clínico, as LDBs acarretam custos financeiros significativos. Análises revelam um aumento de 126% nos pagamentos para pacientes com LDB em comparação aos sem LDB, devido à maior permanência hospitalar e à necessidade de múltiplos procedimentos. Estima-se que o custo de tratamento de uma LDB iatrogênica possa superar os $100,000. Esses incidentes também são a principal causa de litígios em cirurgias gastrointestinais, com 20-30% das LDBs laparoscópicas resultando em ações judiciais. No Brasil, embora os custos possam ser menores devido às diferenças nos sistemas de saúde, o impacto econômico e legal das complicações permanece significativo, com um número crescente de processos relacionados a erros médicos.
Complicações Além das Lesões de Ducto Biliar
As complicações gerais da colecistectomia laparoscópica são variadas e podem ser graves. Entre as complicações mais comuns estão infecções da ferida cirúrgica, que ocorrem em até 4% dos casos. Hemorragias intraoperatórias e pós-operatórias são reportadas em cerca de 1-2% dos pacientes. Outras complicações incluem lesões intestinais e vasculares, que podem ocorrer em aproximadamente 0,2% dos casos. A taxa de mortalidade associada à colecistectomia laparoscópica é baixa, em torno de 0,1%, mas pode aumentar significativamente em pacientes com complicações graves como sepse e falência múltipla de órgãos. No contexto brasileiro, estudos mostram taxas de complicações semelhantes, com variações de acordo com a experiência do cirurgião e a infraestrutura disponível.
Medidas de Prevenção para uma Colecistectomia Segura
A prevenção de complicações na colecistectomia laparoscópica requer uma abordagem multifacetada, incluindo:
- Treinamento e Capacitação: Cirurgiões devem receber treinamento extensivo em técnicas laparoscópicas, incluindo simulações e supervisão em procedimentos iniciais.
- Uso de Tecnologia Avançada: Ferramentas como colangiografia intraoperatória podem ajudar na visualização dos ductos biliares e na prevenção de LDBs.
- Identificação Crítica das Estruturas: A técnica do “Critical View of Safety” (CVS) é crucial para assegurar a identificação correta das estruturas anatômicas antes da dissecção.
- Monitoramento Intraoperatório: A vigilância constante durante a cirurgia, com monitoramento de sinais vitais e resposta do paciente, pode ajudar a identificar e corrigir problemas rapidamente.
- Protocolo de Segurança: Implementar protocolos padronizados de segurança, como listas de verificação pré-operatórias, pode reduzir erros e melhorar os resultados cirúrgicos.
Considerações Finais
Embora a colecistectomia laparoscópica seja amplamente realizada, ela continua associada a uma morbi-mortalidade significativa. Os dados, que incluem informações tanto de pacientes hospitalizados quanto ambulatoriais, corroboram estudos anteriores e ressaltam a necessidade contínua de vigilância e melhoria nos padrões de segurança deste procedimento. A taxa de complicações de quase 10% e a incidência persistente de LDB indicam que esforços adicionais são necessários para melhorar os resultados e reduzir os riscos.
Nota Histórica
“Cirurgia é uma ciência de incerteza e uma arte de probabilidade” – William Stewart Halsted.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#CirurgiaGeral #ColecistectomiaLaparoscópica #LesãoDuctoBiliar #Morbimortalidade #EducaçãoMédica
A história da PRIMEIRA COLECISTECTOMIA
A história da medicina é repleta de marcos que redefiniram os limites do conhecimento e da prática clínica. Um desses marcos é a primeira colecistectomia realizada por Karl Langenbuch, um episódio que não só alterou o tratamento das doenças da vesícula biliar, mas também estabeleceu novas diretrizes para a cirurgia abdominal. Esta narrativa explorará a evolução histórica da anatomia biliar, a biografia de Langenbuch, seus preparativos experimentais, o quadro clínico do primeiro paciente operado, e a importância histórica desse feito pioneiro.
Evolução Histórica do Conhecimento da Anatomia Biliar
Até o século XIX, o entendimento da anatomia biliar era rudimentar. A vesícula biliar era vista como um órgão de pouca importância, e seu papel na digestão não era totalmente compreendido. As investigações anatômicas e os avanços na técnica de dissecação, como os realizados por Andreas Vesalius no século XVI, foram cruciais para o entendimento da função e estrutura da vesícula biliar. No entanto, a verdadeira inovação veio com a descoberta das técnicas assépticas e a evolução dos conhecimentos cirúrgicos que permitiram a realização de procedimentos complexos como a colecistectomia.
Karl Langenbuch e a Primeira Colecistectomia
Karl Langenbuch, um cirurgião alemão, é amplamente reconhecido por realizar a primeira colecistectomia em 1882. Nascido em 1852, Langenbuch foi um pioneiro na cirurgia biliar, impulsionado por sua insatisfação com as opções de tratamento disponíveis para os pacientes com colecistite crônica e cálculos biliares. Observando que o tratamento conservador muitas vezes falhava, ele começou a explorar a remoção da vesícula biliar como uma solução definitiva. Langenbuch realizou experimentos em animais para testar a viabilidade da remoção da vesícula biliar, constatando que os animais sobreviviam sem ela. Essa descoberta, aliada à observação de casos de ausência congênita da vesícula biliar em humanos e outros animais, convenceu-o de que a remoção desse órgão era possível e segura.
Preparativos Experimentais e Técnicos
Antes de realizar a primeira colecistectomia humana, Langenbuch desenvolveu e refinou sua técnica através de dissecações anatômicas e operações experimentais em cadáveres e animais. Em 15 de julho de 1882, Langenbuch realizou a operação em Wilhelm Daniels, um paciente com colecistite crônica severa e dor debilitante, que havia se tornado dependente de morfina.
Evolução Perioperatória do Paciente
Internação e Preparativos
Wilhelm Daniels foi admitido no Hospital Lazarus em 10 de julho de 1882, cinco dias antes da cirurgia. Durante a internação, foram administrados laxantes e enemas para limpar o trato gastrointestinal, preparando o paciente para a operação. A dieta pré-operatória consistia em alimentos leves e líquidos, visando minimizar a carga sobre o sistema digestivo e reduzir o risco de complicações durante a cirurgia.
Durante a Cirurgia
A operação, que durou aproximadamente 90 minutos, foi realizada com uma técnica asséptica rigorosa, refletindo o compromisso de Langenbuch com a prevenção de infecções. A equipe cirúrgica incluía o assistente regular de Langenbuch, Dr. Lohlein, e o Professor F. Busch. O procedimento envolveu uma incisão oblíqua paralela à margem costal direita e um T vertical, cuidadosamente executado para acessar e remover a vesícula biliar, que estava significativamente dilatada e cheia de bile e cálculos biliares pequenos. O procedimento foi realizado com precisão, e a vesícula biliar foi removida com sucesso após a ligação e divisão do ducto cístico. A operação foi acompanhada por Dr. A. Martin, um ginecologista que também auxiliou no procedimento.
Pós-Operatório Imediato
No dia seguinte à operação, Langenbuch encontrou Daniels fumando um charuto e relatando a completa ausência de dor, um resultado surpreendente e positivo. O paciente foi monitorado de perto para sinais de complicações e recebeu cuidados de suporte, incluindo analgesia, para garantir uma recuperação confortável. A febre não foi observada, e o paciente foi mantido em repouso absoluto por 12 dias para promover a cicatrização adequada.
Alta Hospitalar e Recuperação
Após uma recuperação bem-sucedida e sem complicações, Wilhelm Daniels recebeu alta hospitalar após oito semanas. Durante sua estadia, ele recuperou 13,5 kg, e a dependência de morfina foi eliminada. A recuperação completa do paciente foi um testemunho da eficácia do procedimento e da habilidade de Langenbuch. O paciente relatou sentir-se totalmente curado e livre da dor debilitante que havia sofrido por anos.
Importância Histórica
A primeira colecistectomia não apenas provou a viabilidade do procedimento, mas também estabeleceu um novo padrão para o tratamento cirúrgico de doenças da vesícula biliar. A técnica de Langenbuch, embora inicialmente criticada, eventualmente se tornou um procedimento comum e essencial na cirurgia digestiva. A importância de seu trabalho é evidenciada pela evolução dos métodos de colecistectomia e a redução das complicações associadas à doença biliar.
Nota Histórica
“Um cirurgião não é apenas um artesão; ele é um cientista da vida e da morte. A habilidade técnica deve ser sempre acompanhada por um entendimento profundo da fisiologia e da anatomia.” – William Halsted
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #Colecistectomia #HistóriaDaCirurgia #AnatomiaBiliar #KarlLangenbuch #CirurgiaDigestiva
Prevenção da Lesão da Via Biliar Durante a Colecistectomia: Recomendações Gerais
A lesão da via biliar (LVB) é uma complicação grave que pode ocorrer durante a colecistectomia, resultando em significativa morbidade e impacto na qualidade de vida do paciente. A prevenção dessa complicação é essencial para garantir a segurança e o sucesso da cirurgia. Este artigo aborda as recomendações gerais para a prevenção da LVB, com base nas diretrizes atuais e melhores práticas em cirurgia.
Identificação Anatômica Clara
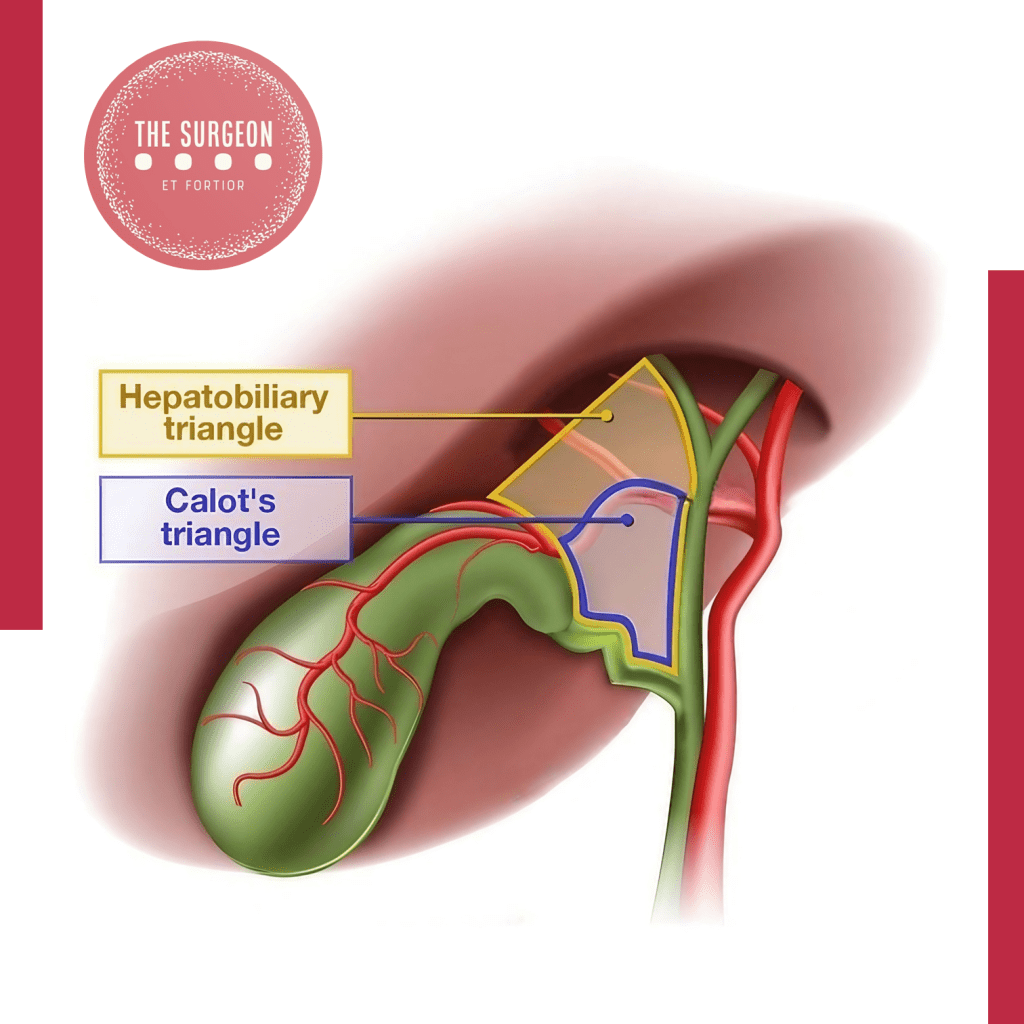
Um dos passos mais cruciais na prevenção da LVB é a identificação clara das estruturas anatômicas. A técnica do “triângulo de Calot”, que envolve a dissecção cuidadosa para visualizar a vesícula biliar, o ducto cístico e a artéria cística, é fundamental. Essa abordagem minimiza o risco de identificar erroneamente o ducto biliar comum como o ducto cístico.
Uso de Colangiografia Intraoperatória
A colangiografia intraoperatória é uma ferramenta valiosa para confirmar a anatomia biliar e detectar possíveis anomalias. Essa prática deve ser considerada, especialmente em casos complexos ou quando houver dúvida sobre a anatomia. Estudos demonstram que a colangiografia pode reduzir a incidência de LVB ao fornecer uma visualização detalhada da árvore biliar.
Formação e Treinamento Cirúrgico
A educação contínua e o treinamento são essenciais para manter a proficiência técnica. Workshops, simulações e o uso de tecnologias de realidade virtual podem ajudar os cirurgiões a aprimorar suas habilidades e aumentar a conscientização sobre os riscos de LVB. Programas de treinamento devem enfatizar a importância da identificação anatômica correta e do uso de técnicas seguras.
Revisão de Práticas Cirúrgicas
A revisão periódica das práticas cirúrgicas e a implementação de protocolos de segurança podem ajudar a reduzir a incidência de LVB. As instituições devem promover uma cultura de segurança e incentivar os cirurgiões a relatar e discutir complicações para aprendizado contínuo e melhoria dos procedimentos.
Abordagem Multidisciplinar
Em casos de LVB identificada intra ou pós-operatória, uma abordagem multidisciplinar é essencial. A colaboração entre cirurgiões, radiologistas e gastroenterologistas pode otimizar o manejo e reduzir as complicações associadas. A intervenção precoce e apropriada pode melhorar significativamente os desfechos para os pacientes.
Técnica do Critical View of Safety (CVS)
Introduzida em 1995, a técnica do Critical View of Safety (CVS) garante a abordagem mais segura para a colecistectomia ao promover o reconhecimento correto dos elementos da vesícula biliar, especialmente o triângulo hepatocístico (composto pelo ducto cístico, ducto biliar comum e fígado). A literatura demonstra que, quando o CVS é identificado, o risco de complicações intraoperatórias iatrogênicas é minimizado. Portanto, o uso rotineiro do CVS é recomendado em detrimento de outras técnicas, como a abordagem infundibular. No entanto, alcançar uma CVS completa é facilmente obtido em apenas 50% dos casos.
A lesão do ducto biliar comum é mais comum durante a curva de aprendizado inicial na colecistectomia laparoscópica (< 50 casos). Portanto, o uso do CVS pode ser de maior importância para treinandos e residentes; nesse cenário, o treinando ou residente deve assegurar o CVS, e o cirurgião supervisor deve confirmar o CVS antes que o ducto cístico e a artéria cística sejam ligados.
Procedimentos de Resgate
Sempre que um CVS não puder ser alcançado e a anatomia biliar não puder ser claramente definida, técnicas alternativas, como a abordagem “fundus-first” ou a colecistectomia subtotal (STC), devem ser consideradas. Estudos mostram que a técnica “fundus-first” está associada a taxas reduzidas de conversão e complicações iatrogênicas durante operações difíceis. No entanto, STC está associada a infecções significativas no local cirúrgico, necessidade de reintervenções e uma estadia hospitalar prolongada em comparação com a colecistectomia total.
Imagem Biliar Intraoperatória
A colangiografia intraoperatória (IOC) pode ser usada para reconhecer coledocolitíase e definir a anatomia biliar. No entanto, seu uso rotineiro não é aconselhável atualmente, pois não está associado a uma redução significativa nas taxas de complicações e LVBs durante a colecistectomia laparoscópica (LC). Alternativamente, a colangiografia com fluorescência de verde de indocianina (ICG-C) pode ser uma técnica útil para visualizar as estruturas do trato biliar sem a necessidade de imagem por raios X.
Considerações Finais
Prevenir a LVB requer um esforço conjunto de conhecimento anatômico, uso de tecnologias auxiliares e um compromisso contínuo com a educação e a prática segura. Os cirurgiões devem estar atentos aos sinais de risco e utilizar todas as ferramentas disponíveis para garantir a segurança do paciente.
Em 1924, o renomado cirurgião britânico Sir Berkeley Moynihan escreveu: “O cirurgião que falha em identificar corretamente as estruturas anatômicas durante uma operação corre o risco de causar mais mal do que benefício.” Essa máxima permanece verdadeira e reforça a importância da precisão e do cuidado na prática cirúrgica.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#PrevençãoDeLesão #ViaBiliar #CirurgiaGeral #Colecistectomia #EducaçãoMédica
Prevenção Terciária da Lesão da Via Biliar
A lesão do ducto biliar (LDB) durante a colecistectomia laparoscópica continua sendo um espectro que assombra cirurgiões em todo o mundo. Com uma incidência que varia de 0,5% a 0,9%, esta complicação, embora incomum, carrega consigo o potencial de alterar drasticamente o curso da vida de um paciente. O que torna este cenário ainda mais desafiador é o fato de que apenas um terço dessas lesões são detectadas intraoperatoriamente, deixando os dois terços restantes como bombas-relógio silenciosas, prontas para detonar no período pós-operatório.
A prevenção terciária da LDB refere-se às medidas tomadas após a ocorrência da lesão para minimizar suas consequências e otimizar os resultados para o paciente. Este é um território onde a experiência, o julgamento clínico e a habilidade técnica convergem para determinar o destino do paciente.
O primeiro pilar da prevenção terciária é o reconhecimento precoce. Estudos demonstram que o reparo precoce do ducto biliar (dentro de 72 horas após a lesão) está associado a uma estadia hospitalar mais curta e a uma melhor qualidade de vida do paciente. Além disso, os resultados a longo prazo após um reparo precoce têm se mostrado favoráveis.
O segundo pilar é a escolha do cirurgião e do centro para o reparo. A análise de Stewart e Way em 1995 revelou resultados significativamente superior quando o reparo foi realizado por um cirurgião experiente em cirurgia biliar em comparação com o cirurgião primário (94% vs 17% de sucesso). Isso sublinha a importância crucial de encaminhar o paciente a um centro especializado em cirurgia hepatobiliar quando a lesão é identificada.
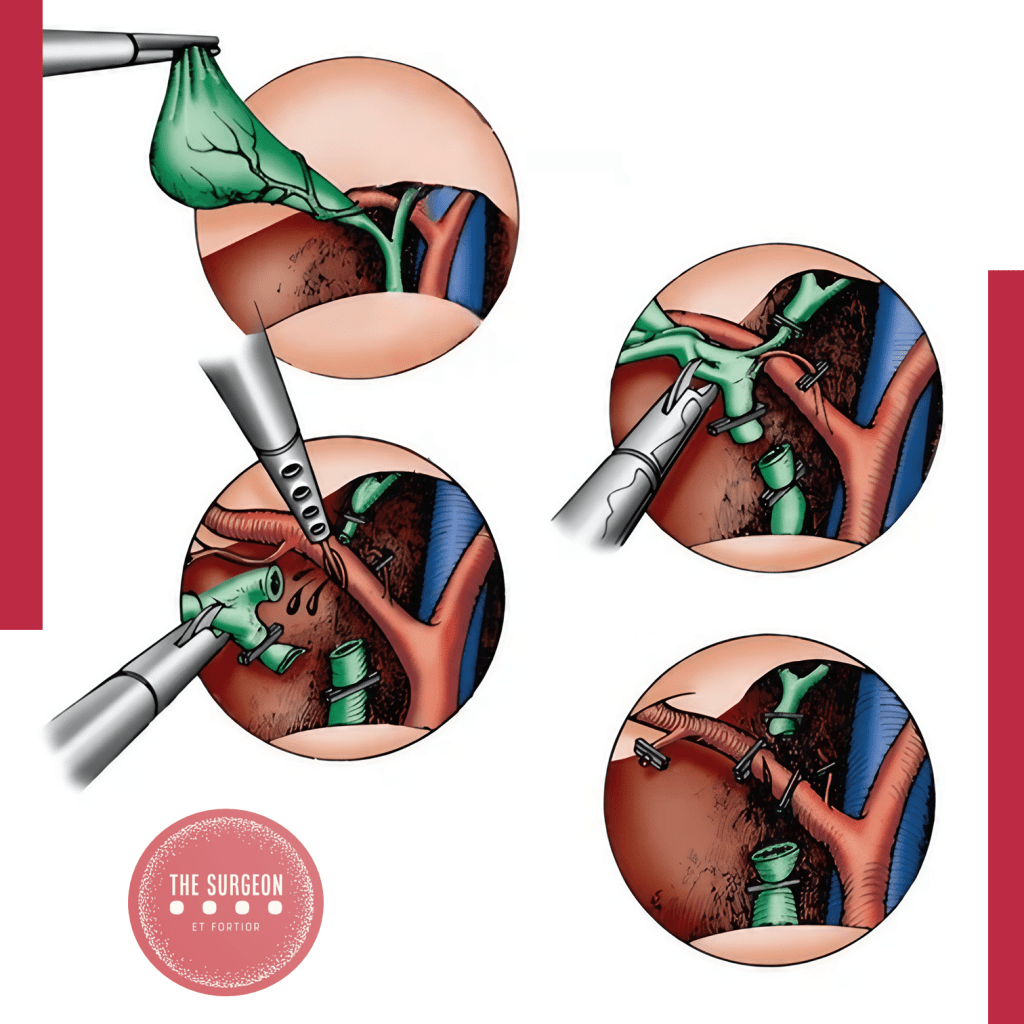
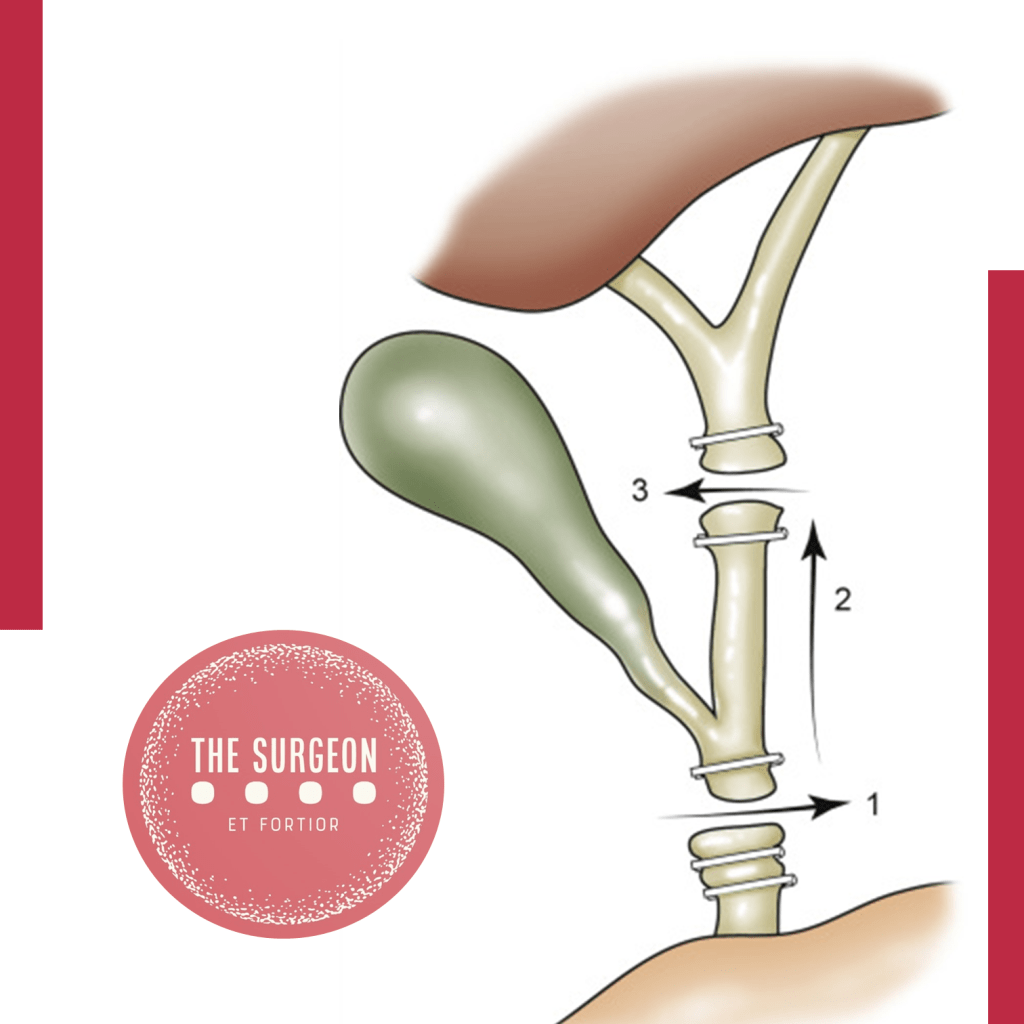
O terceiro pilar é a técnica cirúrgica adequada. A reconstrução biliar deve seguir princípios fundamentais: ser livre de tensão, utilizar segmentos de ducto bem vascularizados, garantir anastomose mucosa-mucosa e drenar todos os segmentos do fígado. A escolha entre anastomose ducto-ducto término-terminal e hepaticojejunostomia em Y de Roux deve ser feita com base na extensão e localização da lesão, bem como na experiência do cirurgião.
PRÍNCIPIOS TÉCNICOS DAS ANASTOMOSES BILIOENTÉRICAS
O quarto pilar é o manejo pós-operatório cuidadoso. Isso inclui a vigilância de complicações precoces, como vazamentos biliares e estenoses, bem como o acompanhamento a longo prazo para detectar complicações tardias.
É importante ressaltar que cada tentativa fracassada de reparo torna a cirurgia subsequente mais difícil e menos recompensadora. Portanto, a decisão de tentar um reparo ou encaminhar o paciente deve ser tomada com extrema cautela, sempre priorizando o melhor interesse do paciente.
Em conclusão, a prevenção terciária da lesão do ducto biliar é uma arte que demanda não apenas habilidade técnica, mas também humildade e sabedoria para reconhecer as próprias limitações. É um lembrete constante de que, na medicina, assim como na vida, às vezes o ato mais corajoso é pedir ajuda.
#LesãoDuctoBiliar #CirurgiaHepatobiliar #PrevençãoTerciária #ColecistectomiaLaparoscópica #EducaçãoCirúrgica
Nota histórica: William Stewart Halsted, pioneiro da cirurgia moderna, uma vez observou: “O cirurgião deve evitar cuidadosamente o ducto biliar comum, pois sua lesão é um dos acidentes mais graves que podem ocorrer durante uma operação na vesícula biliar.” Esta observação, feita há mais de um século, permanece pertinente até hoje, sublinhando a importância contínua da prevenção e do manejo cuidadoso das lesões biliares.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Lesão da Via Biliar: Inevitabilidade ou Evento Adverso?
A colecistectomia laparoscópica, procedimento que revolucionou a cirurgia biliar, trouxe consigo um dilema persistente: a lesão iatrogênica da via biliar. Este artigo examina a natureza dessa complicação, questionando se deve ser considerada um evento adverso inerente ou uma falha evitável.
Desde a introdução da colecistectomia laparoscópica há cerca de três décadas, a incidência de lesões do ducto biliar comum permanece estável, oscilando entre 0,4% e 0,7%. Este fato intrigante persiste apesar dos avanços tecnológicos, da padronização de técnicas e da crescente experiência dos cirurgiões.

A anatomia complexa da região hepatobiliar, combinada com as limitações inerentes à abordagem laparoscópica, cria um cenário propício para erros de percepção. O estudo seminal de Way e Hunter, analisando 252 casos de lesões biliares, revelou que 97% dessas lesões resultaram de ilusões de percepção visual, não de falhas técnicas ou de conhecimento.
Estratégias para mitigar o risco de lesão incluem a abordagem do infundíbulo, a “visão crítica de segurança”, a dissecção retrógrada e a colangiografia intraoperatória. No entanto, nenhuma dessas técnicas provou ser infalível. Surpreendentemente, mesmo a colangiografia, frequentemente considerada o padrão-ouro para identificação anatômica, falhou em prevenir ou detectar lesões em muitos casos.
A questão central permanece: devemos considerar a lesão da via biliar durante a colecistectomia laparoscópica como um risco inerente do procedimento ou como evidência de prática abaixo do padrão? A resposta não é simples e tem implicações significativas, tanto do ponto de vista médico quanto legal.
Argumenta-se que, se um cirurgião empregou todos os métodos reconhecidos para identificar a anatomia corretamente e ainda assim ocorreu uma lesão, isso não deve ser automaticamente rotulado como negligência. A cirurgia, afinal, é tanto uma arte quanto uma ciência, sujeita às limitações da percepção humana e às variabilidades anatômicas.
Por outro lado, a comunidade cirúrgica tem a responsabilidade de continuar buscando métodos para reduzir a incidência dessas lesões. Isso inclui treinamento avançado em anatomia biliar, simulações que reproduzam cenários desafiadores e educação contínua sobre os processos cognitivos envolvidos na tomada de decisão cirúrgica.
É crucial que os pacientes sejam plenamente informados sobre este risco específico. A conveniência e os benefícios da abordagem laparoscópica vêm com um pequeno, mas significativo, aumento no risco de lesão biliar em comparação com a cirurgia aberta tradicional.
Em conclusão, enquanto continuamos a debater se a lesão da via biliar durante a colecistectomia laparoscópica é um evento adverso inevitável ou uma complicação evitável, é imperativo que mantenhamos um equilíbrio entre a busca pela perfeição técnica e o reconhecimento das limitações humanas. Somente através de uma abordagem honesta e reflexiva poderemos avançar na segurança cirúrgica e na qualidade do cuidado ao paciente.

#LesãoViaBiliar #ColecistectomiaLaparoscópica #SegurançaCirúrgica #AnatomiaHepatobiliar #EducaçãoMédicaContinuada
“To study the phenomena of disease without books is to sail an uncharted sea, while to study books without patients is not to go to sea at all.” – William Osler
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Heurística da Lesão da Via Biliar: Um Desafio Cognitivo na Cirurgia Biliar
A lesão iatrogênica da via biliar durante a colecistectomia permanece um dos desafios mais complexos e devastadores na cirurgia do aparelho digestivo. Apesar dos avanços tecnológicos e da padronização de técnicas cirúrgicas, a incidência dessas lesões não diminuiu significativamente nas últimas décadas. Este fenômeno intrigante levanta questões fundamentais sobre os processos cognitivos envolvidos na tomada de decisão cirúrgica e na percepção anatômica durante procedimentos laparoscópicos.

A heurística, definida como atalhos mentais utilizados para simplificar a tomada de decisões complexas, desempenha um papel crucial na ocorrência de lesões da via biliar. O cirurgião, ao se deparar com a anatomia biliar, frequentemente recorre a mapas cognitivos baseados em experiências prévias. Estes mapas, embora geralmente úteis, podem levar a interpretações errôneas em situações de variabilidade anatômica ou inflamação severa.
Um dos fenômenos mais intrigantes neste contexto é a “ilusão do ducto biliar”. Esta ilusão ocorre quando a tração na vesícula biliar cria uma angulação no ducto biliar comum que se assemelha à junção entre o ducto cístico e a vesícula. Esta falsa percepção pode levar o cirurgião a posicionar incorretamente seu mapa cognitivo, resultando em dissecção no espaço errado e potencial lesão do ducto biliar comum.
A tecnologia laparoscópica, embora tenha revolucionado a cirurgia biliar, também introduz desafios perceptivos únicos. A visão bidimensional e o campo visual limitado podem exacerbar a desorientação espacial, tornando mais difícil para o cirurgião reconhecer marcos anatômicos cruciais.
As lesões do ducto biliar (LDBs) continuam sendo um problema persistente na colecistectomia, apesar dos esforços para reduzi-las. As causas das LDBs são complexas e envolvem múltiplos fatores, incluindo a proximidade anatômica das estruturas, a variabilidade na anatomia, as limitações das visões laparoscópicas e os vieses cognitivos e erros na percepção e julgamento do cirurgião.
A teoria cognitiva moderna nos oferece insights valiosos para compreender este fenômeno. O pensamento do Sistema 1 (rápido, automático) versus o Sistema 2 (lento, deliberado) desempenha um papel crucial na tomada de decisões cirúrgicas. O uso de heurísticas e mapas cognitivos pelos cirurgiões, embora eficiente na maioria das situações, pode levar a erros críticos quando aplicado inadequadamente.
Vários fatores colocam o ducto biliar “em risco” durante a cirurgia. A proximidade e variabilidade anatômica são fatores primários, mas a experiência limitada de alguns cirurgiões com a anatomia do porta hepatis também contribui significativamente. As limitações da visão laparoscópica e da consciência espacial, juntamente com as distrações do ambiente da sala de operações, aumentam ainda mais o risco de lesões.
Falhas perceptivas podem ocorrer de várias formas durante a cirurgia. A má interpretação dos marcos anatômicos é uma armadilha comum, especialmente quando combinada com a “ilusão do ducto biliar”, onde o ducto biliar comum é confundido com o ducto cístico. Isso pode levar ao posicionamento incorreto do mapa cognitivo do cirurgião no espaço anatômico errado, um erro que pode ter consequências devastadoras.
Além disso, vieses cognitivos como o viés de confirmação e a fixação cognitiva podem impedir a correção de erros uma vez iniciados. O cirurgião pode inconscientemente interpretar informações subsequentes de maneira a confirmar sua percepção inicial equivocada, perpetuando assim o erro. O viés em direção à ação ou decisão, a fixação cognitiva e a crença nas primeiras impressões são outros fatores que podem impedir a correção oportuna de erros.
Para mitigar estes riscos, é crucial desenvolver estratégias que abordem tanto os aspectos técnicos quanto os cognitivos da cirurgia biliar. Estas incluem:
- Treinamento avançado em anatomia biliar, incluindo variações comuns.
- Simulações que reproduzam a “ilusão do ducto biliar” e outras armadilhas perceptivas.
- Implementação de “time-outs” intraoperatórios para reavaliação anatômica.
- Educação em psicologia cognitiva e reconhecimento de vieses para cirurgiões.
- Desenvolvimento de protocolos de “parada” quando a anatomia não está clara.
Além disso, propõe-se uma série de soluções para abordar esses desafios. A melhoria da educação anatômica e do treinamento em simulação é fundamental, com ênfase especial no ensino do reconhecimento da “ilusão do ducto biliar”. O treinamento em psicologia cognitiva e prevenção de erros deve ser incorporado aos programas de residência cirúrgica.

Mudanças sistêmicas para otimizar o ambiente da sala de operações também são cruciais. Isso pode incluir a redução de distrações, a melhoria da ergonomia e a implementação de protocolos de segurança mais rigorosos. Técnicas como o “time-out do ducto biliar” para confirmar marcos anatômicos antes da dissecção crítica podem ajudar a prevenir erros.
Finalmente, é essencial incentivar o uso de “regras de parada” quando a anatomia não está clara. Isso envolve cultivar uma cultura cirúrgica que valorize a prudência e a segurança acima da velocidade ou do orgulho profissional. Os cirurgiões devem ser encorajados a pedir ajuda, converter para cirurgia aberta ou adiar o procedimento quando confrontados com anatomia incerta ou situações de alto risco.
A compreensão da heurística da lesão da via biliar não apenas melhora a segurança cirúrgica, mas também oferece insights valiosos sobre os processos cognitivos humanos em ambientes de alta complexidade e pressão. Ao abordar tanto os aspectos técnicos quanto os psicológicos da cirurgia biliar, podemos esperar uma redução significativa nas lesões do ducto biliar e uma melhoria geral nos resultados para os pacientes.
Em conclusão, a prevenção de lesões do ducto biliar requer uma abordagem multifacetada que combine excelência técnica, compreensão profunda da anatomia, consciência dos processos cognitivos e um compromisso inabalável com a segurança do paciente. Somente através desses esforços combinados poderemos esperar superar este desafio persistente na cirurgia biliar.
#LesãoViaBiliar #HeurísticaCirúrgica #CirurgiaLaparoscópica #EducaçãoCirúrgica #SegurançaDosPacientes
“To study the phenomena of disease without books is to sail an uncharted sea, while to study books without patients is not to go to sea at all.” – William Osler
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Visão Crítica de Segurança
A colecistectomia laparoscópica é um procedimento amplamente adotado, mas que, infelizmente, apresenta uma taxa aumentada de lesões biliares em comparação com a colecistectomia aberta. Mesmo após mais de uma década desde sua introdução nos Estados Unidos, a lesão do ducto biliar continua a ser um problema significativo, ocorrendo até mesmo em cirurgiões experientes e altamente competentes. Este artigo aborda a importância da “Visão Crítica de Segurança” na prevenção dessas lesões, oferecendo insights valiosos para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
A Complexidade das Lesões Biliares
As lesões biliares durante a colecistectomia laparoscópica geralmente resultam de erros de visualização durante a dissecção. Um dos métodos originais para identificar o ducto cístico envolve a técnica “infundibular”, onde o ducto cístico é dissecado nos aspectos anterior e posterior do triângulo de Calot. No entanto, essa técnica pode levar à identificação errônea do ducto biliar comum como o ducto cístico, especialmente em casos de colecistite aguda, onde o ducto cístico pode estar oculto sob uma massa inflamatória.

Técnica da Visão Crítica de Segurança
A “Visão Crítica de Segurança” é uma técnica alternativa que visa clarear completamente o triângulo de Calot de tecido fibroso e gorduroso, de modo que as únicas estruturas visíveis sejam o ducto cístico e a artéria cística. Após essa dissecção, a base do fígado (segmento IV) deve ser visível, sem outras estruturas atravessando em direção à vesícula biliar. Se isso não puder ser alcançado, a dissecção deve ser interrompida e a colangiografia deve ser realizada para definir a anatomia, ou a cirurgia deve ser convertida para uma colecistectomia aberta.


Importância da Colangiografia Intraoperatória (CIO)
A CIO é uma ferramenta crucial na prevenção de lesões biliares, pois permite a visualização clara da anatomia biliar. No entanto, se a dissecção inicial isola erroneamente o ducto biliar comum, a CIO pode resultar em uma coledocotomia desnecessária. É vital que o cirurgião interprete corretamente a CIO, visualizando todos os ductos proximais para evitar a ligadura errônea do ducto biliar comum.

Prática Segura e Prevenção de Lesões
Dissecar cuidadosamente a junção do pescoço da vesícula biliar com o ducto cístico é o fator mais importante para definir a anatomia e prevenir lesões biliares. A técnica da “Visão Crítica de Segurança” minimiza o risco de lesão inadvertida ao garantir que apenas o ducto cístico e a artéria cística estejam presentes no triângulo de Calot antes de qualquer corte.
Conclusão
Adotar a “Visão Crítica de Segurança” na colecistectomia laparoscópica é fundamental para reduzir as taxas de lesões biliares. Esta técnica garante uma identificação precisa da anatomia, evitando erros técnicos comuns que podem levar a complicações graves. A vigilância contínua e a adaptabilidade dos cirurgiões são essenciais para a implementação dessas estratégias preventivas.
Nas palavras de Sir William Osler, “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” À medida que buscamos prevenir lesões no ducto biliar, lembremo-nos da importância da precisão e vigilância em cada procedimento cirúrgico.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Palavras-chave: Visão Crítica de Segurança, colecistectomia laparoscópica, lesão do ducto biliar, triângulo de Calot, colangiografia intraoperatória
#CirurgiaLaparoscópica #VisãoCríticaDeSegurança #LesãoDoDuctoBiliar #EducaçãoMédica #Colecistectomia
Etapas de Prevenção da Lesão Biliar na Colecistectomia Laparoscópica
A colecistectomia laparoscópica é uma técnica amplamente utilizada para tratar doenças da vesícula biliar, sendo realizada aproximadamente 750.000 vezes por ano nos Estados Unidos. Apesar dos benefícios de ser uma técnica minimamente invasiva, a colecistectomia laparoscópica apresenta desafios, incluindo um risco aumentado de lesões no ducto biliar. Este artigo fornece uma visão educacional sobre as estratégias de prevenção dessas lesões, voltado para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Compreendendo a Complexidade das Lesões no Ducto Biliar (LDB)
As lesões no ducto biliar frequentemente resultam de uma série de decisões tomadas em cenários complexos e heterogêneos. A prevenção dessas lesões justifica-se plenamente, dadas as consequências catastróficas que podem causar. Estratificamos a prevenção de LDB em quatro níveis clássicos: prevenção primária, secundária, terciária e quaternária.
Prevenção Primária
A prevenção primária é o nível mais importante, visando evitar a ocorrência de LDB. Isso é alcançado realizando a cirurgia corretamente, identificando bem a anatomia regional através da “Visão Crítica de Segurança”, realizando manobras hemostáticas seguras, utilizando Colangiografia Intraoperatória (CIO) e tendo um baixo limiar para interromper a cirurgia e realizar procedimentos alternativos, se necessário.
Treinamento adequado é essencial para prevenir primariamente uma LDB. Embora a curva de aprendizado da colecistectomia laparoscópica seja difícil de alcançar ao final da residência, é fundamental que os trainees sejam sempre cautelosos e humildes. Estudos mostram que a curva de aprendizado reduz as lesões associadas (> 50 casos), mas não elimina aquelas que ocorrem após a realização de muitas cirurgias, conhecidas como “lesões de especialistas” (> 200 casos).
A CIO desempenha um papel crucial na prevenção de lesões, diagnóstico intraoperatório e prevenção de lesões complexas, pois permite uma identificação mais clara da anatomia, evitando dissecções errôneas. Estudos populacionais mostram que a taxa de LDB é duas vezes maior em populações onde a CIO não é rotineiramente utilizada. Além disso, a colangiografia por fluorescência representa uma alternativa promissora, utilizando substâncias fluorescentes como a Indocianina Verde, que permitem a identificação dos ductos biliares sem dissecção prévia, melhorando a interpretação da anatomia.
Procedimentos alternativos, como colecistectomia subtotal ou parcial, são válidos em casos de processos inflamatórios avançados com anatomia regional obscura. No entanto, é importante lembrar que a conversão para cirurgia aberta aumenta o risco de LDB, especialmente em cenários de hemorragia e inflamação avançada.
Prevenção Secundária
A prevenção secundária refere-se ao diagnóstico precoce de LDB para limitar seus efeitos deletérios. O diagnóstico intraoperatório de lesões é essencial para evitar a progressão de lesões não percebidas, que são as mais ameaçadoras para os pacientes. Nesses casos, a CIO é indispensável para facilitar o diagnóstico e evitar danos adicionais às estruturas do hilo hepático.
Prevenção Terciária
A prevenção terciária envolve a instalação de terapias apropriadas e oportunas para evitar complicações e sequelas após os procedimentos de reparo. O cirurgião deve avaliar se está adequadamente equipado para realizar uma CIO eficaz, se sente-se confortável para realizar um reparo primário ou uma anastomose biliodigestiva, ou se seria melhor concluir a cirurgia e encaminhar o paciente para um centro terciário.
Prevenção Quaternária
A prevenção quaternária é um conceito mais contemporâneo, referindo-se às atividades realizadas para evitar, reduzir ou mitigar os danos causados pela exposição ao sistema de saúde. No caso das LDB, isso inclui evitar a exposição do paciente ao risco de sofrer uma lesão, discutindo as indicações para a colecistectomia laparoscópica com mais especificidade.
Conclusão
Prevenir lesões no ducto biliar durante a colecistectomia laparoscópica exige uma abordagem multifacetada, integrando imagens de alta qualidade, técnicas de dissecção cuidadosas e uma consciência aumentada das variações anatômicas. A vigilância contínua e a adaptabilidade dos cirurgiões são essenciais para a implementação dessas estratégias preventivas.
Nas palavras de Sir William Osler, “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” À medida que buscamos prevenir lesões no ducto biliar, lembremo-nos da importância da precisão e vigilância em cada procedimento cirúrgico.

Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Palavras-chave: Colecistectomia laparoscópica, prevenção de lesões no ducto biliar, técnicas cirúrgicas, triângulo de Calot, colangiografia intraoperatória
#CirurgiaLaparoscópica #LesãoDoDuctoBiliar #EducaçãoCirúrgica #Colecistectomia #CuidadosPreventivos
Colecistectomia Segura Laparoscópica
A colecistectomia laparoscópica é um procedimento fundamental na cirurgia moderna, com aproximadamente 750.000 operações realizadas anualmente nos Estados Unidos. Embora a natureza minimamente invasiva dessa técnica ofereça inúmeros benefícios, ela também apresenta desafios únicos, incluindo um risco aumentado de lesões graves no ducto biliar em comparação com a colecistectomia aberta. Este artigo tem como objetivo fornecer uma visão educacional das estratégias para prevenir essas lesões, voltado para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.


Compreendendo o Risco
Apesar da experiência adquirida ao longo dos anos de prática, as lesões no ducto biliar ocorrem em uma taxa relativamente constante. Estudos indicam que a colecistectomia laparoscópica tem uma incidência mais alta de lesões graves no ducto biliar (0,5%) em comparação com a colecistectomia aberta (0,1-0,2%). A principal causa dessas lesões é a identificação errônea do ducto biliar comum (CBD) como o ducto cístico, agravada pelo ambiente visual alterado e pela perda de feedback tátil na cirurgia laparoscópica.
Principais Estratégias Preventivas
Otimização da Imagem
A imagem de alta qualidade é crucial. Utilizar um endoscópio angulado (30° ou 45°) pode proporcionar uma melhor visualização. Comece dissecando o triângulo de Calot para identificar claramente o ducto cístico. Certifique-se de que o ducto cístico possa ser rastreado ininterruptamente até a base da vesícula biliar.
Etapas Iniciais de Dissecação
Abra os planos teciduais entre a vesícula biliar e o suposto ducto cístico. Se a anatomia estiver obscura ou se houver suspeita de uma anomalia biliar, prossiga com cautela e considere a realização de colangiogramas operatórios liberais. Evite colocar clipes em estruturas que não estejam totalmente mobilizadas e converta para um procedimento aberto se necessário.


Reconhecendo e Respondendo aos Sinais de Alerta
Certos achados intraoperatórios devem levantar a suspeita de uma possível lesão no ducto biliar. Estes incluem:
- A necessidade de mais de oito clipes, indicando sangramento excessivo.
- Um ducto não totalmente abarcado por um clipe padrão de 9 mm.
- Encontro de estruturas linfáticas ou vasculares extras.
- Presença de uma grande artéria atrás do ducto, sugerindo que pode ser a artéria hepática direita posterior ao CBD.
Gerenciamento de Ilusões Anatômicas
O processamento visual na cirurgia laparoscópica pode levar a ilusões anatômicas convincentes. Os cirurgiões devem estar cientes de que experiência, conhecimento e habilidade técnica por si só são insuficientes para proteger contra a identificação errônea dos ductos. Aplicar consistentemente a visão crítica de segurança e utilizar colangiogramas operatórios pode mitigar esses riscos.


Ênfase Educacional
A prevenção de lesões no ducto biliar requer uma abordagem multifacetada, integrando imagens de alta qualidade, técnicas de dissecação cuidadosas e uma maior consciência das variações anatômicas. Os cirurgiões devem permanecer vigilantes e adaptáveis, atualizando continuamente suas técnicas com base nas pesquisas mais recentes e diretrizes clínicas.
Nas palavras de Sir William Osler, “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” Enquanto nos esforçamos para prevenir lesões no ducto biliar, lembremo-nos da importância da precisão e vigilância em cada procedimento cirúrgico.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Palavras-chave: Colecistectomia laparoscópica, prevenção de lesões no ducto biliar, técnicas cirúrgicas, triângulo de Calot, colangiograma operatório
#CirurgiaLaparoscópica #LesãoDoDuctoBiliar #EducaçãoCirúrgica #Colecistectomia #CuidadosPreventivos
Prevenção de Lesões do Ducto Biliar
A compreensão das lesões do ducto biliar durante colecistectomias laparoscópicas exige uma análise aprofundada não apenas das técnicas cirúrgicas, mas também dos fatores humanos e da psicologia cognitiva envolvidos. Este texto destina-se a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, oferecendo uma visão abrangente e científica sobre como a integração dessas disciplinas pode contribuir para a prevenção de lesões iatrogênicas.
Mecanismos e Classificação das Lesões do Ducto Biliar
Lesões do ducto biliar são uma complicação séria e muitas vezes evitável da colecistectomia laparoscópica. Elas podem ser classificadas em diferentes classes baseadas na anatomia lesada e na técnica cirúrgica empregada. Entre as classificações mais comuns, destacam-se:
- Classe I: Dano ao ducto colédoco (CBD) confundido com o ducto cístico.
- Classe II: Dano ao ducto hepático comum (CHD).
- Classe III: Lesão de ramos biliares direitos ou esquerdos.
- Classe IV: Dano simultâneo a múltiplos ductos biliares.
A compreensão detalhada dessas classificações permite aos cirurgiões identificar e mitigar riscos específicos durante a cirurgia.
Fatores Humanos e Psicologia Cognitiva
Os fatores humanos referem-se ao estudo de como os seres humanos interagem com os elementos de um sistema. Na cirurgia, isso inclui a interação entre o cirurgião, a equipe médica, os instrumentos cirúrgicos e o ambiente operatório. A psicologia cognitiva, por sua vez, estuda os processos mentais envolvidos na percepção, memória, julgamento e tomada de decisão.
Vieses Cognitivos: Um aspecto crítico da psicologia cognitiva são os vieses que afetam o julgamento clínico. O “confirmation bias” (viés de confirmação), por exemplo, ocorre quando um cirurgião interpreta dados de forma a confirmar suas expectativas pré-existentes, potencialmente levando a erros.
Estresse e Desempenho: O estresse é um fator significativo que pode comprometer a performance cirúrgica. Modelos como o “Yerkes-Dodson Law” indicam que um nível moderado de estresse pode melhorar o desempenho, mas níveis excessivos levam a um declínio acentuado.
Ilusões Anatômicas: Ilusões anatômicas são um perigo constante, mesmo para cirurgiões experientes. A confiança excessiva na habilidade técnica sem uma verificação constante pode resultar em erros críticos. A conscientização contínua sobre a possibilidade de tais ilusões é crucial para a segurança do paciente.

Estratégias de Prevenção
Educação e Treinamento: Programas de treinamento contínuo que enfatizam a importância do reconhecimento precoce de anatomias variantes e a prática da colangiografia intraoperatória são fundamentais. A colangiografia permite a visualização direta das vias biliares, ajudando a confirmar a anatomia antes da dissecção.
Checklists Cirúrgicos: A implementação de checklists cirúrgicos, como os desenvolvidos pela Organização Mundial da Saúde (OMS), pode melhorar a comunicação dentro da equipe cirúrgica e garantir que todos os passos críticos sejam seguidos.
Simulação e Prática Deliberada: A utilização de simulações realistas para praticar procedimentos complexos e lidar com complicações inesperadas permite aos cirurgiões aprimorar suas habilidades em um ambiente seguro e controlado.
Ambiente Operacional: Melhorias no ambiente cirúrgico, incluindo iluminação adequada, disposição ergonômica dos instrumentos e minimização de distrações, podem ajudar a reduzir o risco de lesões.
Regras Práticas para Prevenir Lesões do Ducto Biliar
Otimização da Imagem:
- Use equipamentos de imagem de alta qualidade.
Passos Iniciais e Objetivos:
- Utilize o triângulo de Calot para orientação antes de iniciar a dissecção; encontre o ducto cístico começando pelo triângulo.
- Puxe o infundíbulo da vesícula biliar lateralmente para abrir o triângulo de Calot.
- Limpe a parede medial do infundíbulo da vesícula biliar.
- Assegure que o ducto cístico possa ser traçado ininterruptamente até a base da vesícula biliar.
- Abra qualquer plano tecidual sutil entre a vesícula biliar e o presumido ducto cístico; o verdadeiro ducto cístico pode estar escondido ali.
Fatores que Sugerem que se Está Dissecando o Ducto Comum em Vez do Ducto Cístico:
- O ducto quando clipado não é totalmente englobado por um clipe padrão M/L (9 mm).
- Qualquer ducto que possa ser traçado sem interrupção até passar atrás do duodeno é provavelmente o CBD.
- A presença de outra estrutura ductal inesperada.
- Uma artéria grande atrás do ducto – a artéria hepática direita corre posteriormente ao CBD.
- Estruturas linfáticas e vasculares extras encontradas na dissecção.
- Os ductos hepáticos proximais não opacificam nas colangiografias operatórias.
Obtenção Liberal de Colangiografias Operatórias:
- Sempre que a anatomia for confusa.
- Quando a inflamação e as aderências resultarem em uma dissecção difícil.
- Sempre que uma anomalia biliar for suspeita; assuma que o que parece ser uma anatomia anômala é realmente normal e confusa até ser provada por colangiografias.
Evitar Lesões Não Intencionais nas Estruturas Ductais:
- Apenas coloque clipes em estruturas que estão totalmente mobilizadas; a ponta de um clipe fechado não deve conter tecido.
- A necessidade de mais de oito clipes sugere que a operação pode ser sangrenta o suficiente para justificar a conversão para um procedimento aberto.
- A consideração da necessidade de transfusão de sangue sugere que a operação deve ser convertida para um procedimento aberto.
- Abra quando a inflamação ou o sangramento obscurecer a anatomia.
Aspectos Humanos na Cirurgia
Além dos fatores técnicos, é fundamental considerar os aspectos humanos que podem influenciar o desempenho cirúrgico. A fadiga, o estresse emocional, a pressão do tempo e a dinâmica de equipe são fatores que podem aumentar a probabilidade de erros. A promoção de um ambiente de trabalho saudável e a implementação de práticas que reduzem o estresse, como pausas regulares e suporte psicológico, podem contribuir significativamente para a segurança do paciente.
Conclusão
A integração dos princípios dos fatores humanos e da psicologia cognitiva na prática cirúrgica é vital para a prevenção de lesões do ducto biliar durante colecistectomias laparoscópicas. Cirurgiões bem treinados, cientes de seus próprios vieses e operando em ambientes otimizados, são mais propensos a realizar cirurgias seguras e eficazes. Como William Osler disse: “A medicina é uma ciência da incerteza e uma arte da probabilidade.”
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaDigestiva #LesãoDuctoBiliar #FatoresHumanos #PsicologiaCognitiva #PrevençãoCirúrgica
Colecistectomia Laparoscópica
A colecistectomia laparoscópica, estabelecida nas últimas duas décadas como o padrão-ouro para o tratamento da colelitíase, apresenta desafios significativos quando complicações ocorrem. Embora a maioria dos procedimentos seja realizada sem intercorrências, situações complexas exigem do cirurgião uma compreensão profunda da anatomia cirúrgica e das técnicas de manejo de complicações. Este texto abordará os principais desafios da colecistectomia laparoscópica complicada, direcionado a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Desafios Anatômicos
O triângulo hepatocístico, formado pela vesícula biliar, o ducto hepático comum e o fígado, é uma estrutura anatômica crítica na colecistectomia. A dissecção inadequada desta região pode resultar em lesões graves. A artéria cística, originando-se geralmente da artéria hepática direita, pode apresentar variações anatômicas, incluindo sua origem de uma artéria hepática direita aberrante, complicando a identificação e ligadura. A placa cística, área fibrosa sobre a qual a vesícula biliar se assenta, é outra região crucial. Pequenos ductos biliares, os ductos de Luschka, podem penetrar na vesícula e causar vazamento biliar se lesados. Em cerca de 10% dos pacientes, um ducto biliar periférico grande se localiza imediatamente abaixo da placa cística, aumentando o risco de lesão.
Prevenção da Lesão da Via Biliar
Aspectos Anatômicos
Compreender a complexidade anatômica da árvore biliar é essencial para a prevenção de lesões. O triângulo de Calot é um ponto chave onde a artéria cística e o ducto cístico se encontram. A “vista crítica de segurança” deve ser alcançada antes de qualquer ligadura ou corte, o que implica na identificação clara de duas e somente duas estruturas (ducto cístico e artéria cística) entrando na vesícula biliar. Além disso, é fundamental reconhecer variações anatômicas comuns, como a presença de uma artéria hepática direita acessória ou a confluência baixa do ducto cístico com o ducto hepático comum. A colangiografia intraoperatória pode auxiliar na confirmação da anatomia biliar e na prevenção de lesões inadvertidas.


Técnicas Cirúrgicas
- Dissecção Cuidadosa: Utilizar técnicas de dissecção romba e aguda para separar os tecidos no triângulo de Calot. Evitar o uso excessivo de eletrocautério próximo ao ducto biliar comum para minimizar o risco de lesão térmica.
- Vista Crítica de Segurança: Antes de ligar ou cortar qualquer estrutura, garantir que duas e apenas duas estruturas estão claramente identificadas entrando na vesícula biliar. Esta técnica reduz significativamente a incidência de lesões do ducto biliar.
- Colangiografia Intraoperatória (IOC): A IOC é uma ferramenta valiosa para mapear a anatomia biliar durante a cirurgia. Sua utilização regular pode ajudar na identificação de variações anatômicas e na confirmação do trajeto dos ductos biliares, prevenindo lesões inadvertidas.
- Exposição Adequada: Posicionar o paciente de forma que o fígado seja elevado e a vesícula biliar fique bem exposta. Utilizar tração adequada para visualizar claramente a anatomia biliar.
- Conversão para Laparotomia: Se a anatomia não puder ser claramente identificada laparoscopicamente ou se ocorrerem complicações, a conversão para cirurgia aberta deve ser considerada prontamente para assegurar a segurança do paciente.
Complicações e Manejo
Lesões do Ducto Biliar Comum (CBD)
As lesões do CBD são mais frequentes na colecistectomia laparoscópica (0,1% a 0,5%) em comparação com a aberta (0,2%). A perda de feedback tátil, a identificação incorreta da anatomia e o uso indevido de cautério contribuem para esse risco. A prevenção envolve técnicas de dissecção adequadas e obtenção da “vista crítica de segurança” antes de aplicar clipes no ducto cístico. Se a anatomia for difícil de visualizar, a colangiografia intraoperatória (IOC) é recomendada.

Sangramento
O sangramento, particularmente no acesso inicial ao abdômen, pode ser fatal. Hemorragias na região da porta hepatis não devem ser tratadas laparoscopicamente; a conversão para laparotomia é muitas vezes necessária. Pequenas hemorragias podem ser controladas com clipes ou eletrocautério, mas é essencial garantir que estruturas vitais não foram lesadas.
Lesões Intestinais
Lesões intestinais podem ocorrer durante a criação do acesso abdominal, adesiólise ou dissecção da vesícula biliar. A lesão por eletrocirurgia deve ser reparada com sutura cuidadosa. A incidência de lesão visceral ou vascular por trocar ou agulha de Veress é de 0,2%.
Contaminação por Cálculo Biliar
O derramamento de cálculos biliares deve ser evitado. Pequenas pedras podem ser deixadas no abdômen sem preocupação, mas grandes pedras ou bile infectada exigem remoção cuidadosa. Em caso de derramamento significativo, a conversão para cirurgia aberta pode ser necessária para evitar abscessos intra-abdominais.
Cuidados Pós-Operatórios
Após uma colecistectomia laparoscópica não complicada, os cuidados pós-operatórios são simples. Os pacientes podem iniciar uma dieta líquida clara assim que acordam e, se não houver náuseas, passar para uma dieta regular. Alta hospitalar é geralmente possível poucas horas (24h) após a cirurgia. No entanto, os pacientes e seus familiares devem estar cientes de possíveis complicações pós-operatórias, como vazamento biliar, sangramento, pancreatite, perfuração intestinal, infecção da ferida e íleo.
Considerações Finais
A colecistectomia laparoscópica, apesar de ser um procedimento amplamente realizado, não está isenta de complicações. A familiaridade com a anatomia cirúrgica e a aplicação de técnicas de dissecção seguras são essenciais para minimizar riscos. Além disso, o manejo adequado das complicações, quando ocorrem, é crucial para garantir a segurança do paciente e o sucesso do procedimento.
“Primum non nocere” – Hipócrates
Hashtags
#CirurgiaDigestiva #Colecistectomia #CirurgiaMinimamenteInvasiva #SegurançaCirúrgica #EducaçãoMédica
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Colecistectomia Subtotal: Uma Abordagem Segura para Situações Complexas
Introdução
A colecistectomia subtotal tem ganhado destaque como uma técnica cirúrgica vital em casos de colecistite severa, onde a dissecção completa da vesícula biliar é dificultada por inflamação intensa ou aderências extensas. Esta técnica é particularmente útil para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo que buscam compreender abordagens alternativas em situações desafiadoras.
O que é Colecistectomia Subtotal?
A colecistectomia subtotal é uma técnica onde parte da vesícula biliar é deixada in situ, seja devido à dificuldade técnica ou risco aumentado de complicações ao tentar remover a vesícula biliar completamente. Existem duas variações principais: a colecistectomia subtotal fenestrada e a colecistectomia subtotal reconstituinte.

Vantagens e Desvantagens das Técnicas Subtotais
Fenestrada vs. Reconstituinte
A técnica fenestrada envolve deixar a base da vesícula biliar aberta para a cavidade peritoneal, enquanto a técnica reconstituinte fecha o lúmen da vesícula biliar na bolsa de Hartmann.
Vantagens da Técnica Fenestrada:
- Menor probabilidade de formar um remanescente da vesícula biliar.
- Redução da incidência de fístula biliar, que geralmente se resolve espontaneamente.
- Facilidade na drenagem de secreções biliares remanescentes.
Desvantagens da Técnica Fenestrada:
- Maior risco de fístulas biliares pós-operatórias, embora a maioria resolva sem intervenção.
Vantagens da Técnica Reconstituinte:
- Menor incidência de fístulas biliares imediatas.
- Fechamento seguro do lúmen, reduzindo o risco de vazamento biliar.
Desvantagens da Técnica Reconstituinte:
- Possibilidade de formação de remanescente da vesícula biliar, potencialmente sintomático a longo prazo.
- Requer maior habilidade técnica para fechar o lúmen da vesícula biliar de maneira eficaz.
Procedimento Cirúrgico
A técnica moderna de colecistectomia subtotal envolve abrir a vesícula biliar ao longo de seu eixo longitudinal e remover todas as pedras. O lúmen é cuidadosamente drenado e pode ser considerado o uso de colangiografia intraoperatória para visualizar possíveis pedras no ducto biliar comum. No caso da técnica fenestrada, a base da vesícula biliar é deixada aberta, com a borda cortada podendo ser suturada para prevenir vazamentos. Já na técnica reconstituinte, a abertura é fechada com suturas ou grampeadores, criando um remanescente fechado.
Considerações Finais
A decisão entre as técnicas fenestrada e reconstituinte deve ser baseada na avaliação intraoperatória e na experiência do cirurgião. Estudos comparativos diretos entre as técnicas são escassos, e o conhecimento atual é baseado em revisões e meta-análises que indicam a necessidade de mais pesquisas, especialmente com foco em seguimento a longo prazo.
Conclusão
A colecistectomia subtotal é uma técnica valiosa em situações complexas, oferecendo opções seguras para a remoção da vesícula biliar. A escolha entre a técnica fenestrada e a reconstituinte depende de vários fatores intraoperatórios, e ambos têm seus prós e contras. Com mais estudos e dados, será possível otimizar ainda mais essa técnica, garantindo segurança e eficácia para os pacientes.
“A cirurgia é a arte de trabalhar em um pequeno espaço, com grande precisão.” – Harvey Cushing
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#ColecistectomiaSubtotal #CirurgiaDigestiva #MedicinaCirúrgica #EducaçãoMédica #CirurgiaMinimamenteInvasiva
Fatores Humanos na Lesão do Ducto Biliar na Colecistectomia Laparoscópica
A lesão do ducto biliar deve ser considerada evitável, mas em um estudo publicado no American Journal of Surgery em 2003, mais de 70% dos cirurgiões consideraram-na inevitável. Após as primeiras experiências com essas lesões no início dos anos 90, Hunter e Troidl propuseram várias técnicas para prevenir lesões: uso de telescópio de 30º, evitar diatermia próxima ao ducto hepático comum, dissecação próxima à junção vesícula biliar-ducto cístico, evitar dissecação desnecessária perto da junção ducto cístico-ducto hepático comum e conversão para abordagem aberta quando incerto. No entanto, para aplicar essas técnicas, é necessário interpretar corretamente a anatomia.

Prevenindo Erros de Identificação
Os erros de identificação são devidos à falha em alcançar a identificação conclusiva das estruturas císticas. O ducto cístico e a artéria cística são as únicas estruturas que requerem divisão durante a colecistectomia, portanto, o objetivo da dissecação é identificar essas estruturas conclusivamente. Existem vários métodos para identificar o ducto cístico. Na abordagem aberta, a exibição da confluência do ducto cístico com o ducto hepático comum para formar o ducto biliar comum era utilizada, mas não é considerada segura na abordagem laparoscópica. Na cirurgia laparoscópica, técnicas usadas incluem colangiografia intraoperatória, técnica infundibular e técnica da visão crítica.
A técnica infundibular é um método usado inicialmente para identificação ductal com base na demonstração tridimensional da forma de funil da extremidade inferior da vesícula biliar e do ducto cístico adjacente. Para obter essa visão, o ducto cístico é seguido até a vesícula biliar ou a extremidade inferior da vesícula biliar é rastreada até o ducto cístico. Quando a dissecação é completada, a união em forma de funil do ducto cístico com a vesícula biliar pode ser vista em três dimensões. A falácia dessa técnica é obter uma falsa “visão infundibular” quando o ducto biliar comum é seguido até uma massa inflamatória onde o ducto cístico está escondido. Essa ilusão visual ocorre especialmente na presença de inflamação aguda ou crônica severa, uma grande pedra no fundo de Hartmann, bandas adesivas entre a vesícula biliar e o ducto hepático comum e vesícula biliar intra-hepática.
Técnica da Visão Crítica de Segurança
A técnica da visão crítica de segurança, defendida por Strasberg, envolve a identificação tentativa dessas estruturas císticas por dissecação no triângulo de Calot, seguida pela dissecação da vesícula biliar do leito hepático. Nessa técnica, o triângulo de Calot é limpo de gordura e tecido fibroso, e após o destacamento da vesícula biliar, apenas duas estruturas estão conectadas à extremidade inferior da vesícula biliar: o ducto cístico e a artéria cística. Não é necessário ou recomendado que o ducto biliar comum seja visualizado. A falha em alcançar essa visão crítica é uma indicação absoluta para conversão ou possivelmente colangiografia para definir a anatomia ductal.
Desde sua introdução, essa técnica de visão crítica foi aceita por muitos cirurgiões pelos resultados superiores em minimizar lesões de ducto biliar. Averginos et al. em 2009 publicaram o resultado de 1046 colecistectomias sem lesão de ducto biliar usando a técnica da visão crítica. Apenas cinco pacientes tiveram vazamentos biliares transitórios no período pós-operatório, que cessaram dentro de 2 a 14 dias. Similarmente, Yegiyants e Collins analisaram o papel da visão crítica de segurança em 3.000 pacientes submetidos a colecistectomia eletiva e relataram uma lesão de ducto biliar, que ocorreu durante a dissecação do triângulo de Calot, antes de alcançar a visão crítica. Sanjay et al. em 2010 estudaram sua segurança em 447 colecistectomias realizadas para patologias biliares agudas e não relataram lesões de ducto biliar.
Colangiografia Intraoperatória e Outros Métodos
Outro método de identificação conclusiva das estruturas císticas é a colangiografia intraoperatória rotineira. Vários estudos prospectivos tentaram avaliar a utilidade da colangiografia intraoperatória na prevenção de lesões do ducto biliar comum. Uma meta-análise de 40 séries de casos detalhando 327.523 colecistectomias laparoscópicas e 405 lesões maiores foi realizada em 2002. A taxa de lesão foi reduzida pela metade no grupo de colangiografia intraoperatória rotineira (0,21%) em comparação com o grupo seletivo (0,43%). Além disso, no grupo seletivo, apenas 21,7% das lesões do ducto biliar comum foram detectadas intraoperatoriamente. Fletcher et al. descobriram que a colangiografia intraoperatória rotineira reduziu a incidência de lesão. No entanto, outros estudos sugerem que a gravidade, mas não a incidência de lesões biliares, é reduzida pela colangiografia intraoperatória rotineira.

Técnicas recentes para identificar corretamente a anatomia biliar incluem o uso de corantes. Ishizawa et al. relataram o uso de técnica de colangiografia fluorescente com a injeção intravenosa de verde de indocianina. A estrutura biliar foi delineada em todos os 52 pacientes estudados usando o sistema de imagem fluorescente. No entanto, o custo envolvido é um obstáculo para o uso generalizado. Similarmente, Sari et al. propuseram injetar azul de metileno na vesícula biliar após aspirar a bile com uma agulha de Varess antes de iniciar a dissecação.
Fatores Humanos na Lesão do Ducto Biliar
Embora uma instrução rigorosa nos princípios de técnica cirúrgica segura para colecistectomia seja essencial, pode ser igualmente importante desenvolver novas estratégias de treinamento que utilizem o conhecimento de fatores psicológicos na produção de erros. Esse é o enfoque dos fatores humanos descrito por Reason em “organizações de alta confiabilidade”, como o controle de tráfego aéreo e a indústria de energia nuclear. Nesses ambientes, profissionais altamente treinados realizam tarefas técnicas complexas e às vezes precisam tomar decisões rápidas em condições de incerteza, com consequências potencialmente desastrosas em caso de erros.
Conclusão
Lesões de ducto biliar lançaram uma sombra de apreensão sobre um procedimento maravilhoso como a colecistectomia laparoscópica. Milhões de pessoas já se beneficiaram desse avanço contra doenças da vesícula biliar. Portanto, para preservar esses benefícios, o cirurgião operatório deve estar ciente dos fatores responsáveis por essas lesões e tomar medidas apropriadas para preveni-las. Isso requer aderência estrita aos princípios de dissecação meticulosa, para que apenas estruturas positivamente identificadas sejam divididas. O uso rotineiro de colangiografias intraoperatórias e a conversão para procedimento aberto em caso de falha de progresso ou anatomia incerta podem reduzir significativamente esse infortúnio.
Gostou? Nos deixe um comentário, compartilhe em suas redes sociais e/ou mande sua dúvida pelo Chat On-line em nossa DM do Instagram.
Hashtags: #ColecistectomiaLaparoscópica #LesãoDuctoBiliar #SegurançaCirúrgica #CirurgiaDigestiva #EducaçãoMédica
Prevenção das Lesões Iatrogênicas das Vias Biliares na Colecistectomia Laparoscópica
As lesões iatrogênicas das vias biliares que ocorrem durante a colecistectomia se apresentam como um verdadeiro desafio cirúrgico. Estas lesões podem representar uma grande complicação no tratamento de doenças comuns como a colelitíase, que afeta aproximadamente 10% da população. A literatura continua a registrar níveis variando de 0,1% a 0,6% de lesões nas vias biliares em procedimentos laparoscópicos, mesmo em centros de referência.
A mudança de paradigma proporcionada pela laparoscopia é uma das principais explicações para o aumento da frequência de lesões iatrogênicas dos ductos biliares. O conhecimento incompleto da tecnologia e dos instrumentos, bem como o treinamento inadequado em habilidades cirúrgicas, determinam o aumento do número de lesões nos ductos biliares, associado ao aumento da gravidade e reparação inadequada. Tal conhecimento incompleto levou, em vez da cura da colecistectomia para colelitíase, ao surgimento de uma doença crônica com morbidade e mortalidade significativas: a lesão iatrogênica dos ductos biliares (aleijados biliares).
Em resumo, podemos dizer que o prognóstico de um paciente com lesão acidental das vias biliares depende crucialmente de dois fatores. O primeiro diz respeito ao grau de remanescente hepático e do ducto biliar no momento da reconstrução. O segundo, por sua vez, está relacionado à técnica de reconstrução do fluxo biliar. Se no primeiro caso o cirurgião não pode interferir, o mesmo não acontece com o segundo. Isso depende inteiramente dele. Deve-se enfatizar que o reconhecimento da lesão durante a cirurgia é muito importante, pois permite a reparação em melhores condições do que quando realizada no pós-operatório, na presença de coleperitônio, infecção ou fístula.
Lesões maiores podem contribuir para um impacto considerável na qualidade de vida, no estado funcional do fígado e na sobrevivência de pacientes jovens. As reconstruções cirúrgicas atuais visam restaurar o trânsito biliar por meio da anastomose biliodigestiva mucosa-mucosa, sem tensão.
Quando a perda de substância no ducto biliar é pequena, podemos realizar a reconstrução de extremidade a extremidade, desde que a sutura possa ser realizada sem tensão. Como na maior parte do tempo as bordas do trato biliar são removidas e/ou a porção distal não pode ser identificada, a reconstrução do trato biliar é feita, mais comumente, através de derivação do ducto biliar comum ou drenagem bileodigestiva com um segmento excluído de jejuno de aproximadamente 40 a 60 cm (reconstrução em Y de Roux). As lesões do trato biliar geralmente ocorrem perto do hilo hepático, tornando a reconstrução bileodigestiva muito difícil ou impossível. Além disso, está relacionada a maior incidência de câncer de ducto biliar a longo prazo, devido ao refluxo crônico de suco pancreático-biliar para a árvore biliar.
Em uma pesquisa realizada por Massarweh et al., com 1412 cirurgiões do American College of Surgeons, constatou-se que cirurgiões mais jovens e mais experientes que praticavam em hospitais universitários tinham um número estatisticamente menor de lesões iatrogênicas do ducto biliar.
O reconhecimento e a avaliação da gravidade das lesões nos ductos e comprometimento das estruturas vasculares, que podem ocorrer em até 32% dos pacientes, geralmente são feitos no período pós-operatório. Para uma extensão mais abrangente do problema, a angio-colangiografia por ressonância magnética tem sido muito útil ao considerar a extensão vascular das lesões. Tian Yu, com o objetivo de prevenir lesões no ducto biliar, relatou a realização de colecistectomia subtotal em 48 pacientes com colecistite aguda com inflamação no ducto cístico alto.
As lesões ocorrem com mais frequência durante os primeiros 100 casos de curva de aprendizado, associadas a casos agudos e ao uso de equipamentos inadequados. O uso da colangiografia pré-operatória rotineira na prevenção de lesões iatrogênicas do ducto biliar é controverso. A realização da colangiografia de rotina permite a identificação de lesões, mas não tem sido útil na prevenção de lesões. Portanto, a colangiografia tem se mostrado útil na detecção e reparo mais adequado.
Fatores relacionados à técnica cirúrgica estão diretamente ligados às lesões do trato biliar. Entre eles, na maioria dos casos, estão o sangramento da área cística do triângulo ou do trato biliar, a tração excessiva da vesícula biliar e a presença de variações anatômicas não reconhecidas.
Alguns marcos anatômicos do hilo hepático têm sido citados como parâmetros importantes para orientação durante a dissecção. O sulco de Rouvière deve ser identificado e a dissecção não deve ser feita abaixo da base do segmento IV e do ligamento hepatoduodenal. Acreditamos que a prevenção de lesões do trato biliar começa antes do procedimento, e algumas etapas devem ser seguidas rotineiramente:
- A equipe deve ter conhecimento dos equipamentos, utilizando ferramentas adequadas (câmera, monitor, insuflador e ótica de 30º);
- O paciente deve estar em uma boa posição, conforme a experiência da equipe;
- O anestesiologista deve ter experiência com procedimentos laparoscópicos;
- O cirurgião e os assistentes devem ter treinamento em simuladores e animais, e supervisão de cirurgiões mais experientes nos primeiros casos humanos;
- Bom conhecimento da anatomia das vias biliares e suas variações;
- Durante o procedimento, a tração e apresentação devem ser feitas de forma suave;
- Visualizar as estruturas biliares com tração inferior da vesícula biliar para cima e lateralmente (em direção ao ombro direito do paciente) com o infundíbulo puxado para baixo e para os lados, proporcionando o achatamento das estruturas e visualização clara do triângulo do trato biliar;
- A dissecção circular do infundíbulo cístico começa com a abertura do peritônio e adesões do triângulo posterior do trato biliar, utilizando bisturis e baixa frequência; o uso criterioso do cautério ou clipes durante a hemorragia é importante, limpando a área com gaze antes de proceder à secção ou ligadura final;
- Deve haver identificação prévia do ducto cístico, hepático e artérias císticas antes da clipagem e secção das estruturas, sendo essencial identificar a transição infundíbulo-cístico, começando da direita para a esquerda, e em caso de dúvida, antes da secção, deve-se realizar um estudo radiológico;
- A dissecção do fundo da vesícula biliar deve manter o eixo do plano (especialmente o infundíbulo) durante todo o procedimento e, necessariamente, o campo cirúrgico deve estar bem iluminado, sem sangue ou bile e com visualização do hilo hepático.
Como disse Lahey: “A primeira regra da cirurgia é saber quando não operar”.
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #ColecistectomiaLaparoscópica #LesãoIatrogênica #PrevençãoCirúrgica #SaúdeDigestiva
Lesão da Via Biliar na Colecistectomia Laparoscópica
A lesão da via biliar é uma complicação temida e frequentemente debilitante associada a procedimentos cirúrgicos no abdome superior, especialmente durante a colecistectomia. Com a crescente adoção da abordagem laparoscópica, houve um aumento na incidência dessas lesões, tornando crucial a compreensão de sua patogênese para melhorar os desfechos cirúrgicos e a segurança do paciente.
Anomalias Anatômicas: O Campo Minado da Cirurgia Biliar
As variações anatômicas da árvore biliar são numerosas e frequentemente surpreendentes, mesmo para os cirurgiões mais experientes. Anomalias do ducto cístico e do ducto hepático direito, por exemplo, podem predispor a erros durante a dissecção. O ducto cístico pode se unir ao ducto hepático comum em posições altas ou baixas, e a ausência do ducto hepático direito em até 25% dos pacientes adiciona uma camada de complexidade. Além disso, a presença de ductos hepáticos direitos com trajetos prolongados e extra-hepáticos, conhecidos como ductos de Bismuth tipo 5, são particularmente vulneráveis durante a colecistectomia laparoscópica.
Erros Técnicos: A Principal Causa de Lesões
A maioria das lesões da via biliar é atribuída a erros técnicos ou à má interpretação da anatomia. Durante a colecistectomia laparoscópica, o cirurgião pode confundir o ducto biliar comum com o ducto cístico, resultando na ligadura e ressecção do ducto errado. Esse erro é mais comum em casos de inflamação aguda, onde a anatomia normal está distorcida. A utilização inadequada de equipamentos, como a eletrocauterização excessiva, também pode causar lesões térmicas aos ductos biliares, levando a estenoses biliares tardias.
Fatores Patológicos: Inflamação e Isquemia
Pacientes com colecistite aguda ou crônica apresentam maior risco de lesão da via biliar devido à inflamação intensa e fibrose na área do triângulo de Calot. Nesses casos, a dissecção torna-se desafiadora, com maior probabilidade de lesão do ducto hepático comum ou dos ductos hepáticos direitos. A dissecção excessiva pode interromper o fluxo sanguíneo axial dos ductos biliares, que é essencialmente suprido por pequenas artérias que correm ao longo das bordas laterais dos ductos. A interrupção desse fluxo pode resultar em estenoses biliares secundárias à isquemia.
Avanços na Imagem Pré-Operatória
A imagem pré-operatória avançada, como a colangiografia por ressonância magnética (RM) e a tomografia computadorizada (TC) colangiográfica, tem o potencial de reduzir a incidência de lesões da via biliar, identificando anomalias anatômicas antes da cirurgia. Estudos mostram que anomalias ductais direitas estão presentes em 4,8% a 8,4% da população geral. A adoção ampla dessas técnicas de imagem, embora custosa, pode ser justificada pela redução das complicações pós-operatórias.
Estratégias de Prevenção: A Chave para a Segurança
Para minimizar o risco de lesão da via biliar, é essencial que os cirurgiões adiram rigorosamente aos princípios básicos da colecistectomia segura. Isso inclui a visualização clara da anatomia relevante, a utilização de equipamentos de vídeo de alta resolução e assistência adequada para exposição e retração. Não se deve ligar ou dividir qualquer estrutura sem identificar claramente sua anatomia.
Em casos complexos, como aqueles com colecistite aguda, a conversão para uma abordagem aberta deve ser considerada quando a anatomia não pode ser claramente definida. A realização de uma colecistostomia parcial, removendo a vesícula biliar longe da junção do ducto cístico com o ducto hepático comum, pode ser uma abordagem mais segura em casos de inflamação severa.
Conclusão
A prevenção das lesões da via biliar exige uma combinação de conhecimento anatômico detalhado, habilidades técnicas refinadas e o uso judicioso de tecnologias avançadas. Como disse Lahey: “O cirurgião que não compreende as variações anatômicas da via biliar está condenado a causar danos.” Gostou? Nos deixe um comentário ✍️ , ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#LesãoBiliar #CirurgiaDigestiva #Colecistectomia #SegurançaCirúrgica #AnatomiaBiliar
Prevenção da Lesão da Via Biliar
INTRODUÇÃO
Carl Langenbuch é creditado como o primeiro cirurgião a realizar uma colecistectomia aberta (CA) em 1882. Ele havia feito suas pesquisas em animais e cadáveres antes de realizar o primeiro procedimento em um ser humano. Langenbuch postulou que a remoção da vesícula biliar resultaria na extração dos cálculos biliares e do órgão que os produzia. Em 1985, E. Muhe, de Boblingen, Alemanha, realizou a primeira colecistectomia laparoscópica (CL), mas enfrentou grande oposição de seus colegas.
Três anos depois, um ginecologista francês, P. Mouret, realizou uma CL, o que influenciou F. Dubois e J. Perissat a desenvolverem suas técnicas para essa abordagem. A popularização dessa técnica nos Estados Unidos deve ser creditada a E.J. Reddick e D.O. Olsen, de Nashville, Tennessee, que realizaram seu primeiro caso em 1988 e estabeleceram os princípios da operação como ela é conhecida atualmente. Durante a década de 1990, foram descritas tentativas de reduzir ainda mais a abordagem laparoscópica minimamente invasiva para uma única incisão. O uso de trocartes e instrumentos de pequeno diâmetro, de 2 a 3 mm, conhecido como técnica de needlescopic, também foi experimentado. Nenhuma dessas técnicas ganhou aceitação geral devido à falta de benefícios comprovados.
A CL tornou-se o primeiro procedimento de uma revolução que mudou a maneira como a cirurgia abdominal estava sendo realizada. Nos 15 anos seguintes, uma abordagem laparoscópica foi relatada como viável para quase todos os procedimentos abdominais. Esse avanço resultou em um benefício significativo para o paciente na maioria dos procedimentos, devido às vantagens inerentes da técnica laparoscópica. Para a CL, no entanto, ainda há um risco aumentado de lesão do ducto biliar (LDB) em comparação com a agora histórica CA. O denominador comum na ocorrência de LDB é a falha em identificar claramente a anatomia do triângulo de Calot. Embora essa desvantagem persistente da CL não justifique a realização de uma CA, ela precisa ser continuamente abordada. Passos para prevenir LDB foram descritos nos primeiros anos da CL, e em 1995 Strassberg descreveu o termo “visão crítica de segurança” como o passo mais importante na prevenção de LDB durante o procedimento.
Passos Técnicos Importantes para Evitar Lesões do Ducto Biliar
A partir da técnica cirúrgica descrita, os principais passos para evitar lesões do ducto biliar (LDB) são:
- Máxima tração cefálica do fundo da vesícula biliar.
- Retração lateral e inferior (em direção ao pé direito) da bolsa de Hartmann, puxando-a para longe do fígado e evitando o alinhamento do ducto cístico com o ducto biliar comum.
- Inicie a dissecção na parte superior do colo da vesícula biliar e conduza-a de lateral para medial.
- Gire a bolsa de Hartmann medialmente para uma dissecção póstero-lateral da serosa da vesícula biliar.
- Liberte o colo da vesícula biliar do leito hepático, criando uma janela que seja tão grande quanto necessário para expor claramente a anatomia do triângulo de Calot e obter uma visão crítica de segurança.
- Coloque os clipes sob visualização direta de ambos os ramos em uma direção medial para lateral, a partir do porto subxifoide.
- Realize a colangiografia intraoperatória se houver quaisquer dúvidas sobre a anatomia biliar.
- Ao iniciar o descolamento subsequente da vesícula biliar do leito hepático, mantenha a dissecção próxima à parede da vesícula biliar e longe das estruturas do hilo do fígado. O uso criterioso de eletrocautério é recomendado.
Dicas e Truques para Evitar Complicações
- Assuma que cada caso tem um ducto cístico curto e/ou outras anomalias anatômicas. O objetivo é a dissecção do ducto cístico começando na junção com a vesícula biliar.
- Use a técnica da visão crítica de segurança para limpar o triângulo de Calot e individualizar, identificar e isolar completamente o ducto cístico e a artéria antes de dividi-los.
- Durante toda a operação, sempre tenha em mente que sua interpretação da anatomia pode estar errada ou equivocada; isso serve como uma salvaguarda para prevenir lesões dos ductos biliares (LDBs).
- Uma reação de pânico ao sangramento, resultando na aplicação de vários clipes ou cauterização em massa, leva ao desastre. A compressão, irrigação e sucção, e o uso de uma pinça de bico de pato para pegar o ponto de sangramento são recomendados. Esteja ciente do aumento de 16 vezes da visão laparoscópica.
- Cuidado com a retração excessiva da bolsa de Hartmann, que pode levar à interpretação errada do ducto biliar comum como sendo o ducto cístico. Ao se deparar com um ducto cístico largo, a colangiografia é obrigatória para garantir que é o ducto cístico e não o ducto biliar comum. Para o fechamento, podem ser colocadas 2 suturas endoloop em vez de clipes de titânio regulares.
Diretrizes de Tóquio 2018: Passos Seguros Durante Colecistectomia para Colecistite Aguda
As Diretrizes de Tóquio 2018 (TG18) foram uma conferência de consenso com mais de 60 especialistas de todo o mundo. Um dos objetivos do TG18 foi estratificar a colecistite aguda por gravidade e recomendar o tratamento com base na severidade. Os passos seguros do TG18 durante a colecistectomia para colecistite incluem os seguintes:
- Se a vesícula biliar estiver distendida e interferir na visão, ela deve ser descomprimida por aspiração com agulha.
- Retração eficaz da vesícula biliar para desenvolver um plano na área do triângulo de Calot e identificar seus limites (contra-tração).
- Iniciar a dissecção a partir da folha posterior do peritônio que cobre o colo da vesícula biliar e expor a superfície da vesícula biliar acima do sulco de Rouvière.
- Manter o plano de dissecção na superfície da vesícula biliar durante toda a colecistectomia laparoscópica (CL).
- Dissecar a parte inferior do leito da vesícula biliar (pelo menos um terço) para obter a visão crítica de segurança (CVS).
- Criar a visão crítica de segurança (CVS).
- Para hemorragia persistente, obter hemostasia principalmente por compressão e evitar o uso excessivo de eletrocautério ou clipes.
Lesão do Ducto Biliar (LDB) na Colecistectomia: Desafios e Prevenção
A lesão do ducto biliar (LDB) é uma complicação muito séria da colecistectomia. Após a curva de aprendizado inicial da laparoscopia (50 casos), estudos mais recentes indicam que as taxas de LDB durante a colecistectomia laparoscópica variam entre 0,08% e 0,5%, geralmente mais altas do que as taxas relatadas para a colecistectomia aberta (0,1%–0,2%). Contudo, a LDB pode ser subestimada em cirurgias abertas. A maioria das lesões de LDB (97%) resulta de erros na percepção visual, com falhas nas habilidades técnicas representando apenas 3%. Aproximadamente 25% das lesões são reconhecidas durante a operação inicial. Fatores que contribuem para lesões iatrogênicas incluem tração excessiva que distorce a anatomia, anomalias anatômicas, presença de inflamação, uso inadequado de cautério ou problemas relacionados ao controle de hemorragia intraoperatória, entre outros. Além disso, graus mais altos de gravidade da colecistite aguda estão associados a um maior risco de LDB. O manejo depende do momento em que a lesão é reconhecida, da localização da lesão e se há lesão vascular concomitante.
PREVENÇÃO DA LESÃO DO DUCTO BILIAR
Uma técnica cirúrgica adequada, conhecimento de possíveis anomalias anatômicas, obtenção da visão crítica de segurança e uso de colangiografia radiográfica e/ou fluorescente são medidas que ajudam a evitar a LDB. A visão crítica de segurança foi descrita por Strasberg e colegas como um método de identificação consistente do ducto cístico e da artéria. No entanto, pode ser difícil de obter em casos com inflamação severa. Consiste em cumprir 3 critérios: (1) o triângulo hepatocístico deve estar livre de gordura e tecido fibroso, (2) o terço inferior da vesícula biliar deve estar separado do fígado para expor a placa cística, e (3) dois e apenas dois estruturas devem ser vistas entrando na vesícula biliar. Essas duas estruturas devem ser visualizadas anteriormente e posteriormente com um laparoscópio angular ou “balançando” o fundo da vesícula. A visão crítica de segurança é amplamente apoiada pela opinião de especialistas como o método mais confiável de identificação anatômica, e, portanto, é recomendada como uma diretriz importante para colecistectomias laparoscópicas.
Se houver incerteza sobre a anatomia biliar ou suspeita de anomalias anatômicas, a colangiografia via vesícula biliar ou ducto cístico deve ser usada, se possível, para esclarecer as estruturas. Relatórios mostram que o uso de colangiografia pode reduzir o risco de lesões do ducto biliar, embora alguns estudos não tenham encontrado associação. No entanto, se uma lesão biliar for suspeitada intraoperatoriamente, a colangiografia intraoperatória é eficaz para aumentar as chances de reconhecimento precoce, melhorando os resultados no tratamento da LDB. A Sociedade Americana de Cirurgiões Gastrointestinais e Endoscópicos recomenda o “uso liberal” de colangiografia ou outras modalidades para delinear com precisão a anatomia cirúrgica. Alguns defensores sugerem o uso rotineiro de colangiografia, citando não apenas uma menor taxa de LDB, mas também a prevenção de lesões excisionais mais graves. A anatomia biliar também pode ser visualizada usando ultrassonografia intraoperatória, se a experiência estiver disponível.
Conclusão
A colecistectomia é um dos procedimentos da cirurgia do aparelho digestivo que mais comumente são realizados em todo o mundo, mas pode estar repleta de potenciais problemas. O Safe Cholecystectomy Task Force da Sociedade Americana de Cirurgiões Gastrointestinais Endoscópicos identificou vários fatores importantes para garantir a segurança na colecistectomia laparoscópica:
- Estabelecimento da visão crítica de segurança
- Compreensão da anatomia
- Obtenção de exposição adequada
- Solicitação de ajuda a um colega mais experiente
- Reconhecimento de quando converter ou abandonar o procedimento
As complicações após a colecistectomia incluem lesões ou vazamentos do ducto biliar, sangramento, lesões vasculobiliares combinadas, cálculos biliares retidos, cálculos biliares derramados, abscessos, estenoses, hérnias e síndrome pós-colecistectomia (PCS). Embora as taxas dessas complicações sejam geralmente muito baixas, a conscientização e uma alta suspeita clínica quando um paciente apresenta sintomas semanas, meses ou anos após a colecistectomia podem ajudar no diagnóstico e tratamento adequado.
Ductos Subvesicais (ductos de Luschka)
Introdução A doença da vesícula biliar continua sendo uma das condições cirúrgicas mais comuns nas sociedades ocidentais, e a colecistectomia minimamente invasiva é um dos procedimentos cirúrgicos mais frequentes. Um princípio fundamental da anatomia cirúrgica é a variabilidade estrutural da árvore biliar. Uma variação anatômica comum com implicações cirúrgicas é o ducto subvesical, erroneamente chamado de “ducto de Luschka”. No texto anatômico de Herbert von Luschka, ele descreveu glândulas intra-murais que drenam para o lúmen da vesícula biliar, bem como uma rede de ductos microscópicos no tecido mole ao redor da vesícula, e não ductos biliares subvesicais.
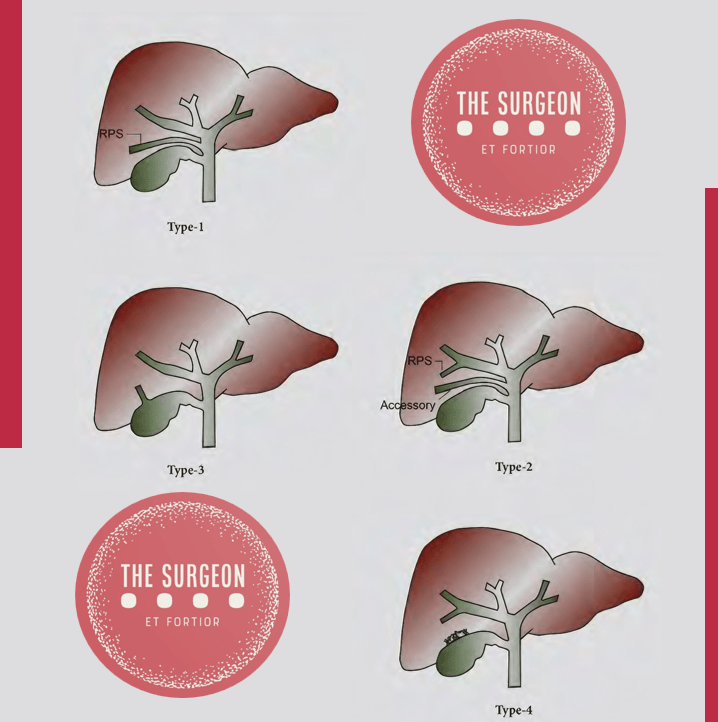
Importância Clínica e Risco de Lesões A importância clínica do ducto subvesical reside no risco potencial de lesão durante a colecistectomia e procedimentos hepatobiliares. Vazamentos biliares ocorrem em aproximadamente 0,2-2% das colecistectomias minimamente invasivas. Lesões inadvertidas e não detectadas do ducto subvesical são uma causa frequente de vazamentos biliares, sendo responsáveis por até 27% dos vazamentos.
Classificação dos Ductos Subvesicais Schnelldorfer et al. categorizaram os ductos subvesicais em:
- Ductos biliares subvesicais segmentares ou setoriais
- Ductos biliares subvesicais acessórios
- Ductos biliares hepato-cisto-vesiculares
- Ductos biliares subvesicais aberrantes
Princípio da Visão Crítica de Segurança O princípio da visão crítica de segurança é utilizado para identificar o ducto cístico e a artéria durante a colecistectomia laparoscópica, prevenindo a identificação errônea do ducto biliar comum ou ductos aberrantes como o ducto cístico. Para alcançar a visão crítica de segurança, três condições devem ser atendidas: primeiro, o triângulo hepatocístico deve ser limpo de gordura e tecido fibroso; segundo, o terço inferior da vesícula biliar deve ser separado do fígado para expor a placa cística; e finalmente, apenas duas estruturas devem ser vistas entrando na vesícula biliar.
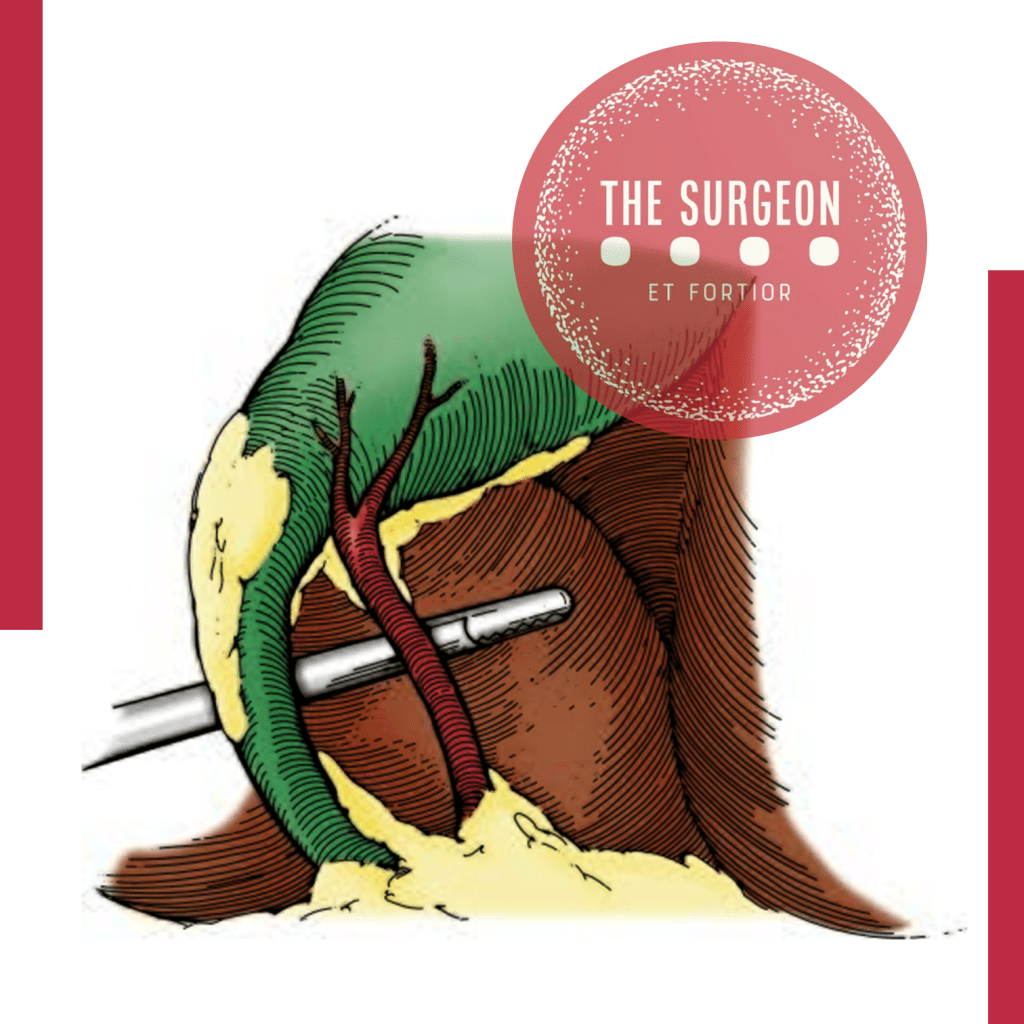
Detecção Pré-operatória e Técnicas Avançadas Ductos subvesicais podem ser representados preoperativamente com técnicas de imagem especializadas. No entanto, a imagem pré-operatória padrão (principalmente a ultrassonografia) não detectará esses ductos na maioria dos casos. Uma dissecção cuidadosa durante a colecistectomia utilizando o princípio da visão crítica de segurança, bem como a laparoscopia de alta definição, pode permitir a detecção, dissecção e controle intraoperatórios dos ductos subvesicais. O uso da laparoscopia tridimensional (3D) pode melhorar a percepção de profundidade do cirurgião, facilitando a identificação da anatomia biliar normal e aberrante. A colangiografia intraoperatória fluorescente com verde de indocianina (ICG) foi descrita por Ishizawa et al., e seu uso levou à identificação de ductos biliares aberrantes durante a colecistectomia laparoscópica.
Identificação Intraoperatória de Vazamentos Biliares A importância da identificação intraoperatória de vazamentos biliares também deve ser enfatizada. A tecnologia avançada disponível atualmente pode ser utilizada para identificar e prevenir vazamentos biliares significativos associados à colecistectomia.

Anatomia e Variações do Ducto Cístico O ducto cístico geralmente tem 2-4 cm de comprimento e 2-3 mm de diâmetro. Ele se junta ao ducto hepático comum em diferentes configurações, sendo a mais comum uma inserção angular em 75% dos casos, seguida por uma inserção paralela em 20% e uma inserção espiral em 5% dos casos. O ducto cístico pode ocasionalmente se juntar ao ducto hepático direito ou ao ducto setorial direito em 0,6-2,3% dos casos. É raramente ausente, mas mais frequentemente a ausência se deve a um encurtamento inflamatório ou erosão por um cálculo, como na síndrome de Mirizzi. Para uma colecistectomia segura, é importante exibir sua junção com a vesícula biliar, em vez do ponto de inserção no ducto biliar comum.
Ducto Subvesical e Suas Variações O ducto subvesical, localizado próximo ao leito da vesícula biliar, está presente em 34,5% dos casos. Uma revisão mais recente relatou uma incidência de 3-10%. O diâmetro médio do ducto geralmente é inferior a 2 mm. Quatro tipos de ductos foram identificados:
- Ducto segmentar ou setorial: Ducto segmentar posterior direito que corre próximo ao leito da vesícula biliar para se juntar ao ducto principal.
- Ducto acessório: Surge do ducto segmentar anterior ou posterior direito e drena no ducto principal.
- Ducto hepato-cisto-vesicular: Drena na vesícula biliar.
- Série de ductos minúsculos que terminam cegamente no tecido conjuntivo do leito da vesícula biliar.
Conclusão A identificação e manejo adequado das variações anatômicas da árvore biliar, como os ductos subvesicais, são essenciais para prevenir lesões durante a colecistectomia laparoscópica. Técnicas avançadas e uma abordagem cirúrgica meticulosa são fundamentais para garantir a segurança do paciente e a eficácia do procedimento.
Colecistectomia Segura: Preditores de Dificuldade Técnica
Introdução
A colecistectomia laparoscópica é amplamente reconhecida por suas vantagens sobre a colecistectomia aberta, incluindo redução da dor pós-operatória, estadias hospitalares mais curtas e tempos de recuperação mais rápidos. No entanto, a transição para técnicas laparoscópicas introduziu um maior risco de lesões do ducto biliar, com incidências relatadas sendo duas a três vezes maiores do que em procedimentos abertos. Dadas as graves consequências associadas à LDB, identificar preditores de colecistectomia difícil e implementar estratégias de manejo apropriadas são cruciais para melhorar os resultados dos pacientes.
Preditores Pré-operatórios de Colecistectomia Difícil
Gênero: O gênero masculino é um preditor significativo de colecistectomia difícil. Análises retrospectivas indicam taxas mais altas de aderências, desafios anatômicos, taxas de conversão e inflamação aguda ou crônica em pacientes do sexo masculino. Fatores contribuintes possíveis incluem a consulta médica tardia e a colecistite recorrente, levando a um aumento da fibrose. Além disso, diferenças fisiológicas, como maior massa muscular e menor circunferência torácica, podem complicar o procedimento.
Idade: A idade avançada (acima de 65-70 anos) está associada a taxas de conversão mais altas devido a históricos mais longos de doença calculosa biliar e frequentes ataques de colecistite. Apesar desses desafios, a colecistectomia laparoscópica em pacientes idosos geralmente resulta em menos complicações em comparação com procedimentos abertos.
Obesidade: O IMC mais alto introduz várias dificuldades técnicas, como obter acesso para a criação do pneumoperitônio, retração do fundo da vesícula biliar e dissecação do triângulo de Calot em um ambiente com excesso de gordura. Pacientes obesos também necessitam de cuidados anestésicos e de enfermagem especializados. Embora se notem tempos operatórios aumentados e taxas de conversão mais altas, a colecistectomia laparoscópica ainda oferece menor morbidade pós-operatória em comparação com a colecistectomia aberta.
Histórico de Colecistite Aguda, Colangite, Pancreatite e Icterícia: Essas condições levam a cicatrizes e fibrose, complicando a delineação anatômica e a dissecação. A colecistite recorrente pode encurtar o ducto cístico, fazendo com que a vesícula biliar pareça drenar diretamente no ducto biliar comum (DBC). A pancreatite aguda, embora não afete diretamente a vesícula biliar, pode causar aderências que dificultam a exposição operatória. A colangiopancreatografia retrógrada endoscópica (CPRE) prévia com stent também pode contribuir para dificuldades intraoperatórias.
Cirrose: A cirrose hepática apresenta um risco significativo de hemorragia devido a colaterais dilatados no triângulo de Calot, coagulopatia e trombocitopenia. A menor complacência do fígado fibroso complica ainda mais a retração da vesícula biliar e a exposição do triângulo de Calot. O uso de tesouras ultrassônicas e a manutenção de uma hemostasia meticulosa são essenciais nesses casos.
Laparotomia Anterior: Cirurgias abdominais anteriores, especialmente múltiplos procedimentos abdominais superiores, frequentemente resultam em aderências, complicando o acesso ao local operatório. O planejamento pré-operatório para o acesso peritoneal e o aconselhamento do paciente sobre a possibilidade de conversão são imperativos.
Fatores Intraoperatórios que Predizem Dificuldade
Aderências densas, vesícula biliar tensa (mucocele/empiema), colecistite aguda, anatomia pouco clara, triângulo de Calot congelado, síndrome de Mirizzi, fístula colecistoentérica, vesícula biliar intra-hepática e cálculos biliares grandes complicam significativamente a colecistectomia laparoscópica. O nível de dificuldade varia com a experiência do cirurgião. Aderências no triângulo de Calot, em particular, apresentam o maior risco de conversão para cirurgia aberta.
Estratégias de Manejo
Acesso Difícil: Locais alternativos para a criação do pneumoperitônio, como o ponto de Palmer, podem ser utilizados em pacientes com cirurgias abdominais superiores anteriores ou obesidade. As aderências devem ser abordadas com dissecação afiada ou métodos rombos, dependendo de sua densidade.
Estratégias de Resgate: Em casos em que a dissecção segura não é viável, estratégias como colecistectomia subtotal, colecistectomia do fundo para a tríade, colecistostomia tubular ou conversão para cirurgia aberta são recomendadas. A colangiografia intraoperatória ou ultrassonografia laparoscópica podem auxiliar na compreensão da anatomia biliar.
Síndrome de Mirizzi e Fístula Colecisto-colédoco: O manejo depende do tipo de síndrome de Mirizzi. A colecistectomia total ou subtotal é tipicamente suficiente para o Tipo I, enquanto casos mais complexos (Tipos II-IV) podem necessitar de coledocoplastia ou anastomose bilioentérica.
Conclusão
A transição para a colecistectomia laparoscópica, embora benéfica, introduz maiores riscos de complicações, como a lesão do ducto biliar. Identificar preditores pré-operatórios e intraoperatórios de colecistectomia difícil é essencial para planejar e executar intervenções cirúrgicas seguras. Os cirurgiões devem estar preparados para implementar várias estratégias de manejo para minimizar os riscos e garantir a segurança do paciente. Como Lahey afirmou apropriadamente, “O cirurgião que vê diante de si apenas a anatomia normal enfrentará mais dificuldades.”

Colecistectomia Segura: Plano R4U
O Imperativo do Sulco de Rouvière e a Visão Crítica de Segurança
Autor: Prof. Dr. Ozimo Gama
Afiliação: Membro Titular do Colégio Brasileiro de Cirurgiões
Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
Introdução
A colecistectomia laparoscópica (CL) permanece como um dos procedimentos cirúrgicos mais executados globalmente. No entanto, sua ubiquidade não mitiga riscos inerentes; a variação anatômica dos ductos biliares, combinada à identificação visual incorreta, continua a precipitar complicações graves, notadamente as lesões iatrogênicas das vias biliares[1]. Neste cenário, a segurança do paciente transcende a destreza manual, residindo na identificação rigorosa de marcos anatômicos imutáveis. Entre estes, o sulco de Rouvière (SR) emerge não apenas como detalhe morfológico, mas como farol essencial para a orientação cirúrgica segura[2].
A Nomenclatura e a Realidade Anatômica
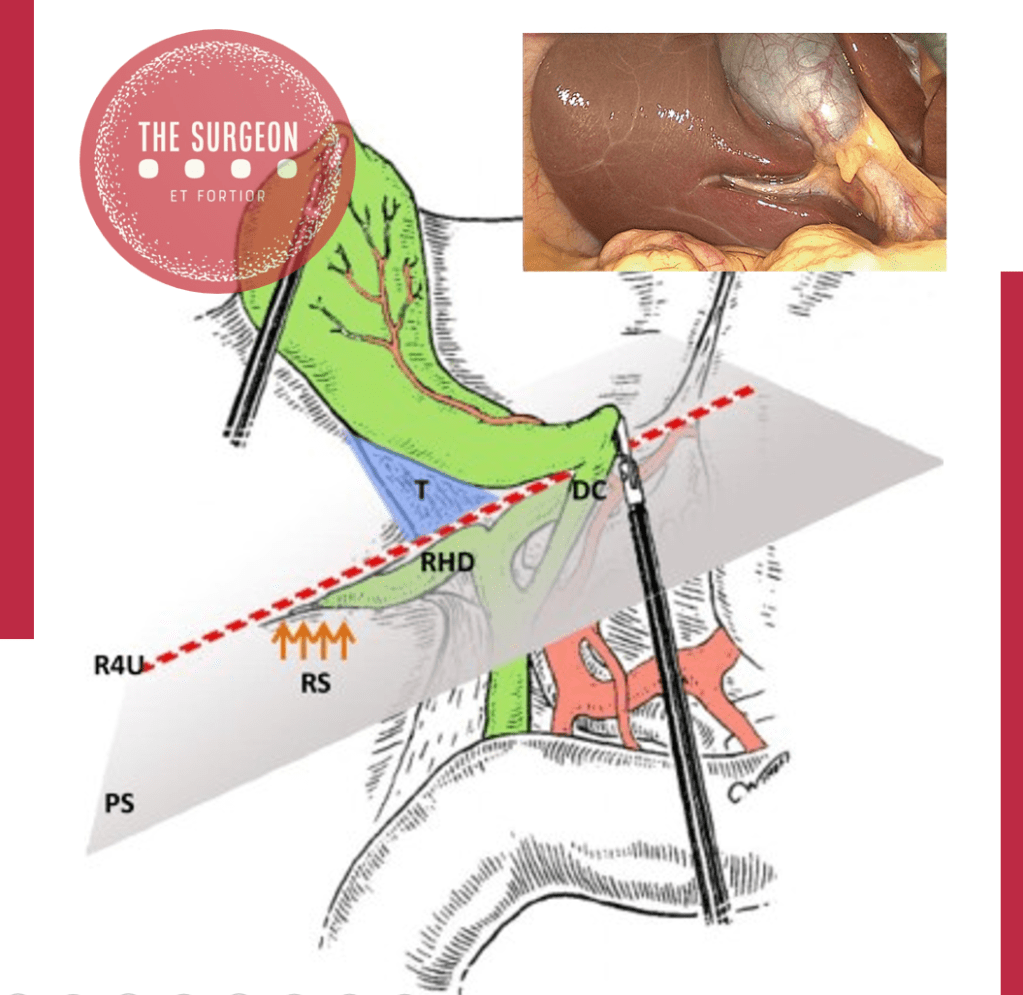
A precisão cirúrgica exige precisão anatômica. Na literatura, o SR é referenciado sob diversas nomenclaturas, incluindo “incisura dextra de Gans”[7] e, originalmente por Henri Rouvière, como “le sillon du processus caudé”[5]. Embora textos clássicos apresentem dados inconsistentes, estudos contemporâneos demonstram a presença do SR em até 80% dos fígados[3,6]. Tal prevalência torna o reconhecimento deste marco uma competência obrigatória. A relevância topográfica do SR é crítica, estabelecendo um divisor de águas anatômico: o ducto e a artéria cística localizam-se anterossuperiormente ao sulco, enquanto o ducto biliar comum (CBD) reside abaixo do seu nível. Evidências sugerem que dissecções iniciadas ventralmente ao SR reduzem significativamente a incidência de lesões ao CBD[2]. Ademais, o marco é instrumental para a execução segura de ressecções hepáticas segmentares[4].
A Integração com a Visão Crítica de Segurança (CVS)
A técnica da Critical View of Safety (CVS), preconizada por Strasberg, é o padrão ouro para minimizar riscos de lesão biliar[1]. Contudo, a aplicação da CVS deve ser ancorada em marcos confiáveis. Variações da árvore biliar extra-hepática afetam até um terço dos pacientes[3], mas o SR tende a manter-se no mesmo plano do ducto hepático comum e do CBD, facilitando a orientação tridimensional. A identificação do SR deve ser o passo preliminar que habilita a construção segura da CVS, mormente em casos de anatomia distorcida por inflamação.
Estratégias de Contingência: A Linha R4U
Em casos onde o SR está obscurecido por fibrose ou aderências, a segurança não pode ser comprometida. A linha R4U — estendendo-se da fissura umbilical para a direita do hilo — apresenta-se como alternativa viável para delimitar um plano seguro de dissecção[2]. Todavia, a utilização eficaz da linha R4U exige profundo conhecimento da anatomia hepática e treinamento contínuo em técnicas de segurança.
Conclusão
A prevenção de lesões na CL exige uma sistematização que transcende a técnica básica. A identificação rotineira do Sulco de Rouvière e a adesão estrita à CVS são imperativos éticos e técnicos. Ao integrar o conhecimento anatômico clássico com estratégias modernas, elevamos o padrão de cuidado. Como nos lembra a sabedoria cirúrgica secular:
“O cirurgião que ignora a anatomia esculpe o corpo humano como um cego esculpe a madeira.” — Guy de Chauliac (1300–1368), Chirurgia Magna.
Referências Bibliográficas
Referências
- Strasberg, S. M., et al. “The Critical View of Safety in Laparoscopic Cholecystectomy.”
- Hugh, T. B. “Anatomical Landmarks for Safe Laparoscopic Cholecystectomy.”
- Zubair, M., et al. “Anatomical Variations in the Extrahepatic Biliary Tree.”
- Couinaud, C. “Segmental Anatomy of the Liver.”
- Rouvière, H. “Le sillon du processus caudé.”
- Reynaud, C., Coucoravas, G., Giuly, J., et al. “Incisura Dextra de Gans.”
- Hugh, T. B. “Minimal Common Bile Duct Injury During Laparoscopic Cholecystectomy.”
- Gans, H. “Incisura Dextra in Classic Anatomical Literature.”
Variações Anatômicas da Árvore Biliar Extra-Hepática no Contexto da Colecistectomia Laparoscópica
Introdução A compreensão das variações anatômicas dos ductos biliares extra-hepáticos é essencial para a realização segura da colecistectomia laparoscópica. A terminologia frequentemente utilizada para descrever essas variações inclui termos como “acessório”, “anômalo” e “aberrante”. Entretanto, essas variações são naturais e suficientemente frequentes para serem antecipadas pelo cirurgião atento. A preferência é pelo termo “duto variante”.
Marcos Anatômicos Gerais para a Orientação
Durante a colecistectomia laparoscópica, é crucial reconhecer marcos anatômicos adjacentes para evitar lesões. O ligamento falciforme situa-se entre os segmentos hepáticos 3 e 4, e o ducto hepático comum (DHC) está próximo ao plano mediano do fígado entre os segmentos 4 e 5. O sulco de Rouvière é uma fissura que contém porções do pedículo portal direito e demarca o plano ventral-dorsal do ducto biliar comum (DBC), auxiliando na orientação durante a dissecção.

Anatomia dos Ductos Hepáticos Direitos
Na configuração mais comum, o ducto hepático seccional anterior direito (segmentos 5 e 8) e o ducto hepático seccional posterior direito (segmentos 6 e 7) unem-se para formar o ducto hepático direito (DHD), que se junta ao ducto hepático esquerdo para formar o DHC. Essa anatomia ocorre em 57-72% dos indivíduos. Em 15-30% dos casos, os ductos seccionais direito anterior e posterior não se unem, cada um tendo uma junção separada com o DHC ou o ducto hepático esquerdo, aumentando o risco de lesão durante a cirurgia.

Ductos Subvesicais
Os ductos subvesicais, localizados superficialmente no leito da vesícula biliar, são a fonte mais comum de vazamento biliar pós-operatório. Observados em cerca de um terço dos espécimes humanos, esses ductos, geralmente originários do segmento 5, drenam para o ducto hepático direito, o DHD ou o DHC. A dissecção deve ser mantida fora do fígado sempre que possível para evitar lesões.
Anatomia do Ducto Cístico
O ducto cístico geralmente se junta ao DHC, com a localização da junção variando do hilo hepático à área pré-ampular. Configurações paralelas e espirais do ducto cístico são comuns e representam fatores de risco significativos para lesões durante a colecistectomia. Fusão inflamatória e contração do ducto cístico são situações de alto risco.
A variabilidade anatômica dos ductos biliares extra-hepáticos requer uma abordagem cuidadosa durante a colecistectomia laparoscópica para evitar lesões. O conhecimento detalhado das possíveis variações e a identificação precisa dos marcos anatômicos são fundamentais para o sucesso cirúrgico. As variações anatômicas dos ductos biliares são frequentes e devem ser esperadas pelos cirurgiões. A terminologia adequada e o reconhecimento dessas variações são cruciais para prevenir lesões durante a colecistectomia laparoscópica. Como afirmou Lahey: “A variação anatômica é a regra, não a exceção.”
Referências
- Michels, NA. “Every duct drains a definite segmental area of the liver.”
- Strasberg, SM. “Anatomic and historical basis of variations in bile ducts.”
- Bismuth, H. “Variations in the anatomy of the extrahepatic bile ducts.”
Diferenciação Morfológica do Ducto Cístico e do Ducto Colédoco no Contexto da Colecistectomia Laparoscópica
Introdução
Na cirurgia laparoscópica, a precisão na identificação e dissecação das estruturas anatômicas é fundamental para a prevenção de lesões iatrogênicas da via biliar. O conhecimento detalhado das variações anatômicas do ducto cístico e do ducto colédoco é essencial para evitar complicações graves. Conforme disse Lahey em 1954: “Cholecystectomy is a dangerous operation unless one realizes that variations are very common.” Assim, a terminologia anatômica deve ser correta, consistente e padronizada para evitar mal-entendidos.
Anatomia Normal
O ducto cístico conecta a vesícula biliar ao ducto hepático comum, formando o ducto colédoco. Este último é a principal via de passagem da bile do fígado para o duodeno. A correta identificação dessas estruturas é crucial durante a colecistectomia para evitar lesões.
Dimensões e Diâmetro
O ducto cístico geralmente tem um comprimento de 2-4 cm e um diâmetro de 1-5 mm. Já o ducto colédoco mede aproximadamente 6-8 cm de comprimento e tem um diâmetro que varia de 4-10 mm.
Trajeto e Topografia
O ducto cístico apresenta um trajeto sinuoso, que pode variar significativamente entre os pacientes. Ele se une ao ducto hepático comum para formar o ducto colédoco, que desce posteriormente ao duodeno até a ampola de Vater. A topografia dessas estruturas é fundamental para a correta dissecação durante a cirurgia.
Vascularização
O ducto cístico é irrigado principalmente pela artéria cística, um ramo da artéria hepática direita. O ducto colédoco, por sua vez, recebe irrigação de pequenos ramos axiais das artérias hepática direita, gástrica direita e pancreatoduodenal onde 60% é inferior e 40% é superior.
Epônimos e Terminologia Correta
Historicamente, a anatomia hepato-biliar tem sido confundida por diferentes nomenclaturas e epônimos imprecisos. O termo “triângulo de Calot”, descrito por Jean-Francois Calot em 1890, refere-se à área limitada pelo ducto cístico, o ducto hepático comum e a artéria cística. No entanto, o triângulo de Calot não é uma definição anatomicamente precisa, sendo preferível o termo “triângulo hepatocístico”, que é delimitado pelo ducto cístico e a vesícula biliar, o ducto hepático comum e a borda do fígado. Esta é uma área crítica onde ductos hepáticos direitos e a artéria hepática direita podem ser encontrados, sendo comumente obscurecida por inflamação aguda ou crônica.
Principais Variações Anatômicas e Suas Incidências
As variações anatômicas são comuns e devem ser antecipadas. Cerca de 20% dos ductos císticos seguem um trajeto paralelo ao ducto hepático comum, compartilhando uma bainha comum de tecido conjuntivo. Outros 5-10% têm um curso espiralado, cruzando o ducto hepático comum de forma ventral ou dorsal. As variações no trajeto e na união dos ductos são fatores de risco significativos para lesões durante a cirurgia.
Idiotopia em Relação ao Duodeno e Holotipia em Relação à Tríade Portal
O ducto colédoco passa diretamente atrás do duodeno, uma característica que o diferencia do ducto cístico durante a dissecção. Em relação à tríade portal, o ducto cístico e o ducto colédoco são componentes críticos, juntamente com a artéria hepática e a veia porta, sendo importantes marcos anatômicos para a orientação cirúrgica.
Sintopia Entre Eles
A relação espacial entre o ducto cístico e o ducto colédoco é complexa e varia com a inflamação e a dissecção cirúrgica. Durante a colecistectomia, a visualização clara do “triângulo hepatocístico” é fundamental para identificar corretamente o ducto cístico e evitar danos ao ducto colédoco.
Conclusão
O entendimento detalhado das variações anatômicas do ducto cístico e do ducto colédoco é crucial para a realização segura da colecistectomia laparoscópica. A aplicação do conceito da “vista crítica de segurança” ajuda a minimizar os riscos de lesões. Portanto, a terminologia precisa e o conhecimento das variações anatômicas são fundamentais para a prática cirúrgica segura.
Colecistectomia Laparoscópica Segura
Histórico
A primeira colecistectomia laparoscópica foi realizada por Mouret em Lyon, em 1988, com o primeiro relato escrito por Dubois em 1989. Reddick popularizou o procedimento nos Estados Unidos em 1990.
Indicações e Contraindicações
Indicações:
- Mesmas da colecistectomia aberta.
- O cirurgião deve estar adequadamente treinado para realizar o procedimento.
- Manifestações de cálculos biliares sintomáticos: cólica biliar, histórico de icterícia, colecistite crônica e aguda.
- Pancreatite por cálculos biliares.
- Colecistite acalculosa.
- Pólipos grandes na vesícula biliar.
Contraindicações:
- Não há contraindicações absolutas.
- Contraindicações relativas incluem cirrose, hipertensão portal, diátese hemorrágica e gravidez, podendo requerer modificações técnicas.
Investigação Pré-operatória e Preparação
- Testes de Função Hepática: Essenciais para avaliar a função hepática.
- Ultrassonografia: Tipicamente realizada para avaliar a condição da vesícula biliar.
- Estudos Nucleares: Utilizados para avaliar a função da vesícula biliar na colecistite acalculosa.
- Tomografia Computadorizada (TC): Necessária se houver suspeita de câncer na vesícula biliar ou grandes pólipos.
- CPRE (Colangiopancreatografia Retrógrada Endoscópica): Não realizada rotineiramente no pré-operatório.
- Antibióticos Profiláticos: Administrados na indução.
- Medidas Antitrombóticas: Devem ser tomadas medidas preventivas adequadas.
Variações Anatômicas

- As principais variações anatômicas envolvem o ducto biliar comum e a artéria hepática direita.
- Variações do Ducto Biliar Comum: Um ducto biliar comum muito pequeno pode ser confundido com o ducto cístico e excisado.
- Variações de Junção dos Ductos Hepáticos: Junções baixas dos ductos hepáticos ou aberturas diretas da bolsa de Hartmann podem levar à identificação e divisão incorreta dos ductos.
- Ausência de Ducto Cístico: Em alguns casos, a bolsa de Hartmann se abre diretamente no ducto hepático direito ou no ducto comum, complicando o procedimento.
Complicações Intraoperatórias
- Hemorragia: Geralmente ocorre de uma artéria cística curta ou da artéria hepática direita. A hemorragia da veia porta é rara, mas torrencial, exigindo conversão imediata para cirurgia aberta.
- Falha de Progressão: Se o procedimento não está progredindo, deve ser convertido para colecistectomia aberta.
- Lesão do Ducto Biliar: Técnicas adequadas e conversão oportuna para cirurgia aberta minimizam o risco. Consultar imediatamente um especialista em hepatobiliar se ocorrer uma lesão.
Complicações Pós-operatórias
- Fugas Biliares: A maioria é de baixo volume e resolve-se espontaneamente. Fugas de alto volume requerem CPRE para avaliação e manejo.
- Coleção Subfrênica: Pode necessitar de drenagem percutânea.
- Pneumonia: Tratada com fisioterapia e antibióticos.
- Icterícia: Indica obstrução ou lesão maior do ducto, necessitando de CPRE ou encaminhamento a um especialista.
Dicas do Cirurgião Sênior
- Hipertensão Portal e Cirrose: Considerar colecistectomia parcial para evitar hemorragias com risco de vida.
- Colecistite Aguda Severa: Descomprimir a vesícula biliar aspirando seu conteúdo para torná-la mais manejável.
- Cálculo Impactado na Bolsa de Hartmann: Empurrar o cálculo de volta para a vesícula biliar para permitir a manipulação segura do triângulo de Calot.
Técnicas Específicas
Ilustração da Técnica:
- Posicionamento dos Instrumentos: A vesícula biliar é levantada em direção cefálica com um primeiro fórceps inserido pelo portal na linha médio-clavicular, logo abaixo do rebordo costal, para segurar o pescoço da vesícula. Um segundo fórceps é inserido pelo portal na linha axilar anterior para empurrar o cólon e o duodeno para baixo, liberando o campo de visão.
- Incisão na Serosa: A incisão na serosa sobre a junção do ligamento hepatoduodenal é estendida paralelamente a uma linha a 5 mm da borda do fígado, melhorando a visualização do triângulo de Calot.
- Manobras de Tração: O pescoço da vesícula é retraído para baixo e a serosa é retraída para cima com o segundo fórceps, criando contra-tração e ampliando a visualização do triângulo de Calot. Isso também evita lesões térmicas desnecessárias na superfície do fígado.
- Dissecção e Identificação: Tecidos adiposos e bandas fibrosas são removidos até que a relação anatômica entre o ducto cístico e a artéria cística seja clara. A eletrocauterização é usada com cautela para evitar lesões térmicas no ducto biliar comum.
- Colangiografia Intraoperatória: Protagonistas da colangiografia intraoperatória sugerem que essa investigação pode minimizar o risco de lesão do trato biliar extra-hepático, fornecendo um registro anatômico preciso. No entanto, a dissecção cuidadosa e a identificação dos ductos são essenciais.
Complicações durante a Colecistectomia Laparoscópica:
- Cálculos Múltiplos e Aderências: Podem dificultar o procedimento e aumentar o risco de complicações, como lesões térmicas em órgãos adjacentes.
- Hemorragia e Fugas Biliares: A hemorragia deve ser controlada com coagulação ou clipes, e as fugas biliares são geralmente geridas com endoloop após aspiração da bile.
- Extração de Cálculos: Cálculos que escapam devem ser removidos com fórceps para prevenir abscessos intra-abdominais.
Conclusão
A colecistectomia laparoscópica é um procedimento padrão com indicações específicas. A preparação pré-operatória, conhecimento das variações anatômicas e técnicas cirúrgicas meticulosas são cruciais para o sucesso. O manejo eficaz das complicações intra e pós-operatórias garante a segurança e a recuperação do paciente.

Lesão da Via Biliar Durante a Colecistectomia
A lesão da via biliar é uma complicação significativa tanto na colecistectomia aberta quanto na laparoscópica. Na colecistectomia aberta, o risco é de aproximadamente 1 em 1000 casos. No entanto, na colecistectomia laparoscópica as taxas de lesão da via biliar comum variam entre 0,2% e 3%.
Popularidade da Colecistectomia Laparoscópica
Apesar do maior risco de lesão na colecistectomia laparoscópica, sua popularidade continua a crescer entre cirurgiões e o público em geral. Este aumento se deve aos benefícios percebidos, como menor dor pós-operatória, cicatrizes menores e recuperação mais rápida. No entanto, essas vantagens podem ser rapidamente anuladas por uma única lesão da via biliar.
Fatores de Risco e Procedimentos
Estudos, como o de Easter e Moossa, mostraram que a dissecção a laser está associada a um maior risco de lesão em comparação com o uso de eletrocautério. As lesões ocorrem frequentemente devido à dificuldade de visualização clara do campo operatório, exacerbada por inflamação, cicatrizes ou sangramento na região do triângulo de Calot.
Diferenças na Tração Durante a Cirurgia
Durante a colecistectomia aberta, as forças opostas aplicadas ao fígado e ao duodeno tendem a alinhar o ducto biliar comum de maneira a minimizar sua angulação. Em contraste, na colecistectomia laparoscópica, a tração lateral e cefálica na vesícula biliar pode fazer com que o ducto cístico e o ducto biliar distal fiquem alinhados no mesmo plano, aumentando o risco de confusão anatômica e lesão inadvertida do ducto hepático comum.
Estratégias de Prevenção
Para minimizar o risco de lesões, recomenda-se uma tração lateral do fundo da vesícula biliar e uma dissecção cuidadosa no nível do infundíbulo antes da aplicação de clipes ou divisão das estruturas no triângulo de Calot. A colangiografia intraoperatória é fundamental sempre que houver dúvida sobre a anatomia, pois pode ajudar a identificar anomalias anatômicas ou lesões antes que ocorram complicações graves.
Importância do Reconhecimento Precoce
Os sintomas pós-operatórios de anorexia, íleo, náuseas ou vômitos que não melhoram conforme esperado após uma colecistectomia laparoscópica podem indicar uma lesão ductal. A detecção precoce dessas lesões e o reparo imediato por um cirurgião experiente são essenciais para um bom prognóstico a longo prazo. Lesões não detectadas durante o procedimento inicial frequentemente resultam em complicações mais graves, como peritonite biliar e estenoses anastomóticas.
Considerações Finais
Embora a colecistectomia laparoscópica ofereça vantagens significativas, é crucial que os cirurgiões estejam cientes de seus riscos e limitações. A conscientização e o reconhecimento dos fatores de risco podem ajudar a alcançar o nível de segurança esperado na colecistectomia aberta, garantindo melhores resultados para os pacientes.
Colecistectomia Segura
A colecistectomia laparoscópica, amplamente utilizada para a remoção da vesícula biliar, oferece muitas vantagens em relação à técnica aberta tradicional. Entre os benefícios estão a redução da dor pós-operatória, menor tempo de internação hospitalar e recuperação mais rápida. No entanto, esses benefícios não devem compensar a maior incidência de lesões no ducto biliar comum associada ao procedimento laparoscópico em determinadas situações.
Riscos das Lesões no Ducto Biliar
Como enfatizado por Sackier, lesões no ducto biliar comum podem resultar em complicações graves, muitas vezes referidas como “aleijados biliares”. Essas lesões podem levar a estenoses recorrentes, necessitando de múltiplas cirurgias e aumentando o risco de cirrose biliar secundária e falência hepática. O ditado cirúrgico, “o único pecado capital na cirurgia das vias biliares é a lesão do ducto biliar comum”, reflete a gravidade dessas complicações. A morbidade e mortalidade associadas a essas lesões são altas: mais de 25% dos pacientes sofrem complicações em cirurgias de seguimento e a mortalidade pós-operatória imediata de estenoses benignas do ducto biliar é de 8,3%, com uma mortalidade a longo prazo de 13%. A principal causa de morte nesses pacientes é a falência hepática, resultante de sepse ou lesão no suprimento sanguíneo do fígado, ou desenvolvendo-se como cirrose biliar e hipertensão portal.
Incidência e Prevenção
Nos Estados Unidos, são realizadas aproximadamente 500.000 colecistectomias anualmente. Em colecistectomias abertas, o risco de lesão no ducto biliar comum é de cerca de 0,1%, ou seja, 500 pacientes por ano. Para a técnica laparoscópica, os dados variam, com estudos iniciais relatando incidências de 0 a 7%. Estudos mais recentes indicam riscos entre 0,2% e 0,3%, o que significa que cerca de 1.500 pacientes por ano podem sofrer lesões no ducto biliar comum, uma incidência duas a três vezes maior em comparação com a técnica aberta. Trabalhos mais recentes mostram atualmente uma equiparação nos índices de lesões das vias biliares.
Estratégias Preventivas
Para minimizar o risco de lesões, diversas estratégias foram desenvolvidas com base na literatura relevante e nas práticas do Columbia-Presbyterian Medical Center:
- Seleção Apropriada de Pacientes: A colecistectomia laparoscópica não deve ser a escolha para todos os pacientes. Fatores de risco como cicatrizes abdominais, inflamação aguda severa e obesidade grave devem ser consideradas no momento do planejamento cirúrgico.
- Dissecção Cuidadosa: Identificação meticulosa da anatomia é crucial, especialmente devido às limitações visuais bidimensionais da cirurgia laparoscópica.
- Uso do Laparoscópio de 30°: Este oferece uma visão mais ampla do ducto biliar comum, permitindo uma visualização mais segura.
- Retração Apropriada: A tração cefálica no fundo da vesícula biliar e tração posterior e lateral no infundíbulo são necessárias para evitar a distorção do ducto biliar comum.
- Dissecção do Junção Ducto Cístico-Vesícula Biliar: Diferenciar entre o ducto cístico entrando na vesícula e alargando-se no infundíbulo é vital.
- Identificação do Junção Ducto Cístico-Ducto Biliar Comum: A junção deve ser visualizada e o caminho do ducto biliar comum deve ser determinado.
- Relaxamento da Retração: Relaxar a retração no infundíbulo antes de clipar o ducto cístico garante que o ducto biliar comum não esteja sendo tracionado.
- Manutenção de um Remanescente Longo do Ducto Cístico: Evita lesões no ducto biliar comum.
- Evitar Procedimentos Potencialmente Lesivos Próximos à Porta Hepática: Dissecção afiada aumenta o risco de sangramento e lesão.
- Uso liberal de Colangiografia Intraoperatória: Dúvidas na anatomia e diagnosticar lesões imediatamente para reparo imediato (caso o cirurgião tenha experiência em cirurgia hepatobiliar) melhora significativamente os resultados.
- Baixo Limite para Conversão para Cirurgia Aberta: Converte-se para a técnica aberta diante de circunstâncias difíceis, em especial o sangramento, para garantir segurança.
- Curva de Aprendizado: A maioria das lesões no ducto biliar comum ocorre devido à inexperiência (<50 casos). Programas de treinamento adequados podem reduzir essas lesões.
Considerações Finais
Apesar da baixa incidência geral de lesões no ducto biliar comum durante a colecistectomia laparoscópica, a preocupação com o aumento de lesões em comparação com a técnica aberta é válida. As lesões causadas pela técnica laparoscópica são mais extensas e difíceis de reparar, frequentemente ocorrendo em pacientes jovens e saudáveis. As vantagens da colecistectomia laparoscópica não trazem benefícios se aumentarem a possibilidade de lesões graves. Essas medidas preventivas e estratégias adequadas podem tornar a colecistectomia laparoscópica tão segura quanto, ou até mais segura do que, a técnica aberta.
Mechanisms of Bile Duct Injury
Mechanism of Bile Duct Injury: Understanding the Risks in Laparoscopic Cholecystectomy
Introduction
Laparoscopic cholecystectomy, the “gold standard” for treating symptomatic gallbladder disease, has transformed surgical practice since its introduction in the early 1990s. Despite its widespread adoption and the improved safety profile over time, the procedure remains fraught with risks, particularly bile duct injuries (BDIs). The incidence of BDIs during laparoscopic cholecystectomy has declined from its peak, but this complication still represents a significant challenge in digestive surgery, leading to substantial morbidity, mortality, and legal consequences. In Brazil, where an estimated 300,000 cholecystectomies are performed annually, BDIs continue to be a significant concern. This article delves into the mechanisms of bile duct injuries during laparoscopic cholecystectomy, exploring the factors that contribute to these adverse events and their implications for surgical practice.
Development of the Theme
The advent of laparoscopic cholecystectomy marked a turning point in the management of gallbladder disease, offering patients reduced postoperative pain, shorter hospital stays, and faster recovery times. However, the initial enthusiasm for this minimally invasive approach was tempered by a notable increase in bile duct injuries. As surgeons adapted to the new technique, the incidence of BDIs spiked, with early reports indicating injury rates as high as 0.7%. Today, with increased experience and refined techniques, the incidence has decreased to approximately 0.1% to 0.2%. Despite these improvements, the risk remains significant, with estimates suggesting that one in three general surgeons will cause a bile duct injury at some point in their careers.
Iatrogenic bile duct injuries are most often the result of perceptual errors in identifying biliary anatomy during surgery. The most common injury involves a complete transection of the common bile duct, which is also the most difficult to manage. Typically, excessive cephalad retraction of the gallbladder fundus or insufficient lateral retraction on the infundibulum leads to an alignment of the cystic and common bile ducts, causing the common bile duct to be mistaken for the cystic duct. This misidentification results in clipping and transecting the common bile duct—a scenario that can lead to devastating outcomes if not promptly recognized and appropriately managed.
Inflammatory conditions, such as acute or chronic cholecystitis, further complicate the surgical landscape. Thickened and friable tissue, along with adhesions, can obscure normal anatomical landmarks, increasing the difficulty of the procedure. Aberrant biliary anatomy, such as a low-lying right hepatic duct, poses additional risks, as these anatomical variations can be easily overlooked during surgery, leading to unintended ductal injury.
Energy sources used for hemostasis, such as electrocautery, introduce another layer of complexity. Excessive or inappropriate use of these tools can damage the bile duct or its blood supply, resulting in stricture formation or bile leaks. Another common mechanism of injury occurs when a clip is inadvertently placed across the common bile duct, often in a hurried attempt to control bleeding from the hilum without a clear view of the anatomy.
In the context of laparoscopic cholecystectomy, BDIs are particularly perilous when the common bile duct is mistaken for the cystic duct. This classical injury pattern, first described by Davidoff and colleagues, typically involves clipping and dividing the common bile duct, with further proximal dissection leading to injury of the right hepatic artery and more proximal ductal structures, including the common hepatic duct and intrahepatic ducts. Poor visualization due to inadequate illumination, excessive smoke, or intraoperative bleeding exacerbates these risks, making meticulous surgical technique and optimal visualization crucial to avoiding these injuries.
Key Points
- Perceptual Errors: The primary mechanism of bile duct injury during laparoscopic cholecystectomy is the misidentification of biliary anatomy, particularly the confusion between the cystic and common bile ducts.
- Risk Factors: Inflammatory conditions, aberrant anatomy, and excessive use of energy devices significantly increase the risk of bile duct injuries.
- Incidence: Despite advancements in technique, bile duct injuries remain a significant concern, with a 0.1% to 0.2% incidence in laparoscopic cholecystectomy. In Brazil, the annual rate of cholecystectomies underscores the importance of vigilance in preventing these injuries.
- Complications: Bile duct injuries can lead to severe complications, including biliary stricture, leakage, infection, and even death. The financial and legal implications further highlight the need for preventive measures.
Conclusion
Understanding the mechanisms of bile duct injury during laparoscopic cholecystectomy is crucial for improving surgical outcomes and minimizing patient morbidity. Surgeons must remain vigilant in identifying biliary anatomy, particularly in the presence of risk factors such as inflammation and aberrant anatomy. Enhanced visualization techniques, careful dissection, and judicious use of energy devices are essential strategies to reduce the incidence of BDIs. As the field of minimally invasive surgery continues to evolve, ongoing education and training in these areas are paramount to ensuring patient safety and improving the quality of care.
In the words of Alexis Carrel, “There is no such thing as minor surgery, but there are many minor surgeons”. This sentiment is particularly relevant to the surgical treatment of biliary diseases, where the combination of skill, experience, and compassion is vital to patient outcomes.
Did you like it? Leave us a comment ✍️, share on your social networks, and | or send your question via 💬 Online Chat in our Instagram DM.
LaparoscopicCholecystectomy #BileDuctInjury #SurgicalComplications #DigestiveSurgery #SurgicalEducation
Prevention of Bile Duct Injury
Prevention of Bile Duct Injury During Laparoscopic Cholecystectomy
Introduction
Bile duct injury (BDI) during laparoscopic cholecystectomy is a significant surgical complication with profound clinical and medico-legal implications. The incidence of BDI ranges from 0.3% to 0.6%, despite advances in surgical techniques and imaging modalities. The prevalence of BDI remains concerning due to its association with high morbidity and mortality rates. Patients who suffer from BDI often face prolonged hospital stays, multiple surgeries, and long-term complications such as bile leakage, strictures, and secondary biliary cirrhosis. Medico-legally, BDI is one of the most common reasons for litigation against surgeons, often resulting in significant financial settlements and professional repercussions.
Questions and Answers
Question 1: What technique should be used to identify the anatomy during laparoscopic cholecystectomy?
Answer: The Critical View of Safety (CVS) is recommended for identifying the cystic duct and cystic artery.
Key Findings: The incidence of BDI was found to be 2 in one million cases using CVS, compared to 1.5 per 1000 cases with the infundibular technique.
Question 2: When should intraoperative cholangiography (IOC) be used?
Answer: IOC should be used in cases of anatomical uncertainty or suspicion of bile duct injury.
Key Findings: IOC aids in the prevention and immediate management of BDI by providing a precise assessment of biliary anatomy during surgery.
Question 3: What are the recommendations for managing patients with confirmed or suspected bile duct injury?
Answer: Patients with confirmed or suspected BDI should be referred to an experienced surgeon or a multidisciplinary hepatobiliary team.
Key Findings: Early referral to hepatobiliary specialists is associated with better long-term outcomes and lower complication rates.
Question 4: Should the “fundus-first” technique be used when CVS cannot be achieved?
Answer: Yes, the “fundus-first” technique is recommended when CVS cannot be achieved.
Key Findings: This technique is effective for safely dissecting the gallbladder in complex cases where anatomy is unclear.
Question 5: Should CVS be documented during laparoscopic cholecystectomy?
Answer: Yes, documenting CVS with double-static photographs is recommended.
Key Findings: Photographic documentation of CVS ensures correct anatomical identification and serves as a record for later review in case of complications.
Question 6: Should near-infrared biliary imaging be used intraoperatively?
Answer: The evidence for near-infrared biliary imaging is limited; thus, IOC is preferred.
Key Findings: IOC is more widely studied and proven effective in preventing BDI compared to near-infrared imaging.
Question 7: Should surgical risk stratification be used to mitigate the risk of BDI?
Answer: Yes, surgical risk stratification is recommended.
Key Findings: Risk stratification helps identify patients at higher risk of complications, aiding in surgical planning and decision-making.
Question 8: Should the presence of cholecystolithiasis be considered in risk stratification?
Answer: Yes, the presence of cholecystolithiasis should be considered in risk stratification.
Key Findings: Patients with cholecystolithiasis have a higher risk of complications during cholecystectomy, making it important to include this condition in risk assessments.
Question 9: Should immediate cholecystectomy be performed in cases of acute cholecystitis?
Answer: Yes, immediate cholecystectomy within 72 hours is recommended.
Key Findings: Surgery within 72 hours of the onset of acute cholecystitis symptoms is associated with lower complication rates and better patient recovery.
Question 10: Should subtotal cholecystectomy be performed in cases of severe inflammation?
Answer: Yes, subtotal cholecystectomy is recommended in cases of severe inflammation where CVS cannot be obtained.
Key Findings: In severe inflammation scenarios, subtotal cholecystectomy can facilitate the surgery and reduce the risk of BDI.
Question 11: Which approach is preferable, four-port laparoscopic cholecystectomy or reduced-port/single-incision?
Answer: Four-port laparoscopic cholecystectomy is recommended as the standard approach.
Key Findings: The four-port technique is the most studied, showing effectiveness and safety in performing cholecystectomies with lower complication risks.
Question 12: Should interval cholecystectomy be performed following percutaneous cholecystostomy?
Answer: Yes, interval cholecystectomy is recommended after initial stabilization with percutaneous cholecystostomy.
Key Findings: Interval cholecystectomy offers better long-term outcomes and lower risk of recurrent complications compared to no additional treatment.
Question 13: Should laparoscopic cholecystectomy be converted to open in difficult cases?
Answer: Yes, conversion to open surgery is recommended in cases of significant difficulty.
Key Findings: Conversion to open surgery can prevent BDI in situations where laparoscopic dissection is extremely difficult or risky.
Question 14: Should a waiting time be implemented to verify CVS?
Answer: Yes, a waiting time to verify CVS is recommended.
Key Findings: A waiting time allows better anatomical evaluation before proceeding with dissection, reducing the risk of BDI.
Question 15: Should two surgeons be used in complex cases?
Answer: The presence of two surgeons can be beneficial in complex cases, although strong recommendations are not made due to limited evidence.
Key Findings: Some studies suggest that collaboration between two surgeons can improve anatomical identification and reduce complications in difficult cases.
Question 16: Should surgeons receive coaching on CVS to limit the risk or severity of BDI?
Answer: Yes, surgeons should receive coaching on CVS.
Key Findings: Surgeons who receive targeted coaching on CVS show improved anatomical identification and reduced rates of BDI.
Question 17: Should simulation or video-based education be used to train surgeons?
Answer: Yes, simulation or video-based education should be used.
Key Findings: These training methods enhance technical skills, increase surgical precision, and reduce the incidence of BDI during laparoscopic cholecystectomy.
Conclusion
The consensus recommendations provide evidence-based approaches to minimize bile duct injury during laparoscopic cholecystectomy. Practices such as the critical view of safety (CVS), intraoperative cholangiography (IOC), and early referral to specialists can significantly improve surgical outcomes and reduce complications. As famously stated, “The history of surgery is the history of the control of bleeding,” a phrase that underscores the importance of meticulous surgical technique and the prevention of complications like bile duct injuries.
REVISIONAL BARIATRIC SURGERY
- INTRODUCTION
Morbid obesity is a global chronic disease affecting 13% of people worldwide. Weight loss surgery has been proven to be effective in addressing this chronic disease and its associated comorbidities. In 2016, over 200,000 procedures were performed in the United States, and the volume continues to grow. Cases analyzed between 2015 and 2018 indicate an overall growth rate of 21.9%. The most common surgeries performed in the United States are Roux-en-Y gastric bypass (RYGB), sleeve gastrectomy (SG), and biliopancreatic diversion with duodenal switch (BPD/DS). Estimated mean weight loss is 33% of the initial body weight. Unfortunately, it is estimated that up to 25% of patients will have weight regain after primary surgery. Weight regains or recidivism has emerged as a clinical entity and important public health issue given its association with re-emergence of obesity related comorbidities, worsening quality of life, and increased healthcare costs. With the increased number of primary bariatric surgery performed worldwide, revisional surgery has also increased, and it has been shown to be the fastest-growing category of bariatric procedures, currently representing 7 to 15% of all bariatric operations and long-term rates of revisional surgery have been estimated to be as high as 56%.
2. CAUSES
Weight regain is estimated in up to 25% of patients following primary bariatric surgery. In addition, it is estimated that more than 80% of the weight regain happens within the first 6 years following primary surgery. A major factor contributing to weight regain is lack of adherence to recommended followup visits, observed in approximately 60% of patients 4 years after primary surgery. The etiology of weight regain has been attributed to:
• Noncompliance with dietary recommendations.
• Hormonal/metabolic imbalance.
• Mental health.
• Physical inactivity.
• Anatomic/surgical factors.
• Medications.
3. PREOPERATIVE EVALUATION
A multidisciplinary evaluation is essential prior to recommending revisional surgery to patients presenting with weight gain. As with primary surgery, a nutritional evaluation, behavioral/psychological assessment, and endoscopic and contrast series studies should be obtained. The latter will not only aid in establishing an anatomic etiology for weight regain if present, but it will also aid in choosing the type of revisional surgery.
4. SELECTING THE TYPE OF REVISIONAL SURGERY
There are several revisional procedures following primary bariatric surgery. The choice of revisional surgery is tailored according to initial surgery, cause of failure, and surgeon’s experience. Multiple revisional surgeries have been described for all primary bariatric surgeries, but no standardized guidelines have been established. In June 2019, 70 experts from 27 countries formed a committee and created the first consensus on revisional bariatric surgery. An agreement of 70% or more was considered consensus. Consensus was achieved in several points including but not limited to:
(1) RBS is justified in some patients;
(2) RBS is more technically challenging than the respective primary bariatric surgery;
(3) second or third RBS can be justified in some patients;
(4) candidates should undergo a nutritional assessment, psychological evaluation, endoscopy, and a contrast series;
(5) RYGB, one anastomosis gastric bypass (OAGB), and SADI-S are options after gastric banding; and
(6) OAGB, BPD/DS, and SADI-S are options after sleeve gastrectomy. Regarding revision for primary RYGB, the only consensus obtained was lengthening of the biliopancreatic limb as RBS option for RYGB or OAGB.
Roux-En-Y Gastric Bypass
Roux-en-Y gastric bypass is one of the most common weight loss procedures performed worldwide and is considered by many to be the gold standard. Unfortunately, approximately 10–34% of patients experience inadequate weight loss or weight gain and may ultimately require revision. The most common etiology of weight regain is pouch dilation. Other reported etiologies include enlarged gastric pouch greater than 5 cm in diameter, wide gastro-jejunal anastomosis (GJA), anastomosis greater than 1 cm, GJA > 1.5 cm in diameter, dilated GJA greater than or equal to 2 cm, pouch >30 mL, pouch dilation >120 mL, weight recidivism with or without gastric fistula, gastric fistula, short-limb bypass, and hyperphagic behavior. Multiple revisional surgeries have been described. In a recent systemic review and meta-analysis, distal Roux-en-Y gastric bypass (DRGB) alone showed the highest decrease in BMI at 1-year follow-up versus biliopancreatic diversion with duodenal switch (BPD/DS) or single anastomosis duodeno-ileal bypass and sleeve gastrectomy (SADI-S) at 3-year follow-up. Overall, they found maximal BMI decrease in DRGB alone, followed by BPD/DS or SADI-S, laparoscopic pouch and/or GJA resizing, and endoscopic pouch and/or GJA resizing.
Sleeve Gastrectomy
Sleeve gastrectomy (SG) is currently the most commonly performed bariatric procedure worldwide. Its relatively simple technique and low complication rate contribute to it being preferred over some other procedures. Revision is estimated in up to 30% of cases for multiple etiologies, including weight regain. Loss of restriction is one of the main anatomic factors contributing to weight regain. Although revision to RYGB or DS has been recommended as the standard of care, some studies have described revision with re-sleeve for dilation of the residual stomach as the cause. The overall %EWL following re-sleeve can be up to 57% at 12 months and up to 60% at 20 months. A retrospective study analyzed conversion from SG to either RYGB or SADI for insufficient weight loss or weight regain. Out of 140 patients, 66 patients underwent SG to SADI, and 74 patients underwent SG to RYGB. SADI was found to achieve 8.7%, 12.4%, and 19.4% more total body weight loss at 6, 12, and 24 months compared to RYGB for weight regain alone. RYGB is preferred when symptoms of reflux accompany weight regain. For patients with super morbid obesity and weight regain after SG, in the absence of reflux symptoms, conversion to biliopancreatic diversion with duodenal switch (BPD/DS) is recommended for maximal weight loss, with %EWL ranging from 70 to 80% at 2 years.
5. WEIGHT LOSS FOLLOWING REVISIONAL SURGERY
Weight loss after revisional bariatric surgery leads to significant weight loss in the long term, rates varying per procedure performed. A single-center retrospective study for patients who underwent revisional surgery for weight regain (52.4%) S. Ardila et al. analyzed weight loss at 3-, 6-, 9-, and 12-month intervals. Patients with a primary restrictive procedure and reflux symptoms underwent conversion to either RYGB or BPD/DS and experienced 50–65.3%EWL at 3 months and 50.1–79.1%EWL at 12 months. Patients with initial RYGB underwent GJ revision for pouch or GJ abnormalities. For those without anatomic abnormalities, they underwent conversion to distal bypass. At 3 months, %EWL was 36.6 for GJ revision and 37.5% for distal revision.
6. Complications of Revisional Surgery
Revisional bariatric surgery is complex, is technically demanding, and is therefore associated with higher morbidity and mortality. Compared to primary surgery, revisional surgery has been associated with higher rates of postoperative complications, longer operative times, longer hospital stay, conversion to open surgery, readmission, and unplanned admission to the critical care unit. In comparing primary versus revisional RYGB, revisional surgery was associated with higher rates of leak, hemorrhage, wound infection, stricture, ulcer, perforation, and hernia. A single-center retrospective study analyzed complications after revisional surgeries performed at their center for weight regain between 2012 and 2015. Of 84 patients, 43 presented for weight regain (52.4%). Complications included incarcerated ventral hernia following AGB conversion to SG, anastomotic leak and recurrent intussusception following gastro-jejunostomy revision, and stricture and marginal ulcer following AGB conversion to RYGB . In summary, reported complications of revisional bariatric surgery are:
• Hernia.
• Anastomotic leak.
• Stricture.
• Marginal ulcer.
• Wound infection.
• Hemorrhage.
• Perforation.
• Obstruction.
Conclusion
Weight regain after primary bariatric surgery is multifactorial. It is imperative to establish guidelines for classifying weight gain in order to guide subsequent intervention and thus to aid bariatric teams internationally in the management of this clinical entity. Revisional surgery has been shown to be a successful treatment option for patients presenting with weight gain, with rates of weight loss nearing those seen after primary surgery. Furthermore, the importance of revisional surgery lies in its ability to readdress many of the obesity-related comorbidities which prompted the primary procedure. When indicated, it is important to tailor the type of revisional surgery to each patient. Although Roux-en-Y gastric bypass remains the most common type of revisional surgery after primary surgery of any type, duodenal switch is emerging as the revision procedure of choice for superobese patients and patients with failed sleeve gastrectomy secondary to weight regain in the absence of reflux symptoms.
Revisional Surgery for Weight Regain
- Introduction
Revisional bariatric surgery is a weight loss surgery for people who have not lost enough weight or have regained weight after their first bariatric surgery. It is a complex and technically demanding procedure, but it can be a successful treatment option for patients with weight regain.
- Causes of Weight Regain
There are many factors that can contribute to weight regain after bariatric surgery, including:
* Lack of adherence to dietary recommendations
* Hormonal/metabolic imbalance
* Mental health
* Physical inactivity
* Anatomic/surgical factors
* Medications
- Preoperative Evaluation
Before revisional surgery, patients will undergo a thorough evaluation to determine if they are eligible for the procedure. This evaluation will include a medical history and physical exam, as well as blood tests, imaging studies, and a psychological evaluation.
- Selecting the Type of Revisional Surgery
The type of revisional surgery that is best for a patient will depend on a number of factors, including the type of primary surgery they had, the cause of their weight regain, and their overall health. Some of the most common types of revisional surgery include:
* Roux-en-Y gastric bypass (RYGB)
* Sleeve gastrectomy (SG)
* Biliopancreatic diversion with duodenal switch (BPD/DS)
* Single anastomosis gastric bypass (OAGB)
* Sleeve gastrectomy with duodenal switch (SADI-S)
- Weight Loss Following Revisional Surgery
Weight loss after revisional surgery can be significant. In one study, patients who underwent revisional surgery for weight regain lost an average of 50–65.3% of their excess weight after 3 months and 50.1–79.1% of their excess weight after 12 months.
- Complications of Revisional Surgery
Revisional surgery is more complex and technically demanding than primary bariatric surgery, and therefore carries a higher risk of complications. Some of the most common complications of revisional surgery include:
* Hernia
* Anastomotic leak
* Stricture
* Marginal ulcer
* Wound infection
* Hemorrhage
* Perforation
* Obstruction
- Conclusion
Revisional bariatric surgery can be a successful treatment option for patients with weight regain. However, it is important to carefully consider the risks and benefits of the procedure before making a decision. Patients should also work closely with their healthcare team to choose the best type of revisional surgery for them and to prepare for the procedure and its aftermath. Revisional bariatric surgery is a complex and technically demanding procedure, but it can be a successful treatment option for patients with weight regain. It is important to work closely with your healthcare team to determine if you are eligible for the procedure and to choose the best type of surgery for you.
Wasteland in the Operating Room: Reflections on Medical Practice
“April is the cruellest month” – This T.S. Eliot verse may, in a way, resonate in the hallways of hospitals. April, for many, signifies the onset of spring, but in the operating room, it can symbolize the start of intense challenges.
“Mixing memory and desire” – As surgeons, we are constantly challenged to balance past experiences with future aspirations. The memory of previous cases shapes our desire to refine techniques and achieve better outcomes for our patients.
“Spring is dead, buried is hope” – Post-operative desolation often mirrors this verse. Surgery is at times a painful and grueling process, but it is in these moments that our hope for recovery and healing remains steadfast.
“Here is no water but only rock” – The operating room, with its sterile white surfaces, may seem devoid of life. Yet, it is here that life is preserved and restored, where the line between mortality and survival is drawn with surgical precision.
“Shaking the bitter foam of past experience” – As healthcare professionals, we are compelled to learn from each procedure. Every case is an opportunity for refinement, a chance to perfect our skills and grasp the intricacies of medicine.
“I cannot help but think/ This that we believe to be the end is only the beginning” – When the scalpel glides, when the sutures are closed, it is crucial to remember that the conclusion of a surgery is just the start of the patient’s recovery process. Hope is renewed in the promise of a healthier tomorrow.
“In the waiting room, gazing at the sky” – Even in moments of pre-operative anxiety, we look to the future with optimism. We know that medicine is a journey of challenges and triumphs, and each patient is a star in the sky of our professional experience.
“Here we are, contemplating the horizon” – In our medical careers, we face each day with determination and resilience. We are always keeping an eye on the horizon, seeking new techniques, advancements, and opportunities to enhance patient care.
“Shantih shantih shantih” – At the end of each procedure, when silence fills the operating room, it is a tranquil reminder that, even amidst complexity and challenges, medicine is ultimately an act of compassion and healing.
Just as in T.S. Eliot’s “The Waste Land,” in medicine and surgery, desolation and hope intertwine. Each procedure is an opportunity for learning and renewal. Through dedication and a commitment to patient well-being, we find our “shantih,” the peace we seek throughout this medical journey.

10 Anatomical Aspects for Prevention the Bile Duct Injury
Essential aspects to visualize and interpret the anatomy during a cholecystectomy:
1. Have the necessary instruments for the procedure, with adequate positioning of the trocars and a 30-degree optic.
2. Cephalic traction of the gallbladder fundus and lateral traction (pointing to the patient’s right shoulder), to reduce redundancy of the infundibulum.
3. Puncture and evacuation of the gallbladder to improve its retraction, in cases where traction cannot be performed easily (acute cholecystitis).
4. Lateral and caudal traction of the infundibulum, for correct exposure of Calot’s triangle, exposing the CD and artery.
5. “Critical view of Safety” to avoid misidentification of the bile ducts, ensuring that only two structures (CD and artery) are attached to the gallbladder. For this, they must be dissected separately, and the proximal third of the gallbladder must be moved from its fossa, to ensure that there is no anatomical variant there.
6. Systematic use of intraoperative cholangiography. Ideally by transcystic route or possibly by a puncture of the gallbladder.
7. Ligation of the cystic duct with knots (“endoloop”) to prevent migration of metallic clips that could condition a postoperative leak.
8. In case of severe inflammation of the gallbladder pedicle, with its retraction or lack of recognition of cystic structures, a subtotal cholecystectomy might be indicated.
9. In case of hemorrhage, avoid indiscriminate clip placement and or blind cautery. Opt for compressive maneuvers and, once the bleeding site has been identified, evaluate the best method of hemostasis.
10. If the surgeon is not able to resolve the injury caused, it is always better to ask for help from a colleague, and if necessary, to refer the patient to a specialized center.
#SafetyFirst
The main goal in the postoperative management of BDI is to control sepsis in the first instance and to convert an uncontrolled biliary leak into a controlled external biliary fistula to achieve optimal local and systemic control. Definitive treatment to re-establish biliary continuity will be deferred once this primary goal is achieved and should not be obsessively pursued in the acute phase. The factors that will determine the initial presentation of a patient with a BDI in the postoperative stage are related to the time elapsed since the primary surgery, the type of injury, the mechanism of injury, and the overall general condition of the patient.
Sobre o FUTURO
Aos cinco anos, o que você queria ser quando crescesse?
Médico.
Tudo começou quando eu tinha por volta de 4 – 5 anos e após um acidente domiciliar, precisei passar por uma cirurgia na mão. A forma como aquele profissional que nos atendeu acalmou a angústia dos meus pais e tratou com habilidade o ferimento me marcou profundamente. Apesar de não ter ideia do que isso significaria na minha jornada futura, aquele sentimento de ação e resolução se tornou uma paixão que me acompanha até hoje.

Anatomia Cirúrgica da REGIÃO INGUINAL
A hérnia inguinal é uma condição comum que ocorre quando um órgão abdominal protraí através de uma fraqueza na parede abdominal na região abdominal. O orifício miopectineal é a principal área de fraqueza na parede abdominal onde a hérnia inguinal pode se desenvolver. O conhecimento da anatomia da parede abdominal é importante para entender a patofisiologia da hérnia inguinal e para ajudar no diagnóstico e tratamento dessa condição médica comum.
GASTROSTOMY: INDICATIONS, TECHNICAL DETAILS AND POSTOPERATIVE CARE.
Ozimo Pereira Gama Filho
Adjunct Professor at the Federal University of Maranhão
No conflict of interest
- INTRODUCTION
- HISTORICAL ASPECTS
- ANATOMICAL FUNDAMENTALS
- INDICATIONS
- TYPES & TECHNIQUES
- ADVERSE EVENTS
- CUSTO RATIO x EFFECTIVENESS
- CONCLUSIONS
SUMMARY
In the last decade, the use of gastrostomies has been widely indicated as the preferred form of access to the gastrointestinal tract for feeding in chronic conditions and during recovery from acute conditions such as trauma. Together with this increase in indications, new techniques have been developed that have made gastrostomies simpler and less risky. From the classical technique of Stamm performed by laparotomy, two new alternatives that do not require laparotomy emerged: percutaneous endoscopic gastrostomy (PEG) and fluoroscopy gastrostomy. Its main benefit is to avoid a laparotomy, with less associated postoperative pain and earlier return of gastrointestinal function. Although peg is currently widely accepted as the insertion technique of choice due to its simplicity and efficacy, there are patients who are not candidates for an endoscopic approach. In this article we seek to clarify the indications, technical aspects and perioperative care of patients undergoing gastrostomy.
Keywords: Surgical Procedures; Ostomies; Gastrostomy.
Area of Knowledge: General Surgery
- INTRODUCTION
The main indication for enteral or parenteral feeding in the perioperative period is the provision of nutritional support to supply the metabolism of patients with inadequate oral intake. Enteral feeding is the preferred method in relation to parenteral feeding in patients with gastrointestinal dysfunction in the perioperative period due to the inherent risks associated with parenteral nutritional support, such as: infectious complications of the access routes, higher operational cost, and the inability to parenteral nutrition to provide adequate enteral stimulation and subsequent involvement of the intestinal defense barrier [1,2]. In addition, enteral feeding may decrease the risk of bacterial translocation and corresponding bacteremia [3]. Gastric nutritional support is the most common type used. Access to insert the gastrostomy probe can be achieved using endoscopy, interventional radiologia, or surgical techniques (open or laparoscopic). However, since its description in the 1980s [4], percutaneous endoscopic gastrostomy (PEG) is currently considered the method of choice for medium and long-term enteral support.
1.1 Objective: This article reviews the current knowledge about GOSTROSTOMIA in the medical literature, emphasizing the technical and perioperative aspects.
- HISTORICAL ASPECTS
In 876, Verneoil [5] successfully made the first gastrostomy in humans. Since then, several technical modifications have been suggested, such as witzel’s technique in 1891, in which a subseroso tunnel is made on the probe [6]. Stamm, in 1894 [7], described one of the most performed techniques today and in the history of surgical gastrostomy, which consists in the making of suture in a pouch to invaginate the probe inserted into the stomach [8]. In 1980, percutaneous endoscopic gastrostomy was described by Gauderer et al. [4] , which transformed the technique of making gastrostomy.
- ANATOMICAL FUNDAMENTALS
The stomach is a J-shaped dilated cylindrical organ that rests in the left epigastric and hypochodrial region of the abdomen at the level of the first lumbar vertebra. It is previously limited by the left hemidiaphragm, the left lobe of the liver and a triangular portion of the anterior abdominal wall. Subsequently, the pancreas, left kidney and adrenal delimit the stomach. The spleen is posterolaterally and the transverse colon is inferior. It is fixed at two points of continuity: gastroesophageal, superiorly and the duodenal, retroperitoneally. Its ligament attachments also help you in fixation to adjacent organs: gastrophemic (diaphragm), hepatogastric or minor omentum (liver), gastrosplenic or gastrolienal (spleen), and gastrocholic or omentum major (transverse colon). The anatomical regions of the stomach can be distinguished as this: começa superiorly in the continuity of the abdominal part of the esophagus and dthe gastroesophageal junction, the cardiac part of the stomach. Soon below this portion, lies the bottom of the stomach that expands to the left extending above thegastroesophageal junction, forming an acute angle with the distal esophagus known as cardiac notches. The body s andextends as a distensible reservoir and forms a medial edge called the smallest curvature to the right and a side edge called the largest curvature on the left. The gastric den of the stomach is not anatomically distinguishable, but it is estimated to be a region of the angular isis along the distal minor curvature to a point along a lower line to the distal major curvature. It thus ends bymouthing r into the pyloric canal limited by the pyloric sphincter, a palpable thickened ring of muscle that is continuous with the first part of the duodenum.
- INDICATIONS
Gastrostomy is used in the following situations:
- Gastric decompression: can be obtained by means of temporary gastrostomy, occasionally recommended, as a complement to large abdominal operations for which gastric stems, prolonged “adynamic ileus” and digestive fistulas are foreshadowed.
- Nutritional Support: b.1 Temporary; indicated when access to the digestive tract is temporarily impaired for recovery and maintenance of nutritional status (E.g. CEsophageal EC); b.2 Definitive; as palliative therapy in patients with unresectable malignant neoplasia of the head and neck, as wellas n degenerative neurological diseases that lead to irreversible disorders of deglutition.
However, the decision to perform a gastrostomy, as well as its route (surgical, radiological or endoscopic) should be individualizedaccording to the needs, diagnosis, life expectancy of the patient and the available hospital logistics. The objective is not only to optimize perioperative recovery, to improve survival and nutritional status of the patient, but also to promote quality of life, which is not necessarily correlated with nutritional improvement only [9]. Therefore, the appropriate indication, like any other surgical intervention, must be clearly establishedand informed before it is performed. Some of the absolute contraindications of gastrostomy are summarized in Table 1. In addition to absolute contraindication conditions, other situations such as the presence of non-obstructive oromyctological oresophageal malignancy, hepatomegaly, splenomegaly, peritoneal dialysis, portal hypertension with gastric varicose veins, and a history of partial gastrectomy are also considered relative contraindications.
| ABSOLUTE CONTRA – INDICATIONS |
| Coagulopatia Severa (INR > 5, Plaquetas < 50.000 e TPT > 50s) |
| Hemodynamic Instability |
| Septic Shock |
| Refractory Ascites |
| Peritonitis |
| Dermatological infection in the upper abdomen |
| Carcinomatose Peritoneal |
| Interposition of organs that prevent gastric access |
| History of Total Gastrectomy |
| Stenosis or Pyloric Obstruction |
| Severe gastroparesis, in cases of indication for nutritional support |
| Absence of Informed Consent |
- TYPES & TECHNIQUES
Currently there are three techniques for performing gastrostomy: radiological, through percutaneous gastrostomy by fluoroscopy, percutaneous endoscopic gastrostomy (PEG) and surgical gastrostomy. Due to the didactic characteristics of this material, we will focus on endoscopic and surgical gastrostomy , which becomes the main option in the following situations: 1) when the patient will already undergo a laparotomy due to some abdominal condition ; 2) impossibility of performing gastroscopy to perform gastrostomy endoscopic percutaneous (PEG) ; 3) in case of peg technical failure; 4) unavailability of resources for the preparation of PEG or percutaneous gastrostomy by fluoroscopy.
- ENDOSCOPIC PERCUTANEOUS GASTROSTOMY
The informed consent form must be obtained from patients or their legal representatives. Patients should fast for a minimum of 8 hours and receive prophylactic antibiotics one hour before proceeding and intravenous administration of 1-2 g of cefazolin is recommended. The technique introduced by Gauderer et al [4] is the most used technique to insert the PEG gastrostomy probe. In this method, a guide wire is used, inserted in the distal gastric chamber through a needle puncture n to the anterior abdominal wall. This guide wire is then seized endoscopically with a handle and then removed through the esophagus and mouth. Subsequently, the guide wire is fixed to the end of the gastrostomy probe and then pulled from the mouth to the esophagus, stomach and then out to the abdominal wall, where it will be fixed.
- SURGICAL GASTROSTOMY
Surgical gastrostomy can be performed in two ways: 1) via laparotomy – the predominant form; and 2) laparoscopic approach. The preparations are the same as the endoscopic pathway.
5.2.1. GASTROSTOMIA At STAMM
After adequate asepsis and antisepsis, with the patient under anesthesia and in horizontal dorsal decubitus, the technical steps are as follows: 1. Median laparotomy (supraumbilical median incision); 2. Identification of the gastric body; 3. Stomach hold with Babcock tweezers (to evaluate the approach of the stomach to the peritoneum); 4. Suture in pouch (circular area of 2cm) – atraumatic absorbable thread; 5. Section of the stomach wall (0.5cm) – (incision with scalpel or Electrocautery in the center of the suture, of sufficient size, for the placement of a probe with 20 to 26 French); 6. Placement of the Gastrostomy probe in the extension of 5-6 cm, followed by suture closure in a pouch); 7. Tie the suture threads in a pouch around the probe; 8. Apply a second suture in a pouch 1cm above the first (seromuscular stitches); 9. Externalization of the probe by counter opening on the left flank; 10. Fix the stomach wall to the abdominal wall in 4 cardinal points (external ration with the two Kocher tweezers used for grip of the alba line and against traction by means of the index fingers of the wall of the left hipochondrio to approach the parietal peritoneum of the gastric wall); 11. Fixation of the probe to the skin (point with nonabsorbable wire); 12. Closure of the abdominal wall (synthesis of the wall with approximation of the alba thread by continuous suture with monofilament thread 1-0 or 2-0 and of the skin with separate points of nylon 3-0); 13. Dressing.
5.2.1 GASTROSTOMIA EM WITZEL
The initial technical steps from gastrostomy to Witzel are like those of gastrostomy to Stamm, including fixation of the probe to the stomach by a pouch suture. Then, the probe is placed on the gastric wall and a tunnel of 8-10 cm is made by seromuscular suture (continuous or with separate points of absorbable or nonabsorbable thread) covering it and externalization is performed by counteropening.
- ADVERSE EVENTS
According to the literature, the rate of complications for different procedures varies due to the heterogeneity of the samples evaluated. For surgical gastrostomy, the reported complication rates are between 1% and 35%, while for percutaneous radiological gastrostomy it is 3% to 11%, and for percutaneous endoscopic, 17%–32%, the main related adverse event is surgical site infection [10, 11]. Although considered a basic procedure, gastrostomy is associated with an extensive list of related technical complications, care and use of the probe. Serious problems related to the technique include separation of the stomach from the abdominal wall (leading to peritonitis), separation of wounds, hemorrhage, infection, lesion of the posterior gastric wall or other organs, and placement of the tube in an inappropriate place of gastric position. Separation of the stomach from the abdominal wall usually occurs due to inadvertent and premature displacement of the tube, particularly with balloon-like devices, or a rupture during a catheter change. It requires immediate attention, being treated with laparotomy, although in selected cases laparoscopic correction is possible. Most complications can be avoided with the careful choice of the type of procedure, from the appropriate ostomy device, considering it an important intervention and using meticulous technique with the proper approximation of the stomach to the abdominal wall and outflow of the probe through a counter-incision (in conventional procedures), thus avoiding probes in the midline or awfully close to the costal edge.
- COST VS. EFFECTIVENESS
A recent study [12] compared the cost associated with the different gastrostomy techniques, and the results of the evaluation showed variable the benefits of each of the individual percutaneous procedures, indicating that surgical gastrostomy was the onerous mais of the three modalities due to higher costs, complications, and recovery time, as well as the endoscopic technique presenting the cost effectiveness ratio.
- CONCLUSIONS
Despite the technique employed, the decision to performa gastrostomy is not based only on the patient’s survival expectancy, because the adequate indication provides a better quality of life even when the survival of the patient after the procedure is severely limited. Therefore, understanding of techniques, indications, complication rates is essential to guide the surgical team in the scope of multidisciplinary care, as well as the education of patients and their caregivers is vital to ensure the correct maintenance of the devices, thus ensuring adequate nutritional intake of the patient and minimizes complication rates.
References
1 Alverdy J, Chi HS, Sheldon GF. The effect of parenteral nutrition in gastrointestinal immunity. The importance of de estimulação enteral. Ann Surg, 1985; 202: 681-684 [PMID:3935061]
2 Deitch EA, Ma WJ, Ma L, Berg RD, Specian RD. Protein malnutrition predisposes to inflammation-induced intestinal origin septic states. Ann Surg, 1990; 211: 560-567; discussion 560-567 [PMID: 2111125]
3 Deitch EA, Winterton J, Li M, Berg R. The intestine as a portal of entry to bacteremia. Role of protein malnutrition. Ann Surg 1987; 205: 681-692 [PMID: 3592811]
4 Gauderer MW, Ponsky JL, Izant RJ. Gastrostomia sem laparotomy: percutaneous endoscopic technique. J Pediatrician Surg, 1980; 15: 872-875 [PMID: 6780678]
5 Anselmo CB, Tercioti Júnior V, Lopes LR, Coelho Neto JS, Andreollo NA. Surgical gastrostomy: current indications and complications in patients of a university hospital. Rev Col Bras Cir. [Internet journal] 2013;40(6). Available in URL: http://www.scielo.br/rcbc
6 Witzel O. For gastric fistula technique. Chir Zbl. 1891;18:601-4.
7 Stamm M. Gastrostomy: a new method. Med News. 1894;65:324.
8 JP grant. Comparison of percutaneous endoscopic gastrostomy com gastrostomia strain. Ann Surg. 1988;207(5):598-603
9 Bannerman E, Pendlebury J, Phillips F, Ghosh S. Cross-sectional and longitudinal study of health-related quality of life after percutaneous gastrostomy. Eur J Gastroenterol Hepatol 2000; 12: 1101-1109 [PMID: 11057455]
10 Möller P, Lindberg CG, Zilling T. Gastrostomy by various techniques: evaluation of indications, outcome and complications. Scand J Gastroenterol. 1999;34(10):1050-4.
11 Clarke E, Pitts N, Latchford A, Lewis S. A major prospective audit of morbidity and mortality associated with food gastrostomies in the community. Clin Nutr. 2017 Apr;36(2):485-490. DOI: 10.1016/j.clnu.2016.01.008. EPub 2016 January 21. PMID: 26874913.
12 Wollman B, D’Agostino HB, Walus-Wigle JR, Easter DW, Beale A (1995) Radiological, endoscopic and surgical gastrostomy: an institutional evaluation and meta-analysis of the literature. Radiology 197: 699–704.
Specific Competence of Surgical Leadership
Surgeons are uniquely prepared to assume leadership roles because of their position in the operating room (OR). Whether they aspire to the title or not, each and every surgeon is a leader, at least within their surgical team. Their clinical responsibilities offer a rich variety of interpretations that prepare them for a broader role in health care leadership. They deal directly with patients and their families, both in and out of the hospital setting, seeing a perspective that traditional health care administrative leaders rarely experience. They work alongside other direct providers of health care, in varied settings, at night, on weekends, as well as during the typical workday. They understand supply-chain management as something more than lines on a spreadsheet.
The Challenges for a Surgical Leader
Surgeons prefer to lead, not to be led. Surgical training has traditionally emphasized independence, self-reliance, and a well-defined hierarchy as is required in the OR. However, this approach does not work well outside the OR doors. With colleagues, nurses, staff, and patients, they must develop a collaborative approach. Surgeons are entrusted with the responsibility of being the ultimate decision maker in the OR. While great qualities in a surgeon in the OR, it hinders their interactions with others. They have near-absolute authority in the OR, but struggle when switching to a persuasive style while in committees and participating in administrative activities. Most surgeons do not realize they are intimidating to their patients and staff. With patients, a surgeon needs to be empathetic and a good listener. A surgeon needs to slow the pace of the discussion so that the patient can understand and accept the information they are receiving. As perfectionists, surgeons demand a high level of performance of themselves. This sets them up for exhaustion and burnout, becoming actively disengaged, going through the motions, but empty on the inside. Given the many challenges surgeons face, it is difficult for them to understand the leadership role, given its complex demands.
Specific Competencies
Authority
Although teams and all team members provide health care should be allowed input, the team leader makes decisions. The leader must accept the responsibility of making decisions in the presence of all situations. They will have to deal with conflicting opinions and advice from their team, yet they must accept that they will be held accountable for the performance of their team. The surgeon–leader cannot take credit for successes while blaming failures on the team. Good teamwork and excellent communication do not relieve the leader of this responsibility.
Leadership Style
A surgeon often has a position of authority based on their titles or status in an organization that allows them to direct the actions of others. Leadership by this sort of mandate is termed “transactional leadership” and can be successful in accomplishing specific tasks. For example, a surgeon with transactional leadership skills can successfully lead a surgical team through an operation by requesting information and issuing directives. However, a leader will never win the hearts of the team in that manner. The team will not be committed and follow through unless they are empowered and feel they are truly heard. A transformational leader is one who inspires each team member to excel and to take action that supports the entire group. If the leader is successful in creating a genuine atmosphere of cooperation, less time will be spent giving orders and dealing with undercurrents of negativity. This atmosphere can be encouraged by taking the time to listen and understand the history behind its discussion. Blame should be avoided. This will allow the leader to understand the way an individual thinks and the group processes information to facilitate the introduction of change. While leadership style does not guarantee results, the leader’s style sets the stage for a great performance. At the same time, they should be genuine and transparent. This invites the team members to participate, creating an emotional connection. Leaders try to foster an environment where options are sought that meet everyone’s desires.
Conflict Management
Conflict is pervasive, even in healthy, well-run organizations and is not inherently bad. Whether conflict binds an organization together or divides it into factions depends on whether it is constructive or destructive. A good leader needs to know that there are four essential truths about conflict. It is inevitable, it involves costs and risks, the strategies we develop to deal with the conflict can be more damaging than the conflict itself, and conflict can be permanent if not addressed. The leader must recognize the type of conflict that exists and deal with the conflict appropriately. Constructive discussion and debate can result in better decision making by forcing the leader to consider other ideas and perspectives. This dialog is especially helpful when the leader respects the knowledge and opinions of team members with education, experience, and perspective different from the leader’s. Honesty, respect, transparency, communication, and flexibility are all elements that a leader can use to foster cohesion while promoting individual opinion. The leader can create an environment that allows creative thinking, mutual problem solving, and negotiation. These are the hallmarks of a productive conflict. Conflict is viewed as an opportunity, instead of something to be avoided.
Communication Skills
Communication is the primary tool of a successful leader. On important topics, it is incumbent on the leader to be articulate, clear, and compelling. Their influence, power, and credibility come from their ability to communicate. Research has identified the primary skills of an effective communicator. They are set out in the LARSQ model: Listening, Awareness of Emotions, Reframing, Summarizing, and Questions. These are not set in a particular order, but rather should move among each other freely. In a significant or critical conversation, it is important for a leader to listen on multiple levels. The message, body language, and tone of voice all convey meaning. You cannot interrupt or over-talk the other side. They need an opportunity to get their entire message out. Two techniques that enhance listening include pausing and the echo statement. Pausing before speaking allows the other conversant time to process what they have said to make sure the statement is complete and accurate. Echo statements reflect that you have heard what has been said and focuses on a particular aspect needing clarification. Good listening skills assure that the leader can get feedback that is necessary for success.
Vision, Strategy, Tactics, and Goals
One of the major tasks of a leader is to provide a compelling vision, an overarching idea. Vision gives people a sense of belonging. It provides them with a professional identity, attracts commitment, and produces an emotional investment. A leader implements vision by developing strategy that focuses on specific outcomes that move the organization in the direction of the vision. Strategy begins with sorting through the available choices and prioritizing resources. Through clarification, it is possible to set direction. Deficits will become apparent and a leader will want to find new solutions to compensate for those shortfalls. For example, the vision of a hospital is to become a world class health care delivery system. Strategies might include expanding facilities, improving patient satisfaction, giving the highest quality of care, shortening length of hospital stay with minimal readmissions, decreased mortality, and a reduction in the overall costs of health care. Tactics are specific behaviors that support the strategy with the aim to achieve success. Tactics for improving patient satisfaction may include reduced waiting time, spending more time with patients, taking time to communicate in a manner that the patient understands, responding faster to patient calls, etc. These tactics will then allow a leader to develop quantitative goals. Patient satisfaction can be measured. The surgical leader can then construct goals around each tactic, such as increasing satisfaction in specific areas. This information allows a surgical leader to identify barriers and they can take steps to remedy problem areas. This analysis helps a leader find the weakest links in their strategies as they continue toward achieving the vision.
Change Management
The world of health care is in continuous change. The intense rate of political, technical, and administrative change may outpace an individual’s and institution’s ability to adapt. Twenty-first century health care leaders face contradictory demands. They must navigate between competing forces. Leaders must traverse a track record of success with the ability to admit error. They also must maintain visionary ideas with pragmatic results. Individual accountability should be encouraged, while at the same time facilitating teamwork. Most leaders do not understand the change process. There are practical and psychological aspects to change. From an institutional perspective, we know that when 5% of the group begins to change, it affects the entire group. When 20% of a group embraces change, the change is unstoppable.
Succession Planning and Continuous Learning
An often-overlooked area of leadership is planning for human capital movement. As health care professionals retire, take leaves of absences, and move locations, turmoil can erupt in the vacuum. Leaders should regularly be engaging in activities to foster a seamless passing of institutional knowledge to the next generation. They also should seek to maintain continuity to the organization. Ways to accomplish this include senior leaders actively exposing younger colleagues to critical decisions, problem solving, increased authority, and change management. Leaders should identify promising future leaders, give early feedback for areas of improvement, and direct them toward available upward career tracks. Mentoring and coaching help prepare the younger colleagues for the challenges the institution is facing. Teaching success at all levels of leadership helps create sustainable high performance.
Gallstone Ileus
INTRODUCTION
Gallstone ileus is a misnomer: this condition is not a physiologic ileus at all, but a mechanical obstruction of the intestinal lumen (most commonly the small bowel) by a large gallstone that has passed through a cholecystoenteric fistula. Cholecystoenteric fistulae may occur from the gallbladder to the adjacent luminal viscera-duodenum (most common), stomach, or colon. Gallstone obstruction of the stomach at the pylorus is known as Bouveret’s syndrome. Cholecystocolic fistula is less common. Colonic obstruction in this situation typically occurs at the sigmoid colon. Most common is cholecystoduodenal fistula, with a large (usually >2 cm) gallstone passing through the small bowel and becoming lodged in the terminal ileum. Cholecystoenteric fistula is felt to be caused by a combination of pressure, necrosis, and inflammation with chronic longstanding gallstone disease. Up to 25% of patients who develop gallstone ileus will harbor multiple stones in the alimentary tract; therefore, a close inspection of the entire intestine is important at the time of operation.
CLINICAL PRESENTATION
Over the past few years, however, the incidence of gallstone ileus has been shown to be greater than previously thought. Several recent large population-based series have found that gallstone ileus accounts for approximately 0.1% of all small bowel obstructions. The disease usually affects women (70%) and those in the seventh or eighth decade of life. Most patients present with bloating, crampy abdominal pain, and vomiting, symptoms typical of mechanical small bowel obstruction. A careful history may reveal earlier episodic colicky right upper quadrant abdominal pain consistent with gallstone disease. The classic finding on plain abdominal radiograph is that of Rigler’s triad (pneumobilia, dilated small bowel loops with air-fluid levels, and a large, calcified gallstone in the lumen of the small bowel). Currently, computed tomography (CT) is used ubiquitously. CT has 99% accuracy for diagnosing gallstone ileus. Typical CT findings include pneumobilia, dilated loops of small bowel with air-fluid levels consistent with small bowel obstruction, and transition point with the ectopic stone always visible radiologically.
MANAGEMENT
Operation is required for all patients with gallstone ileus, as spontaneous passage of these large stones is rare once the patient has become symptomatic. It is crucial to optimize the patient physiologically as much as possible in this semi urgent situation, with the understanding that most gallstone ileus patients are elderly and commonly have numerous medical comorbidities. Two contemporary series of registry data have expanded our understanding of gallstone ileus. This condition was once thought to be relatively rare; however, the National Inpatient Sample study identified 3268 gallstone ileus patients, which accounts for approximately 0.1% of all patients admitted to the hospital with mechanical small bowel obstruction during this time period. In this series, overall hospital mortality was substantial at 6.7%. Mortality was significantly higher in patients who underwent cholecystectomy and closure of the biliary fistula compared to those who simply had small bowel obstruction addressed by cholecystolithotomy. Overall, 77% of the 3268 patients had small bowel obstruction pathology treated and the remaining 23% had biliary fistula closed and cholecystectomy at the same operation. An interesting finding was the substantial incidence of postoperative renal insufficiency, or approximately 30% in the entire group of patients. The latter finding highlights the need for preoperative resuscitation and close attention to postoperative fluid management. The surgeon must consider carefully feasibility of same operation intervention to repair biliary pathology: It is safe to defer biliary operation to a later date with a second staged operation. When this strategy of two stage operation is selected, surgeons should consider and counsel their patient regarding the substantial incidence of recurrent biliary symptoms.
Tratamento Cirúrgico da ACALASIA ESOFÁGICA
A acalasia, definida como a falha ou relaxamento incompleto do esfíncter esofágico inferior (EEI), acompanhada de aperistalse do corpo esofágico na ausência de obstrução mecânica, é o tipo mais comum de distúrbio da motilidade esofágica. Tem uma incidência de 1 em 100.000 pessoas, com uma prevalência de 10 em 100.000. Não há diferença na prevalência de gênero entre as idades de 30 e 60 anos. A causa primária da acalasia ainda é indeterminada, mas acredita-se que surja da degeneração das células ganglionares inibitórias no plexo miontérico do EEI e corpo esofágico. Fatores associados a um risco aumentado de acalasia incluem distúrbios virais/neurodegenerativos, síndrome de Down, diabetes mellitus tipo 1, hipotireoidismo e condições autoimunes, como a síndrome de Sjögren, o lúpus eritematoso sistêmico e a uveíte. Os casos familiares são raros.
O diagnóstico de acalasia deve ser suspeitado em pacientes com disfagia para sólidos e líquidos que não melhora com o uso de inibidores da bomba de prótons. Se não for tratada, a acalasia é uma doença progressiva que pode evoluir para megaesôfago e está associada a um aumento do risco de carcinoma de células escamosas do esôfago. Embora não existam critérios padronizados para determinar a gravidade da doença, o diâmetro e a confirmação do esôfago dentro da cavidade torácica são geralmente considerados os dois principais fatores. A escala de Eckardt é uma escala frequentemente usada para avaliar a gravidade da doença e a eficácia da terapia. Qualitativamente, a acalasia grave é definida como um diâmetro esofágico maior que 6 cm; a acalasia em estágio avançado inclui a angulação distal, um esôfago sigmóide/tortuoso com diâmetro maior que 6 cm ou um megaesôfago com diâmetro maior que 10 cm. Aproximadamente 5% a 15% das pessoas com acalasia evoluem para acalasia em estágio avançado, são geralmente resistentes aos tratamentos endoscópicos e cirúrgicos iniciais e, em última instância, requerem uma esofagectomia.
MIOTOMIA Á HELLER
A miotomia laparoscópica de Heller (LHM) com fundoplicatura parcial, desenvolvida como uma alternativa minimamente invasiva à miotomia anterior aberta tradicional e posteriormente à miotomia toracoscópica, tem sido o padrão ouro para o tratamento da acalasia nas últimas três décadas. O objetivo da miotomia é abrir completamente o EEI e aliviar a disfagia. A LHM proporciona alívio sintomático inicial da disfagia em cerca de 90% dos pacientes com tipos I e II de acalasia e em 50% dos pacientes com tipo III de acalasia, enquanto diminui as taxas de refluxo pós-operatório. Em comparação com os procedimentos de miotomia aberta, a LHM está associada a menor dor pós-operatória, menor tempo de internação hospitalar e retorno mais precoce à função. A LHM é indicada como tratamento de primeira linha para todos os candidatos à cirurgia com acalasia que estejam dispostos a se submeter à cirurgia ou para aqueles que falharam na dilatação endoscópica. A operação consiste em dividir os músculos do EEI, seguida por uma fundoplicatura para diminuir o refluxo pós-operatório. A fundoplicatura parcial é favorecida em relação à fundoplicatura total porque reduz a falha do tratamento. As duas principais complicações da cirurgia são perfuração da mucosa e DRGE.
Surgical Management of Chronic Pancreatitis
Chronic pancreatitis is a progressive, destructive inflammatory process that ends in destruction of the pancreatic parenchyma resulting in malabsorption, diabetes mellitus, and severe pain. The etiology of chronic pancreatitis is multifactorial. About 65–70% of patients have a history of alcohol abuse, the remaining patients are classified as idiopathic chronic pancreatitis (20–25%), including tropical pancreatitis, a major cause of childhood chronic pancreatitis in tropical regions, or unusual causes including hereditary pancreatitis, cystic fibrosis, and chronic pancreatitis-associated metabolic and congenital factors. Current evidence suggests that a combination of predisposing factors, including environmental, toxic, and genetic, are involved in most patients rather than one single factor. The best-known hypotheses about the pathogenesis of chronic pancreatitis include necrosis-fibrosis, toxic-metabolic, oxidative stress, plug and stone formation with duct obstruction, and primary duct obstruction. Repeated episodes of inflammation initiated by autodigestion, one or more episodes of severe pancreatitis, oxidative stress, and/or toxic-metabolic factors lead to activation and continued stimulation of parenchymal pancreatic stellate cells. These stellate cells cause the fibrosis characteristic of chronic pancreatitis. Nevertheless, multiple hypotheses exist to explain the pathophysiology in the various subgroups of patients with chronic pancreatitis, but to date there is no single unifying theory.
OPERATIVE TREATMENT
There are several different concepts for the operative treatment of chronic pancreatitis. The concept of preservation of functioning pancreatic parenchyma (drainage operations) would be the goal for protection against further loss of pancreatic function. The second main concept is based on resective procedures either in the situation where there is no dilation of the pancreatic duct, if the pancreatic head is enlarged, or if a pancreatic carcinoma is suspected in the setting of chronic pancreatitis. These two concepts involve different operative procedures.
Drainage procedures
Sphincterotomy of the pancreatic duct was one of the first operative procedures proposed for patients with a dilated pancreatic duct in chronic pancreatitis with presumed obstruction or stenosis at the papilla Vater. Unfortunately, this procedure was associated with minimal lasting success for the amelioration of pain, indicating that a stenosis at the papilla of Vater is not the cause of pain in chronic pancreatitis nor the cause of ductal dilation. In contrast, direct ductal-enteric drainage by the original Puestow procedure or its modification by Partington and Rochelle is more successful in patients with chronic pancreatitis and a dilated pancreatic duct. The original Puestow procedure included resection of the tail of the pancreas with filleting open the pancreatic duct proximally along the body of the pancreas with anastomosis to a Roux-en-Y loop of jejunum. Partington and Rochelle modified the Puestow procedure by eliminating the resection of the pancreatic tail. A recent procedure involves a wedge-shaped opening of the pancreatic duct (even when the duct is <5 mm) with a subsequent pancreatico-jejunostomy. The preservation of functional tissue and reduction of operative mortality to less than 1% and morbidity to less than 10% are the goals and benefits of this operation. Unfortunately, large series have reported persistence or recurrence of pain at long-term follow up (>5 year) in 30–50% of patients; in addition, patients with a dominant mass in the head of the pancreas and a non-dilated pancreatic duct do not appear to profit from a drainage procedure at all. A recent randomized controlled trial demonstrated that operative drainage in selected patients with a large duct was more effective than endoscopic treatment in patients with obstruction of the pancreatic duct.
Pancreatic Resections
Pancreatoduodenectomy (Kausch-Whipple procedure). For many surgeons, a pancreatoduodenectomy is the gold standard for patients with the pain of chronic pancreatitis, although the newer, duodenum-preserving procedures are good (and possibly better) alternatives as well (see below). The approach of resection of the proximal gland is based on Longmire’s tenet that the ‘‘pacemaker’’ of pain is in the head of the pancreas. The indications for pancreatoduodenectomy in patients with chronic pancreatitis and pain are:
(1) a non-dilated pancreatic duct (diameter < 6 mm measured in the body of the gland),
(2) an enlarged head of the pancreas, often containing cysts and calcifications,
(3) a previous, ineffective ductal drainage procedure, and/or
(4) when there is the possibility of malignancy in the head of the gland.
This latter subgroup comprises up to 6–10% of patients undergoing operative intervention for chronic pancreatitis. After pancreatoduodenectomy, > 80% of patients have permanent pain relief, which is greater than after a drainage operation. In experienced centers, a pancreatoduodenectomy can be performed with a low operative mortality rate (< 2%), and a morbidity of 40%. Although the classic pancreatoduodenectomy has these advantages, there is some long-term morbidity in chronic pancreatitis patients, especially regarding quality of life. In addition to development of diabetes, patients experience postoperative digestive dysfunction, including dumping, diarrhea, peptic ulcer, and dyspeptic complaints. To address these effects of the classic pancreatoduodenectomy which involved a distal gastrectomy, ‘‘organ-preserving’’ operations like the pylorus-preserving pancreatoduodenectomy. Symptoms of dumping and bile-reflux gastritis can be decreased by preserving the stomach, the pylorus, and the first part of the duodenum. In addition, regarding quality of life, a pylorus-preserving technique provides better results than the classic pancreatoduodenectomy procedure; weight gain occurs in 90% of the patients postoperatively while still leading to long-lasting pain relief in 85–90% of the patients. Pylorus-preserving resections, however, appear to have a greater incidence of transient delayed gastric emptying postoperatively (20–30% of the patients) as well as the risk of cholangitis and the long-term occurrence of exocrine and endocrine pancreatic insufficiency (seen in >45% of patients), representing the possible drawbacks of this operation in chronic pancreatitis patients. The relevant studies (level I and II) comparing classic with pylorus preserving pancreatoduodenectomy could not demonstrate a clear advantage for either resection. One should remember, however, that pancreatoduodenectomy was originally introduced to treat malignant pancreatic or periampullary disease by an oncologic resection. Therefore, for a benign disorder such as chronic pancreatitis, there is no reason – other than the occasional inability to exclude pancreatic cancer definitely – to remove peripancreatic organs (the distal stomach, the duodenum, and the extrahepatic bile ducts), which are involved only secondarily in chronic pancreatitis. This concept stimulated the development of organ-preserving pancreatic resections.
Duodenum-preserving pancreatic head resection (DPPHR).
This procedure addresses patients with a dominant mass in the head of the pancreas with or without a dilated main pancreatic duct. The duodenum-preserving resection (Beger procedure) includes a ventral dissection and dorsal mobilization of the head of the pancreas. After division of the pancreas anterior to the porto-mesenteric vein (as with a pancreatoduodenectomy), the resection is carried out toward the papilla of Vater. A subtotal resection of the pancreatic head is carried out leaving a small margin of pancreatic tissue associated with the duodenum containing the common bile duct; a small rim of pancreatic tissue toward the vena cava should be preserved as well during removal of most all of the uncinate process. In most patients, it is possible to free the bile duct from the surrounding scarring without disrupting continuity with the ampulla of Vater, thereby avoiding the need for a bilio-digestive anastomosis.
In some patients (20%), the common bile duct is obstructed and should be opened, so that the bile will drain into the cavity of the resected pancreatic head which is drained into a Roux-en-Y limb of jejunum. The standard reconstruction consists of a Roux-en- pancreaticojejunostomy to the distal pancreatic remnant (body and tail of pancreas) and a pancreatojejunostomy to the rim of pancreas at the duodenum (including the opened bile duct if needed). In up to 10% of patients, this DPPHR procedure is combined with a lateral pancreaticojejunostomy to drain multiple stenoses of the main pancreatic duct. The mortality rate is low (1%), and the morbidity rate is around 15%, less than after pancreatoduodenectomy.
When compared with pancreatoduodenectomy in patients with chronic pancreatitis, the DPPHR offers the advantage of preserving the duodenum and extrahepatic biliary tree, and its superiority over even the pylorus-preserving resection has been shown in prospective studies. Patients who underwent the DPPHR had greater weight gain, a better glucose tolerance, and a higher capacity for insulin secretion. In long-term follow-up, about 20% of the patients developed new onset of diabetes mellitus, like the incidence of diabetes after pancreatoduodenectomy. There is some evidence that endocrine function may be better preserved after DPPHR when compared with patients with chronic pancreatitis not undergoing operation, secondary to the relief of pancreatic ductal obstruction/hypertension. Regarding pain status, 90% of patients after DPPHR have long-term relief of pain. Regarding quality of life, 69% of the patients in one study were rehabilitated professionally, 26% retired, and only 5% of the patients were unimproved. Considering the better pain status, a lesser frequency of acute episodes of chronic pancreatitis, especially in those patients with an enlarged pancreatic head, marked decrease in the need for further hospitalization, low early and late mortality rate, and the restoration of a better quality of life, evidence suggests that DPPHR may delay the natural course of the disease of chronic pancreatitis.
The DPPHR was modified by Frey and colleagues to include a longitudinal pancreatico-jejunostomy combined with a local ‘‘coring out’’ of the pancreatic head without the need for an extensive dissection near the superior mesenteric vessels as with the DPPHR. The Frey and DPPHR have undergone evaluation in multiple comparative trials, confirming their effectiveness as operative procedures for chronic pancreatitis. A modified technique (Bern procedure) of the Beger and Frey procedures has been described recently in patients with chronic pancreatitis. This extended Frey procedure combines the advantages of the Beger and Frey procedure by maintaining a non-anatomic, subtotal central pancreatic head resection but without the need for transsection of the gland over the superior mesenteric vein (SMV), the most tedious part of the DPPHR procedure which was the major advantage offered by the Frey procedure. This modified technique reduces the risk of intraoperative bleeding which is especially increased in the presence of portal hypertension.
Left-sided pancreatic resection (distal pancreatectomy)
Most surgeons believe that the pancreatic head is the pacemaker in chronic pancreatitis, and therefore, pancreatic head resections should be the target for most patients with chronic pancreatitis affecting the entire gland. There is, however, a small and carefully selected group of patients in whom a left-sided pancreatic resection is the appropriate treatment. This subgroup is selected by imaging techniques, including CT, ERCP, or MRI outlining inflammatory complications, such as pseudocysts, fistula, and pancreatic duct stenosis, involving only (or primarily) the body and/or tail region of the pancreas. A good example is the patient who develops a mid-ductal stricture after an episode of necrotizing pancreatitis secondary to gallstone pancreatitis. Similarly, suspicion of a neoplasm or recurrent acute pancreatitis believed secondary to an isolated, mid-ductal stricture may be justification for a left-sided pancreatic resection. Overall, about 10% of all patients who undergo operative intervention for chronic pancreatitis may be candidates for a distal pancreatectomy. These distal pancreatectomies for benign disease can be performed without splenectomy, but conservation of the splenic artery and vein can be difficult and is time-consuming. Nevertheless, the advantage of avoiding the possibility of overwhelming postsplenectomy sepsis should be taken into consideration as well as the importance of the spleen for maintenance of the host defense system. Thus, preservation of the spleen is desirable if there is no clear indication for splenectomy, such as perisplenic pseudocyst or inflammatory/fibrotic encasement of the splenic vessels.
Central pancreatectomy (middle segmentectomy).
Benign lesions of the neck and proximal body of the pancreas, such as the exceedingly rare focal chronic pancreatitis or post-traumatic pancreatitis, pose an interesting operative challenge. If the lesions are not amenable to simple enucleation, surgeons may be faced with the choice of performing a right-sided resection (pancreatoduodenectomy) or a left-sided resection (distal pancreatectomy) to include the lesion, resulting in resection of a substantial amount of otherwise functioning pancreatic parenchyma. Central pancreatic resections have been reported primarily for benign or low-grade neoplasms with Roux-en-Y pancreatojejunostomy reconstruction. Central pancreatectomy affords the possibility of saving functional pancreatic tissue in attempt to avoid the complications of pancreatic insufficiency. Further studies, however, must prove the effectiveness of such an operation for patients with chronic pancreatitis. Central resections in patients with chronic pancreatitis must be viewed with caution and considered only in highly selected cases.
Pancreatic resection with islet cell autotransplantation.
Because of the concerns of pancreatic endocrine insufficiency after any pancreatic resection for chronic pancreatitis, renewed interest has focused on the possibility of performing a total pancreatectomy, isolating the islets, and reinfusing (autotransplanting) the islets into the liver. Improvements in islet cell harvesting and preservation for islet cell allotransplantation for diabetics have allowed new enthusiasm in this technique for patients with chronic pancreatitis. Results to date are encouraging, but the inability to harvest reliably an adequate number of islets and to prove successful engraftment within the liver remain current limitations. This approach may be more effective early in the disease when islets have not been depleted.
OUTCOMES
In summary, definite evidence for the best operative method for treating painful chronic pancreatitis is still not fully accepted. The study designs in the few randomized controlled trials (evidencebased Level I data) available today have some limitations in design and reporting of morbidity and include only small numbers of patients. Nevertheless, the different variations of the DPPHR, Beger, Frey, and Bern procedures appear to be as equally successful in achieving long-term pain control as pancreatoduodenectomy, but they have fewer postoperative complications and appear to be superior with regard to preservation of pancreatic function and quality of life.
“Ao CADÁVER DESCONHECIDO, todo nosso respeito e agradecimento!”
O estudo da anatomia humana é essencial para o ensino e avanço da medicina, e o cadáver desempenha um papel fundamental nesse processo. O cadáver é uma ferramenta valiosa que permite aos estudantes de medicina, anatomia e outras áreas da saúde aprenderem sobre a estrutura e a organização do corpo humano de uma maneira muito mais eficaz do que seria possível apenas com modelos em duas dimensões ou imagens de realidade virtual.
A dissecação de um cadáver permite que os estudantes examinem as diferentes camadas de tecido e órgãos que compõem o corpo humano, geralmente ensinadas na disciplina de ANATOMIA TOPOGRÁFICA. Isso pode ajudá-los a entender como as estruturas funcionam juntas para manter a homeostase. Ao dissecar um cadáver, os estudantes podem observar as relações anatômicas entre as estruturas, entender as diferenças entre os diferentes sistemas do corpo humano e identificar as variações individuais que ocorrem em cada pessoa. Essas informações são fundamentais para o diagnóstico e o tratamento de doenças e distúrbios.
Além disso, o estudo do cadáver permite que os estudantes observem as variações normais que ocorrem no corpo humano, bem como as anomalias e patologias que podem afetar diferentes sistemas e órgãos. Isso pode ajudar os estudantes a entender as causas e os efeitos de doenças e distúrbios e a desenvolver habilidades práticas para o diagnóstico e o tratamento. Por exemplo, ao estudar um cadáver com uma patologia específica, os estudantes podem aprender a identificar essa condição em pacientes vivos e determinar o melhor tratamento para cada caso.
Além de fornecer informações valiosas sobre a estrutura do corpo humano, o estudo do cadáver também é importante para a investigação científica e o desenvolvimento de novas técnicas e tecnologias médicas. Por exemplo, ao estudar a anatomia do sistema nervoso central de um cadáver, os pesquisadores podem identificar áreas do cérebro que controlam funções específicas, como a fala ou a visão. Isso pode levar ao desenvolvimento de novas técnicas cirúrgicas que preservam essas funções durante procedimentos no cérebro.
O estudo do cadáver também é fundamental para o treinamento de cirurgiões. Através da dissecação de cadáveres, os cirurgiões podem praticar técnicas cirúrgicas complexas e aprimorar suas habilidades antes de realizar procedimentos em pacientes vivos. Isso pode ajudar a reduzir o risco de complicações durante as cirurgias e melhorar os resultados para os pacientes. A anatomia é a disciplina fundamental da formação cirúrgica desde tempos remotos na história da medicina.
No entanto, o uso de cadáveres para o estudo da anatomia humana é uma questão ética e legal complexa. Para garantir que o uso de cadáveres seja feito de forma ética e responsável, muitos países têm leis e regulamentações rigorosas que governam a dissecação de corpos humanos. Essas leis e regulamentações visam garantir que os cadáveres sejam tratados com respeito e dignidade, que o consentimento adequado seja obtido antes da dissecação e que a privacidade e a confidencialidade dos doadores sejam protegidas.
Visão Crítica de Segurança (Colecistectomia)
A colecistectomia laparoscópica (CL) é o padrão-ouro para tratamento de cálculos biliares. No entanto, o risco de lesão do ducto biliar (BDI) continua a ser preocupação significativa, uma vez que CL ainda tem taxa de BDI maior do que a via laparotômica, apesar de muitos esforços propostos para aumentar sua segurança.

A Visão Crítica da Segurança (CVS) proposta por Strasberg é a técnica para a identificação dos elementos críticos do triângulo de Calot durante a CL. Esta técnica foi adotada em vários programas de ensino e com a proposta de reduzir o risco de BDI e o uso da adequado da CVS está associado a menores taxas de BDI. O objetivo deste #Webinar é abordar a Anatomia Cirúrgica Fundamental para a realização de uma Colecistectomia Laparoscópica.
Intraoperative cholangiography: Selective or Routine?
Intraoperative cholangiography (IOC), described by Mirizzi in 1932, represented a significant advance in the diagnosis of choledocolithiasis during cholecystectomy. The natural history of asymptomatic choledocolithiasis has been investigated in different populations and its therapeutic management continues to be controversial. IOC is traditionally advocated as a procedure to be adopted in all laparoscopic cholecystectomies since it permits to define the anatomy of the biliary tract and to detect common bile duct stones. However, in the laparoscopic era, technological advances in radiologic-endoscopic workup have markedly increased the costs of investigation of patients with suspected choledocolithiasis. The routine use of IOC has raised the question of which cases require the exploration of bile tract anatomy during surgery and whether there are methods to predict preoperatively unsuspected choledocolithiasis. Therefore, the most appropriate management of preoperatively unsuspected choledocolithiasis, i.e., the routine or selective use of IOC, still remains undefined. In this respect, well-defined criteria for the inclusion of patients with possible choledocolithiasis who should be submitted to cholangiography exist in the literature, but there is no safe approach to exclude asymptomatic patients without an indication for contrast examination.
A systematic literature search was performed by KOVACS N, et al (2022) using the following search keys: cholangiogra* and cholecystectomy. The primary outcomes were BDI and retained stone rate. To investigate the differences between the groups (routine IOC vs selective IOC and IOC vs no IOC), they calculated weighted mean differences (WMD) for continuous outcomes and relative risks (RR) for dichotomous outcomes, with 95% confidence intervals (CI). Of the 19,863 articles, 38 were selected and 32 were included in the quantitative synthesis. Routine IOC showed no superiority compared to selective IOC in decreasing BDI (RR = 0.91, 95% CI 0.66; 1.24). Comparing IOC and no IOC, no statistically significant differences were found in the case of BDI, retained stone rate, readmission rate, and length of hospital stay. They found an increased risk of conversion rate to open surgery in the no IOC group (RR = 0.64, CI 0.51; 0.78). The operation time was significantly longer in the IOC group compared to the no IOC group (WMD = 11.25 min, 95% CI 6.57; 15.93). So this data findings suggest that IOC may not be indicated in every case, however, the evidence is very uncertain.
Postpancreatectomy Hemorrhage
Postoperative complications represent one of the most debated topics in pancreatic surgery. Indeed, the rate of complications following pancreatectomy is among the highest in abdominal surgery, with morbidity ranging between 30 and 60%. They are often characterized by elevated clinical burden, with a consequent challenging postoperative management. Mortality rates can exceed 5%. The impact on patient recovery and hospital stay eventually leads to massive utilization of resources and increases costs for the health system. The International Study Group of Pancreatic Surgery (ISGPS) provides standardized definitions and clinically based classifications for the most common complications after pancreatectomy, including postoperative pancreatic fistula (POPF), post pancreatectomy hemorrhage (PPH), delayed gastric emptying (DGE), bile leakage, and chyle leak.
Post Pancreatectomy Hemorrhage
Despite its lower incidence compared with POPF with reported rates of 3–10% after pancreatectomy, PPH remains one of the major of postoperative complications, with mortality rates ranging from 30 to 50%. According to current ISGPS recommendations, PPH is classified in three grades (A, B, and C) based on two main criteria: timing of the hemorrhage and severity of the bleeding. The timing is dichotomized as early, occurring within 24 hours from the index surgery, and late, when it happens afterwards.
Management is tailored according to the clinical picture, the timing of onset, and the presumptive location. Early hemorrhage is generally due to either unsuccessful intraoperative hemostasis or to an underlying coagulopathy. The vast majority of patients are basically asymptomatic, with PPH having no influence on the postoperative course. However, when the bleeding is severe, re-laparotomy is recommended, with the aim of finding and controlling the source of bleeding. This approach usually guarantees an uneventful subsequent course. Late PPH is often challenging and the pathogenesis is diverse. Vascular erosion secondary to POPF or intraabdominal abscess, late failure of intraoperative hemostatic devices, arterial pseudoaneurysm, and intraluminal ulceration are some of the most common causes. In this setting, surgical access to the source of bleeding may be challenging. Angiography (if extraluminal) and endoscopy (if intraluminal) represent the primary approaches to treatment. Surgery is reserved for hemodynamically unstable patients and for those who present with deteriorating condition, multiorgan failure or sepsis. Given these assumptions, except for early mild events, contrast-enhanced abdominal CT is crucial in all cases of PPH, possibly allowing identification of the source and planning the management accordingly. Also, it should be noted that late massive hemorrhages may be preceded by mild self-limiting sentinel bleeds. A prompt abdominal CT scan aimed at excluding vascular lesions is therefore strongly recommended in these cases.
The incidence of complications following pancreatic resection remains high. The ISGPS established standardized definitions and clinical grading systems for POPF, PPH, DGE, and biliary and chyle leak. These classification systems have enabled unbiased comparisons of intraoperative techniques and management decisions. However, the management policies of these complications are most often driven by a patient’s condition and local surgical expertise and is not always based on the available high-level evidence. The development of high-volume specialized units with appropriate resources and multidisciplinary experience in complication management might further improve the evidence and the outcomes.
Subtotal cholecystectomy for difficult acute cholecystitis
Laparoscopic cholecystectomy is considered the gold standard for treatment of benign gallbladder diseases. Cholecystectomy using this method can be completed in 90% of elective cholecystectomies and 70% of emergency cholecystectomies. Acute cholecystitis, especially if difficult, can change the above paradigm, resulting in open conversion or change of technique. The conditions that define a difficult cholecystectomy are as follows: necessity of conversion from laparoscopic to open surgery; duration of procedure greater than 180 min; blood loss greater than 300 ml; and urgent need for involvement of a more experienced surgeon. One of the “rescue” procedures to complete the surgery safely (both for the surgeons and patients) is subtotal cholecystectomy (STC). Open and laparoscopic subtotal cholecystectomy have been reported. For many surgeons, this is considered a bail out technique, and the timing of decision making is crucial to avoid catastrophic complications. Te capability to perform STC in laparoscopy is increasingly requested during difficult laparoscopic cholecystectomy. Difficult LC has a risk of BDI from 3 to 5 times higher in laparoscopy than open surgery. In case of operative difficulties of young surgeons mostly trained in laparoscopy the help of senior surgeons is strongly recommended. The purpose of the present study is to clarify how laparoscopic subtotal cholecystectomy may be used to complete a difficult cholecystectomy for acute cholecystitis without serious complications.

Biliary leakage represents the most frequent complication of incomplete resection of the gallbladder wall in cases of difficult acute cholecystectomy treated with subtotal cholecystectomy. This complication is rarely fatal but requires correct treatment. If bile leakage does not stop spontaneously seven days postoperatively, the possible treatments are endoscopic biliary sphincterotomy, endoscopic plastic stent, and a fully covered self-expanding metal stent. When performing closure of the gallbladder stump, suturing the anterior residual of both anterior and posterior wall represents the best method to have fewer complications. Complications, if not lethal, decrease the patient’s quality of life. Intraoperatively, it is of utmost importance to carefully expose the gallbladder stump to avoid left-in-place stones, wash the entire cavity and drain the abdomen. Bile duct injuries can be a significant complication in this type of surgery. Prevention of the lesions with conversion from laparoscopic to open, or the opinion of older surgeon in case of difficulties is strongly recommended. Mortality is a very rare complication. The limitations of our study are given by the heterogeneity of the techniques used for LSC and the lack of a long-term follow-up analyzing the related complications.
Obstrução Intestinal por ADERÊNCIAS pós-operatórias
A obstrução intestinal ocorre quando a propulsão do conteúdo entérico em direção ao ânus sofre interferência. Há vários critérios para classificá-la: quanto ao nível (delgado alto e baixo ou cólon), quanto ao grau (completa, incompleta – suboclusão ou “alça fechada”), quanto ao estado de circulação sangüínea (simples ou estrangulada), quanto ao tipo de evolução (aguda ou crônica) e quanto à natureza da obstrução (mecânica, vascular ou funcional). Ao que se a figura, em torno de 20% das cirurgias por quadros de abdome agudo são de pacientes com obstrução intestinal. Atualmente, as aderências pós-operatórias são a principal causa em todas os grupos etários. Hérnia inguinal estrangulada, outrora causa mais comum, figura em segundo lugar, seguida de neoplasia intestinal. Esses três agentes etiológicos respondem por mais de 80% de todas as obstruções.
QUADRO CLÍNICO
Os sintomas cardinais são: dor, náuseas e vômitos, parada da eliminação de gases e fezes com distensão abdominal, sendo que esta manifestação ocorre mais tarde. A dor é tipicamente em cólica, de início brusco, em salva, ocorrendo a intervalos regulares, de localização epigástrica, periumbilical ou hipogástrica, dependendo do nível da obstrução. Se a dor se tornar contínua, localizada ou difusa nos intervalos entre as cólicas, é grande a suspeita de comprometimento vascular, ou seja, isquemia intestinal. Nas obstruções mecânicas altas os vômitos são freqüentes, surgem precocemente e são constituídos de material estagnado e de aspecto bilioso; nas obstruções de cólon as náuseas e vômitos podem inexistir. Na obstrução mecânica os sintomas de obstipação são tardios. A parada total da eliminação de gases e fezes é o apanágio da obstrução completa. Na suboclusão, o paciente pode continuar eliminando gases. A distensão abdominal pode surgir algumas horas depois de iniciados os sintomas, em função do nível de obstrução, sendo ausente ou discreta nas oclusões altas do intestino delgado, intensa e precoce nas baixas e mais tardias nas obstruções do cólon.
EXAME FÍSICO
O exame físico nas primeiras 24 horas pode revelar pouquíssimos achados anormais, a não ser durante os períodos de cólica, os sinais vitais mantêm-se normais, e a desidratação e distensão ainda não são pronunciadas. Há defesa de parede durante a palpação, e a descoberta de massa ou área restrita de dor é sugestiva de estrangulamento. A ausculta é de grande valor, pois o abdome é silencioso, exceto nos ataques de cólica, nos quais os ruídos são altos, agudos e metálicos. Em torno do segundo ou terceiro dia a doença agrava-se visivelmente, quando a desidratação e a distensão estão acentuadas e os sinais vitais se alteram, apesar da obstrução simples só acarretar choque tardiamente.
PROPEDÊUTICA
Podem ser feitos exames complementares não só para o diagnóstico, como também para terapêutica. Exemplo disto é o tratamento do volvo de sigmóide com o auxílio da retossigmoidoscopia ou colonoscopia pela passagem, sob visão direta, de sonda além da zona de torção. A radiografia do abdome e a Tomografia Computadorizada é fundamental para confirmação diagnóstica, melhor compreensão dos dados clínicos e também pode ajudar a elucidar etiologias. Os exames laboratoriais, permitem avaliar o grau e tipo de desequilíbrio metabólico, o que será fundamental para a terapêutica, definindo se há ou não sofrimento vascular.
TRATAMENTO
Os princípios da terapêutica são a reposição de líquidos e eletrólitos, a descompressão do intestino e a intervenção cirúrgica no momento adequado. Absolutamente todos os pacientes com obstrução intestinal COMPLETA, devem ser operados. Há 5 categorias de manobras cirúrgicas: extraluminares, enterotomia para retirada de corpos estranhos da luz, ressecção intestinal, operações de desvio de trânsito e operações de descompressão. Pelo fato de ser intervenção cirúrgica de urgência, as complicações pós-operatórias são mais freqüentes. As mais observadas são: infecção de parede, íleo prolongado, sepse, complicações pulmonares e infecção urinária.
#Bolsonaro #ObstruçãoIntestinal #Aderências
The “BAD” Gallbladder
Once the decision for surgery has been made, an operative plan needs to be discussed and implemented. Should one initially start with laparoscopic surgery for the “bad gallbladder”? If a laparoscopic approach is taken, when should bail-out maneuvers be attempted? Is converting to open operation still the standard next step? A 2016 study published by Ashfaq and colleagues sheds some light on our first question. They studied 2212 patients who underwent laparoscopic cholecystectomy, of which 351 were considered “difficult gallbladders.” A difficult gallbladder was considered one that was necrotic or gangrenous, involved Mirizzi syndrome, had extensive adhesions, was converted to open, lasted more than 120 minutes, had a prior tube cholecystostomy, or had known gallbladder perforation. Seventy of these 351 operations were converted to open. The indications for conversion included severe inflammation and adhesions around the gallbladder rendering dissection of triangle of Calot difficult (n 5 37 [11.1%]), altered anatomy (n 5 14 [4.2%]), and intraoperative bleeding that was difficult to control laparoscopically (n 5 6 [1.8%]). The remaining 13 patients (18.5%) included a combination of cholecystoenteric fistula, concern for malignancy, common bile duct exploration for stones, and inadvertent enterotomy requiring small bowel repair. Comparing the total laparoscopic cholecystectomy group and the conversion groups, operative time and length of hospital stay were significantly different; 147 +- 47 minutes versus 185 +- 71 minutes (P<.005) and 3+-2 days versus 5+-3 days (P 5 .011), respectively. There was no significant difference in postoperative hemorrhage, subhepatic collection, cystic duct leak, wound infection, reoperation, and 30-day mortality.2 From these findings, we can glean that most cholecystectomies should be started laparoscopically, because it is safe to do so. It is the authors’ practice to start laparoscopically in all cases.
BAILOUT PROCEDURES
Despite the best efforts of experienced surgeons, it is sometimes impossible to safely obtain the critical view of safety in a bad gallbladder with dense inflammation and even scarring in the hepatocystic triangle. Continued attempts to dissect in this hazardous region can lead to devastating injury, including transection of 1 or both hepatic ducts, the common bile duct, and/or a major vascular injury (usually the right hepatic artery). Therefore, it is imperative that any surgeon faced with a bad gallbladder have a toolkit of procedures to safely terminate the operation while obtaining maximum symptom and source control, rather than continue to plunge blindly into treacherous terrain. If the critical view of safety cannot be achieved owing to inflammation, and when further dissection in the hepatocystic triangle is dangerous, these authors default to laparoscopic subtotal cholecystectomy as our bail-out procedure of choice. The rationale for this approach is that it resolves symptoms by removing the majority of the gallbladder, leading to low (although not zero) rates of recurrent symptoms. It is safe, and can be easily completed laparoscopically, thus avoiding the longer hospital stay and morbidity of an open operation. There is now significant data supporting this approach. In a series of 168 patients (of whom 153 were laparoscopic) who underwent subtotal cholecystectomy for bad gallbladders, the mean operative time was 150 minutes (range, 70–315 minutes) and the average blood loss was 170 mL (range, 50–1500 mL). The median length of stay for these patients was 4 days (range, 1–68 days), and there were no common bile duct injuries.23 There were 12 postoperative collections (7.1%), 4 wound infections (2.4%), 1 bile leak (0.6%), and 7 retained stones (4.2%), but the 30-day mortality was similar to those who underwent a total laparoscopic cholecystectomy. A systematic review and meta-analysis by Elshaer and colleagues showed that subtotal cholecystectomy achieves comparable morbidity rates compared with total cholecystectomy. These data support the idea that we should move away from the idea that the only acceptable outcome for a cholecystectomy is the complete removal of a gallbladder, especially when it is not safe to do so. This shift toward subtotal cholecystectomy has been appropriately referred to as the safety first, total cholecystectomy second approach.
Management of HEPATIC ADENOMA
MANAGEMENT
At a minimum, cessation of exogenous hormones is recommended, followed by serial imaging, as these lesions will shrink when the inciting hormone has been removed. In general, to obtain either CT or MRI every 6 months for the first 2 years and then once annually for lesions that we are following. Intervention is dictated by the risk of hemorrhage and malignant transformation, which is directly correlated to size. Hepatocellular carcinoma is seen in 5% of patients with lesions exceeding 8 cm. The rate of rupture is strongly associated with size > 5 cm.
Surgical resection is recommended for lesions ≥ 5 cm, those that are enlarging, those for which malignancy cannot be excluded, and those that are symptomatic. Additionally, adenomas in men, regardless of size, and especially those that are associated with anabolic steroid use, those with glycogen storage disease, and those that harbor ß-catenin mutations should also be given serious consideration for surgical extirpation.
Pregnant women with HA pose a management challenge. Since adenomas respond to hormones, they can increase in size with pregnancy and thus put the patient at risk for rupturing and bleeding. For women who would like to become pregnant, close monitoring without discouraging the patient’s wish is
recommended for lesions < 5 cm. However, for those patients with lesions > 5 cm or those who had complications from the adenomas from previous pregnancies, we recommend surgical resection prior to proceeding with the pregnancy. In situations where HA is discovered during pregnancy, we recommend close monitoring for lesions < 5 cm. However, for lesions > 5 cm, surgical resection should be considered during the second trimester but delayed in the third trimester since surgical intervention during this trimester is fraught with complications.
Managing the “difficult” gallbladder
The gold standard for the surgical treatment of symptomatic cholelithiasis is conventional laparoscopic cholecystectomy (LC). The “difficult gallbladder” is a scenario in which a cholecystectomy turns into an increased surgical risk compared with standard cholecystectomy. The procedure may be difficult due to processes that either obscure normal biliary anatomy (such as acute or chronic inflammation) or operative exposure (obesity or adhesions caused by prior upper abdominal surgery). So, when confronted with a difficult cholecystectomy, the surgeon has a must: to turn the operation into a safe cholecystectomy, which can mean conversion (to an open procedure), cholecystostomy, or partial/ subtotal cholecystectomy. The surgeon should understand that needs to rely on damage control, to prevent more serious complications if choosing to advance and progress to a complete cholecystectomy.
When to Predict a Difficult Laparoscopic Cholecystectomy
A difficult cholecystectomy may be predicted preoperatively based on patient characteristics and ultrasound and laboratory findings. This is probably a very important step in mitigating the high risk associated with a difficult procedure and may serve either to reschedule the procedure or design intraoperative strategies of management to guarantee a safe performance of the surgical procedure.
The following situations are associated with a higher chance of a difficult cholecystectomy:
• Acute cholecystitis (more than 5 days of onset)
• Previous cholecystitis episode
• Male sex
• Obesity
• Cirrhosis
• Sclero-atrophic gallbladder
• Thick walls (>5 mm)
• Previous signs of canalicular dwelling (clinical and laboratory)
Through multivariate analysis, Bourgoin identified these elements of predictive help to identify difficult LC: male sex, previous cholecystitis attack, fibrinogen, neutrophil, and alkaline phosphatase levels. Another important point is the fact of conversion from a laparoscopic procedure to an open and traditional cholecystectomy, usually through a right subcostal incision. Conversion should not be considered as a personal failure, and the surgeon needs to understand the concept of “safety first,” considering that conversion is performed in order to complete the procedure without additional risks and preventing complications and not solving intraoperative complications. It is also useful to define a time threshold to aid in the decision to convert. It is not worth taking an hour and a half and still dissecting adhesions, preventing the correct visualization of the cystic pedicle. This time limit represents a method to prevent inefficiencies in the operating room (OR) schedule as well as additional expenditures.
A smart surgeon should rely to conversion in the following situations:
• Lack of progress in the procedure
• Unclear anatomy/any grade of uncertainty
• CVS not achieved
• Bleeding/vascular injury
• BD injury
• Lack of infrastructure, expertise, and support
Final Remarks
The primary goal of a laparoscopic cholecystectomy in the treatment of symptomatic cholelithiasis is the safe remotion of the gallbladder and the absence of common bile duct injury. Some tips to take into account:
– Never perform a laparoscopic cholecystectomy without a skilled surgeon close by.
– Beware of the easy gallbladder.
– Slow down, take your time.
– Knowledge is power, conversión can be the salvation!
– Do not repair a bile duct injury (unless you have performed at least 25 hepaticojejunostomies).
– Do not ignore postoperative complaints (pain, jaundice, major abdominal discomfort, fever)
Other options when confronted with a difficult laparoscopic cholecystectomy are:
– A percutaneous cholecystostomy, if the risk was identified preoperatively or the patient is a poor surgical candidate;
– An intraoperative cholangiography, which may aid in identifying an injury to the bile duct and solve it, if you are an experienced surgeon;
– A subtotal or partial cholecystectomy;
– Ask for help;
– Conversion to an open procedure;