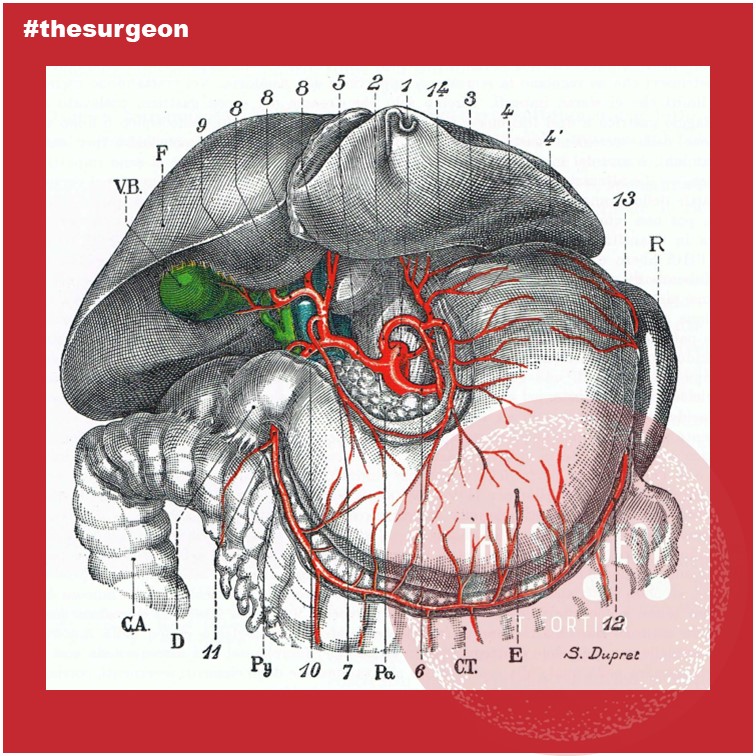
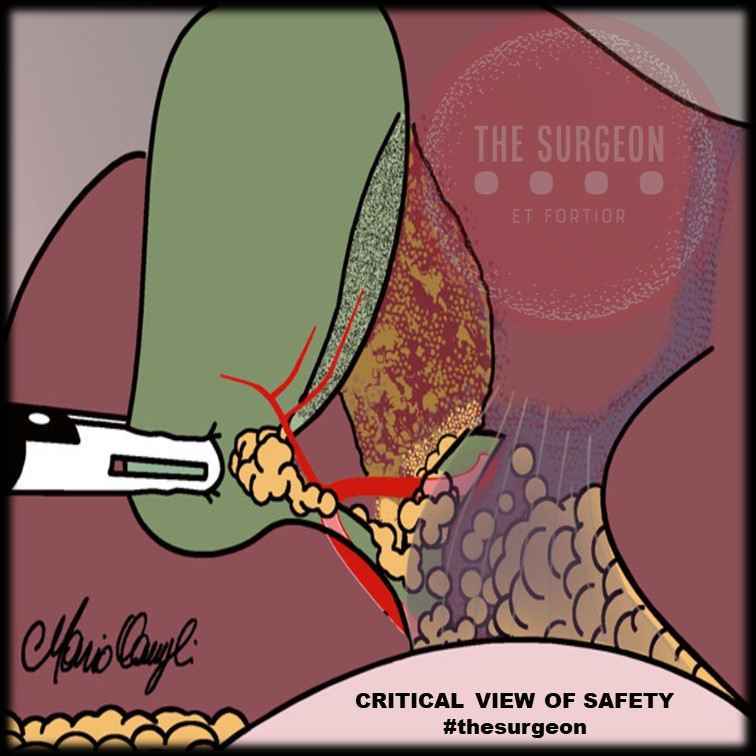
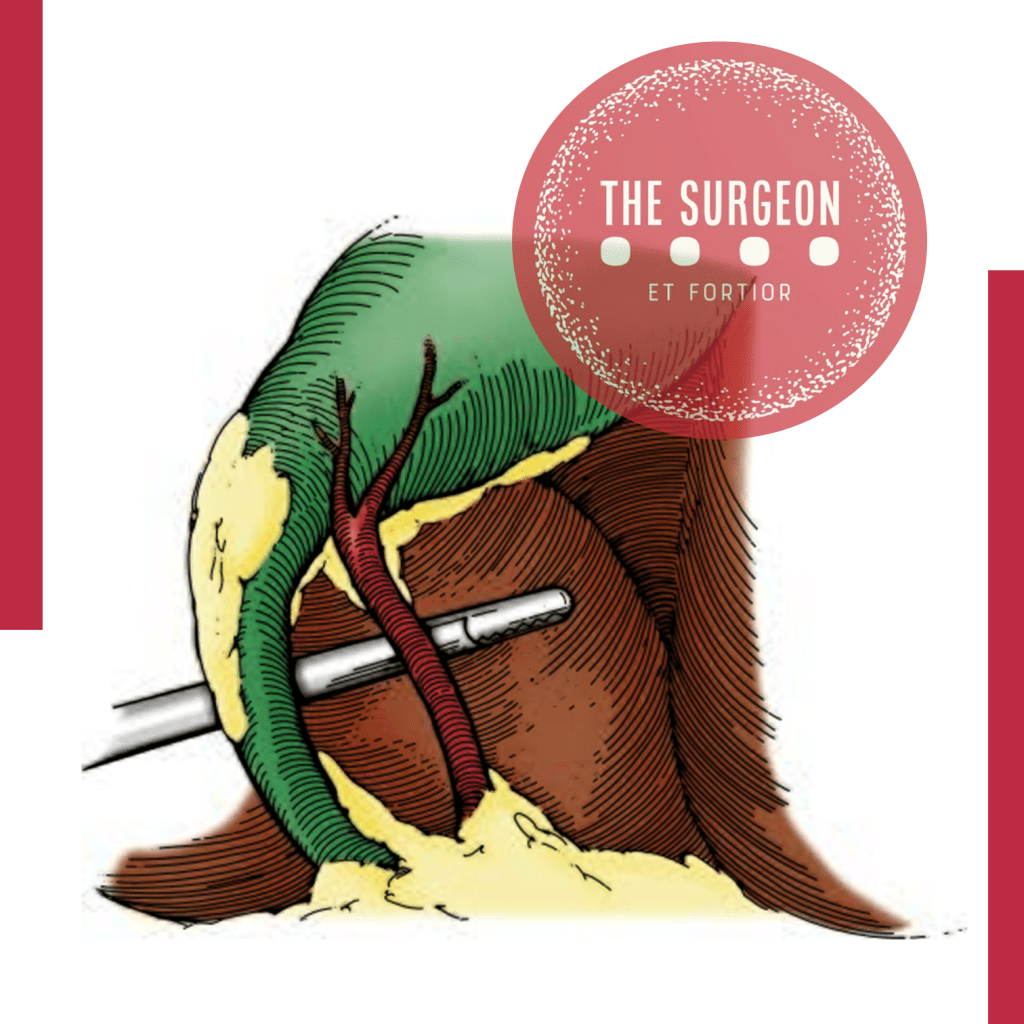
Inteligência Artificial & Apendicite Aguda
Uso da Inteligência Artificial Generativa no Diagnóstico, Tratamento Cirúrgico e Avaliação de Prognóstico da Apendicite Aguda
Introdução
A apendicite aguda continua sendo a causa mais comum de abdome agudo cirúrgico no mundo, com incidência estimada de 100 a 150 casos por 100.000 habitantes ao ano. No Brasil, representa uma das principais causas de internação cirúrgica no SUS. Apesar de amplamente estudada e com tratamento bem estabelecido, a apendicite aguda ainda apresenta desafios clínicos, como o diagnóstico precoce, a decisão operatória e a estratificação de risco de complicações. Nesse contexto, a Inteligência Artificial Generativa (IAG) emerge como uma tecnologia disruptiva com potencial transformador na abordagem cirúrgica dessa condição.
Diagnóstico com Apoio de IA Generativa
O diagnóstico precoce da apendicite aguda depende da correlação de dados clínicos, laboratoriais e de imagem. A IAG, treinada com grandes volumes de dados de prontuários eletrônicos, imagens de tomografia e ultrassonografias, pode sintetizar essas informações em tempo real para gerar hipóteses diagnósticas com acurácia comparável — e, em alguns casos, superior — à avaliação humana isolada. Modelos generativos baseados em deep learning, como os transformers, são capazes de identificar padrões sutis de apresentação clínica atípica, sobretudo em populações vulneráveis, como crianças pequenas, idosos e gestantes. Um exemplo prático é o uso de sistemas que combinam texto livre do prontuário com imagens de abdome para gerar relatórios diagnósticos automatizados e sugerir scores clínicos (como Alvarado ou AIR score) com ajuste probabilístico personalizado, auxiliando o cirurgião na tomada de decisão.
Tratamento Cirúrgico Guiado por IA
A cirurgia laparoscópica é o padrão ouro no tratamento da apendicite aguda, mas a escolha do momento cirúrgico e a abordagem ideal ainda são decisões dependentes da experiência do cirurgião e das condições clínicas do paciente. A IAG pode ser integrada a sistemas de suporte intraoperatório, auxiliando em navegação cirúrgica assistida por imagem, sugestão de condutas intraoperatórias com base em bancos de dados operatórios, e até mesmo em treinamento em simulações realistas de apendicectomia via realidade aumentada e modelos generativos de anatomia personalizada.
Em cenários de medicina robótica, já há estudos utilizando IA generativa para gerar “scripts” de procedimentos otimizados e oferecer feedback em tempo real com base em dados históricos de performance técnica — promovendo cirurgias mais seguras, rápidas e com menor taxa de complicações.
Avaliação Prognóstica com IA Generativa
A estratificação de risco no pós-operatório é outro campo onde a IAG pode oferecer avanços concretos. A partir de redes neurais treinadas em desfechos de milhares de pacientes com apendicite, esses modelos podem prever probabilidades de complicações como abscesso residual, íleo paralítico ou necessidade de reabordagem, considerando variáveis clínicas, laboratoriais, intraoperatórias e demográficas. Além disso, ferramentas baseadas em IA podem gerar relatórios individualizados de prognóstico funcional, tempo estimado de retorno às atividades e risco de reinternação, permitindo ao cirurgião personalizar o plano de alta, acompanhamento ambulatorial e orientações ao paciente com maior precisão.
Pontos-Chave
- A IA generativa tem capacidade de analisar simultaneamente dados clínicos, laboratoriais e de imagem para melhorar o diagnóstico precoce da apendicite aguda.
- Pode ser integrada à decisão cirúrgica, tanto no pré quanto no intraoperatório, por meio de simulação, navegação assistida e análise de performance técnica.
- Modelos preditivos baseados em IA oferecem ferramentas objetivas para prognóstico pós-operatório personalizado, otimizando o seguimento do paciente.
- O uso de IAG deve ser encarado como ferramenta complementar ao raciocínio clínico do cirurgião, jamais como substituto da experiência e do julgamento médico.
- O avanço dessas tecnologias requer formação crítica e ética dos futuros cirurgiões, capacitando-os para liderar a incorporação segura e eficaz dessas ferramentas na prática assistencial.
Conclusão
A incorporação da Inteligência Artificial Generativa na cirurgia do aparelho digestivo representa um novo paradigma na medicina personalizada, baseada em dados e centrada no paciente. No caso da apendicite aguda — uma das mais frequentes emergências cirúrgicas —, o uso responsável e crítico da IAG pode aprimorar significativamente os pilares do cuidado: diagnóstico, decisão operatória e prognóstico. O cirurgião do futuro será, acima de tudo, um líder clínico capaz de integrar inteligência humana e artificial com sabedoria e discernimento ético.
“A tecnologia não substitui o cirurgião. Ela amplia sua visão, mas é o julgamento humano que decide a incisão.” — Sir John Black, ex-presidente do Royal College of Surgeons
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#InteligenciaArtificialNaMedicina #CirurgiaDoAparelhoDigestivo #ApendiciteAguda #DiagnósticoComIA #CirurgiaGuiadaPorDados
Íleo Adinâmico e Íleo Pós-Operatório: Compreensão Atual e Aplicações na Cirurgia Digestiva
Introdução
A motilidade intestinal no pós-operatório abdominal é uma área frequentemente mal compreendida, apesar de sua importância clínica. Termos como íleo pós-operatório (POI, do inglês postoperative ileus) e íleo adinâmico são frequentemente utilizados de forma intercambiável, mas representam entidades fisiopatológicas distintas. Compreender suas diferenças é crucial para a conduta apropriada e para evitar intervenções desnecessárias. Neste artigo, abordamos as bases fisiológicas e clínicas dessas condições, diferenciando-as de forma clara, com foco na prática da cirurgia digestiva.
Íleo Pós-Operatório (POI)
O POI é uma resposta fisiológica previsível que acomete predominantemente o estômago e o cólon nas primeiras 24 a 96 horas após uma laparotomia. Ao contrário da crença comum, o íleo verdadeiro do intestino delgado é raro nesse contexto. Estudos intraoperatórios demonstram que o intestino delgado mantém atividade contrátil mesmo durante o procedimento, enquanto o estômago e o cólon mostram inatividade motora, mesmo com estímulos.
A ausência de ruídos hidroaéreos típicos do POI deve-se, sobretudo, à falta de progressão do gás deglutido, não a uma ausência de motilidade intestinal. O mito de que a manipulação extensa do intestino delgado prolonga o POI foi desmentido por estudos experimentais, sugerindo que o trauma da parede abdominal e o uso de opioides são os principais fatores desencadeantes.
Com o avanço das técnicas minimamente invasivas e dos protocolos de recuperação precoce (ERAS), o impacto clínico do POI tornou-se cada vez menos relevante, sobretudo após cirurgias laparoscópicas, como a colectomia laparoscópica ou a gastrectomia subtotal com reconstrução em Y-de-Roux.
Íleo Adinâmico
O íleo adinâmico verdadeiro é uma condição patológica e generalizada, com bloqueio da motilidade em todo o trato gastrointestinal: estômago, intestino delgado e cólon. Trata-se de uma disfunção neuromuscular reflexa secundária, frequentemente associada a quadros sistêmicos como sepse, trauma retroperitoneal, hematomas ou cirurgias retroperitoneais (ex: transplante renal). Essas condições interferem na inervação autonômica visceral, levando à inatividade motora intestinal completa.
Clinicamente, manifesta-se com distensão abdominal, náuseas, vômitos, obstipação completa (fezes e flatos) e achados radiológicos de distensão gástrica, de delgado e cólon. Diferente da obstrução mecânica, a dor cólica é incomum. O diagnóstico é clínico e radiológico, sendo essencial excluir causas obstrutivas distais, como neoplasias retais (por proctoscopia ou enema opaco).
O tratamento é conservador e de suporte, com correção do fator causal subjacente (geralmente sepse). A introdução de pró-cinéticos ou intervenções cirúrgicas raramente se justifica e pode ser prejudicial.
Aplicação na Cirurgia Digestiva
Na cirurgia digestiva, o conhecimento detalhado desses fenômenos tem implicações práticas relevantes:
- A retomada precoce da dieta por sonda jejunal ou via oral, mesmo após grandes ressecções, é segura e desejável, uma vez que o intestino delgado se mantém funcional no pós-operatório imediato.
- O uso criterioso de opioides deve ser avaliado, já que retarda a motilidade gástrica e colônica e prolonga o POI.
- Cirurgias minimamente invasivas devem ser priorizadas sempre que possível, devido à menor resposta inflamatória e menor impacto na motilidade intestinal.
- Reconhecer o íleo adinâmico é essencial para evitar reoperações desnecessárias, já que o problema é sistêmico e autolimitado com a resolução da causa de base.
Pontos-Chave
- POI é uma resposta fisiológica transitória que acomete estômago e cólon, e não o intestino delgado.
- O íleo adinâmico é uma condição patológica que afeta todo o tubo digestivo, geralmente por causas sistêmicas ou retroperitoneais.
- Manipulação do intestino delgado não prolonga o POI — o trauma parietal e o uso de opioides são mais determinantes.
- A abordagem laparoscópica e os protocolos ERAS diminuem drasticamente a incidência e a gravidade do POI.
- O tratamento do íleo adinâmico é conservador e depende da resolução da causa sistêmica subjacente.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
Para o cirurgião do aparelho digestivo, distinguir entre POI e íleo adinâmico é essencial para um manejo racional e eficaz. A compreensão das bases fisiológicas permite evitar exames desnecessários, intervenções precipitadas e retardos no cuidado. Além disso, reforça a importância das estratégias modernas de recuperação precoce, da analgesia multimodal sem opioides, e da valorização das vias de acesso minimamente invasivas. Saber esperar e não intervir é, por vezes, o ato mais sofisticado da prática cirúrgica.
“Conhecer o tempo certo de não operar é tão vital quanto saber quando operar.” — William Stewart Halsted
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#IleoPosOperatorio #CirurgiaDigestiva #IleoAdinamico #ERASprotocol #Laparoscopia
Insuficiência Renal Perioperatória
Um Desafio para o Cirurgião do Aparelho Digestivo
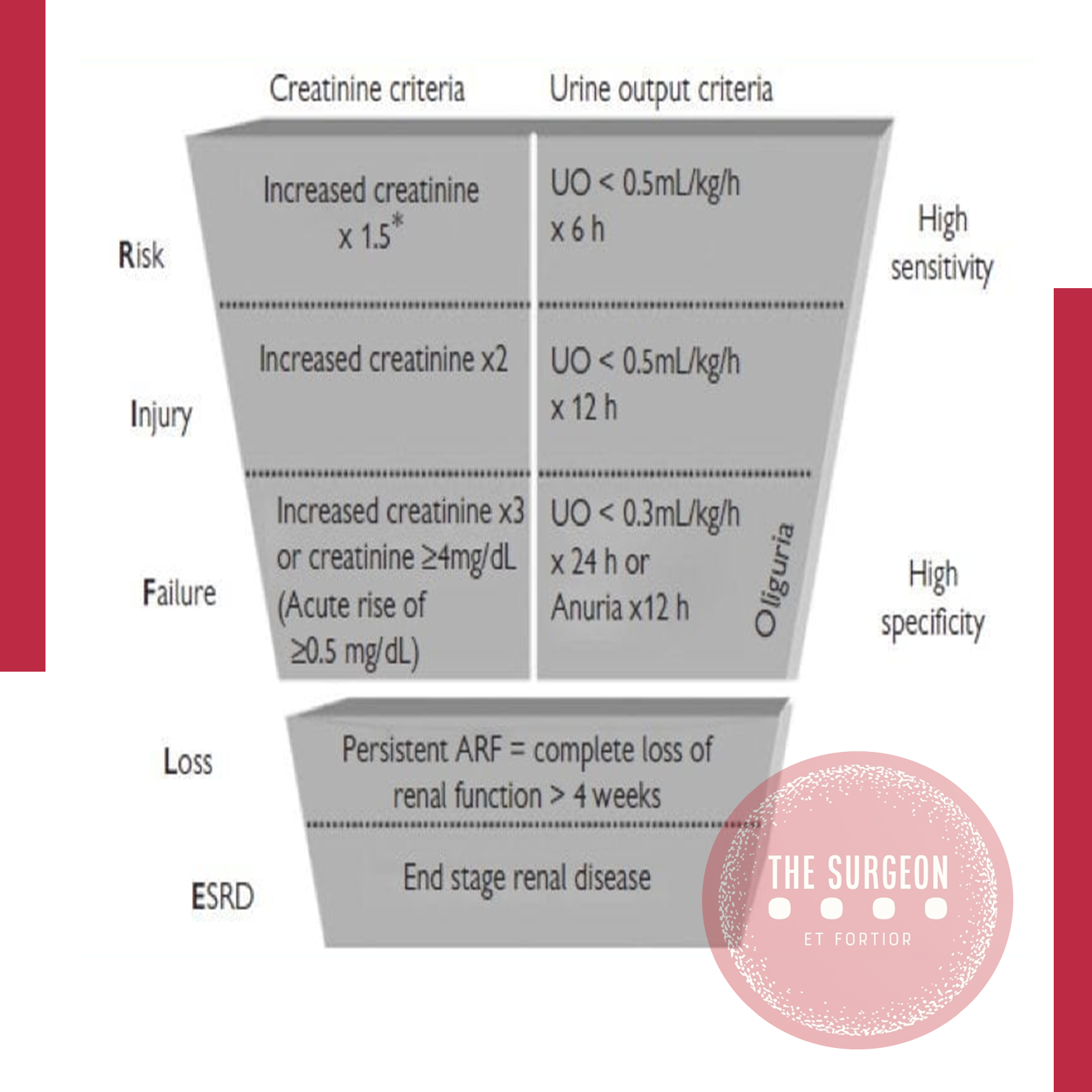
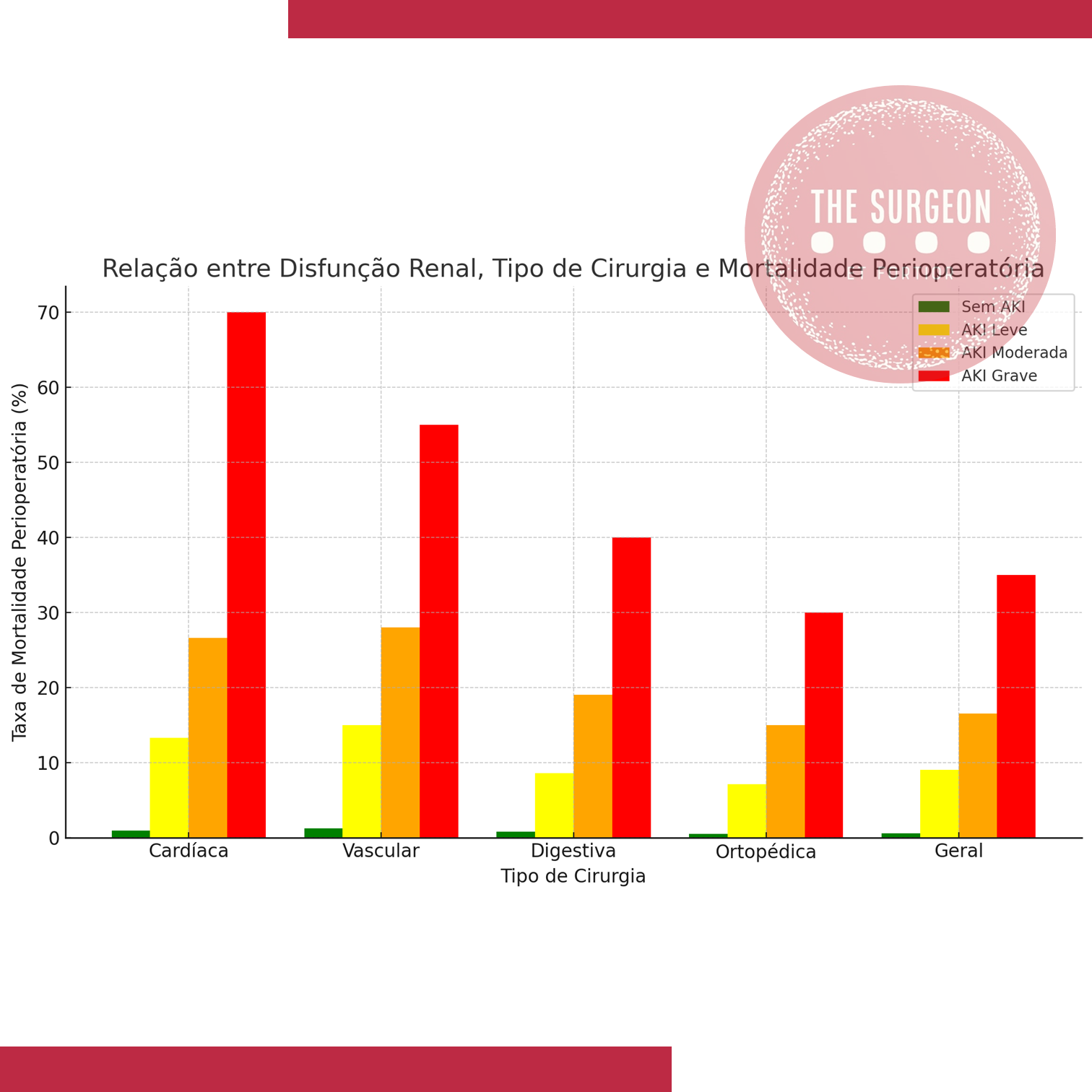
A insuficiência renal perioperatória (IRP), também conhecida como lesão renal aguda (AKI, na sigla em inglês), representa uma complicação grave associada a cirurgias de grande porte, como as do aparelho digestivo. Essa condição, caracterizada pela rápida perda da função renal, ocorre em até 40% dos pacientes cirúrgicos de alto risco, resultando em aumento de morbidade e mortalidade, além de complicações multiorgânicas. No Brasil, estima-se que cerca de 10% das internações hospitalares estejam associadas à disfunção renal, segundo dados da Sociedade Brasileira de Nefrologia. Neste artigo, direcionado a estudantes de medicina e residentes de cirurgia geral, abordaremos de forma didática os principais aspectos da insuficiência renal perioperatória, sua fisiopatologia, fatores de risco e medidas preventivas, com ênfase na aplicação prática no contexto das cirurgias do aparelho digestivo.
Introdução
A insuficiência renal perioperatória é uma das complicações mais temidas no pós-operatório de grandes cirurgias, incluindo procedimentos digestivos, sendo associada a um aumento significativo da mortalidade e ao prolongamento da internação hospitalar. Sua definição se baseia em alterações agudas na função renal, comumente medidas pelo aumento da creatinina sérica ou redução do volume urinário.
O diagnóstico precoce e a implementação de estratégias de prevenção são fundamentais para mitigar seus efeitos, especialmente em pacientes com predisposição a essa condição. Além disso, novas abordagens, como o uso de biomarcadores, têm surgido como promissoras ferramentas para diagnóstico mais rápido e preciso da insuficiência renal.
Fisiopatologia
A fisiopatologia da insuficiência renal perioperatória é complexa e multifatorial, envolvendo três principais mecanismos: hipoperfusão renal, inflamação sistêmica e resposta neuroendócrina ao estresse cirúrgico. Durante cirurgias de grande porte, como as do trato digestivo, o fluxo sanguíneo renal pode ser comprometido devido à hipotensão, hipovolemia e uso de anestésicos vasodilatadores.
A autorregulação renal tenta compensar essas alterações por meio da vasoconstrição arteriolar e ativação do sistema renina-angiotensina-aldosterona, mantendo a perfusão glomerular. Contudo, em casos de hipoperfusão prolongada, pode ocorrer isquemia renal, culminando em necrose tubular aguda e falência renal.
O estresse cirúrgico, associado à inflamação sistêmica, também contribui para a lesão renal por meio da liberação de citocinas pró-inflamatórias, aumento do estresse oxidativo e disfunção endotelial. Assim, mesmo cirurgias que não afetam diretamente os rins podem desencadear um processo inflamatório sistêmico que compromete a função renal.
Fatores de Risco
Diversos fatores aumentam o risco de desenvolvimento de insuficiência renal perioperatória. Entre os mais relevantes estão:
- Idade avançada: Pacientes idosos têm maior risco de hipoperfusão renal devido à diminuição da função renal basal.
- Doenças crônicas pré-existentes: Hipertensão arterial sistêmica, diabetes mellitus e insuficiência cardíaca são condições que predispõem à lesão renal aguda.
- Cirurgias prolongadas ou complexas: Procedimentos com grande perda sanguínea, como as cirurgias de ressecção hepática ou pancreática, aumentam o risco de insuficiência renal.
- Uso de medicamentos nefrotóxicos: O uso de contrastes iodados, anti-inflamatórios não esteroidais (AINEs) e certos antibióticos no perioperatório pode precipitar a disfunção renal.
Prevenção e Aplicação na Cirurgia Digestiva
A prevenção da insuficiência renal perioperatória envolve uma abordagem multidisciplinar, com foco em medidas pré, intra e pós-operatórias. Alguns pontos-chave incluem:
- Hidratação adequada: A reposição volêmica com cristaloides balanceados é essencial para manter a perfusão renal. Estudos demonstram que a administração moderada de fluidos reduz o risco de AKI sem causar sobrecarga hídrica.
- Controle hemodinâmico rigoroso: A manutenção da pressão arterial em níveis adequados (média arterial ≥ 65 mmHg) durante o procedimento é crucial. O uso de monitorização hemodinâmica invasiva pode guiar a administração de fluidos e inotrópicos.
- Evitar o uso de nefrotóxicos: Sempre que possível, deve-se optar por alternativas menos tóxicas aos rins, como o uso controlado de contraste iodado em exames pré-operatórios e a redução de AINEs.
- Uso de biomarcadores: Embora o aumento da creatinina sérica seja o método mais comum para diagnóstico, ele apresenta atraso em relação ao início da lesão. Biomarcadores como a lipocalina associada à gelatinase de neutrófilos (NGAL) e a molécula de lesão renal-1 (KIM-1) têm demonstrado sensibilidade precoce para a detecção da AKI, especialmente em cirurgias de grande porte.
Na cirurgia digestiva, essas estratégias são ainda mais importantes, dado que procedimentos como a ressecção hepática, gastrectomia e cirurgias pancreáticas estão associados a maior risco de complicações renais devido ao potencial de sangramento, manipulação de grandes vasos e impacto sistêmico.
Pontos-Chave
- A insuficiência renal perioperatória ocorre em até 40% dos pacientes de alto risco, sendo uma complicação significativa em cirurgias de grande porte.
- Hipoperfusão, inflamação e resposta ao estresse cirúrgico são os principais mecanismos fisiopatológicos envolvidos.
- Idade avançada, comorbidades e o uso de medicamentos nefrotóxicos são fatores de risco importantes.
- A prevenção depende de uma abordagem multidisciplinar, com hidratação adequada, controle hemodinâmico e redução do uso de drogas nefrotóxicas.
- Biomarcadores emergem como ferramentas promissoras para o diagnóstico precoce da insuficiência renal.
Conclusão
A insuficiência renal perioperatória é uma complicação que todo cirurgião do aparelho digestivo deve estar preparado para prevenir e manejar. O impacto negativo dessa condição sobre a recuperação do paciente, a mortalidade e os custos hospitalares justifica a adoção de protocolos preventivos robustos. A integração de medidas de monitoramento rigoroso e intervenções precoces pode reduzir significativamente as complicações renais em cirurgias digestivas de alta complexidade.
Nas palavras de William Osler, “A medicina é uma ciência da incerteza e uma arte da probabilidade”. Aplicar esse pensamento na prática diária implica antecipar complicações, como a insuficiência renal perioperatória, e estar preparado para enfrentá-las com base na melhor evidência disponível.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#InsuficienciaRenalPerioperatoria
#LesaoRenalAguda
#CirurgiaDigestiva
#PrevencaoAKI
#Medicina
Analgesia Pós-Operatória
Otimizando o Controle da Dor em Cirurgia Digestiva
A dor pós-operatória é uma consequência inevitável da cirurgia, mas sua severidade pode ser minimizada com uma abordagem multimodal eficaz. No Brasil, estudos mostram que até 80% dos pacientes submetidos a procedimentos cirúrgicos do aparelho digestivo relatam dor moderada a intensa no pós-operatório imediato, evidenciando a necessidade de melhorias no manejo da analgesia.
Fatores Influenciadores da Dor Pós-Operatória
Diversos fatores influenciam a intensidade da dor experimentada pelos pacientes após cirurgias semelhantes, como o local da incisão, variações individuais e mecanismos neurais complexos. A teoria do controle do portão explica como vias inibitórias descendentes modulam a transmissão da dor na medula espinhal, justificando a piora noturna e melhora diurna da dor.
Tipos de Dor Pós-Operatória
- Dor somática superficial: bem localizada, com função protetora e facilmente tratada por técnicas analgésicas comuns.
- Dor somática profunda: pode não ser bem localizada, tem função protetora (como imobilização articular) e responde a diversos analgésicos.
- Dor visceral: mal localizada, frequentemente referida e de difícil tratamento.
Em grandes cirurgias, os três tipos de dor podem estar presentes, dificultando o controle analgésico.
Pacientes em Risco para Maior Dor Pós-Operatória
A identificação de pacientes que apresentam maior risco de dor pós-operatória é crucial para a implementação de estratégias de manejo eficazes. Vários fatores podem contribuir para uma experiência de dor mais intensa e prolongada após a cirurgia, portanto a avaliação cuidadosa dos fatores de risco permite que os cirurgiões e a equipe de saúde desenvolvam planos de manejo personalizados e eficazes. Ao abordarmos proativamente esses fatores, é possível melhorar a experiência do paciente e promover uma recuperação mais rápida e confortável. A seguir, discutimos os principais grupos de risco:
1. Pacientes com Dor Crônica Pré-existente
Pacientes que já sofrem de condições de dor crônica, como fibromialgia ou artrite, tendem a relatar níveis mais elevados de dor após a cirurgia. A sensibilização central, um fenômeno em que o sistema nervoso se torna hiper-responsivo a estímulos dolorosos, pode intensificar a dor pós-operatória nesses indivíduos.
2. Histórico de Uso de Opioides
Aqueles que utilizam opioides de forma crônica para o manejo da dor podem apresentar uma tolerância maior aos analgésicos, necessitando de doses mais elevadas para alcançar alívio. Isso pode complicar o manejo da dor pós-operatória e aumentar o risco de efeitos colaterais.
3. Fatores Psicológicos
Pacientes com transtornos de ansiedade, depressão ou histórico de trauma emocional podem experimentar dor mais intensa e uma recuperação mais lenta. A dor é frequentemente exacerbada por fatores emocionais, e a presença de comorbidades psiquiátricas pode dificultar o controle da dor.
4. Idade Avançada
Pacientes mais velhos podem ter uma resposta diferente à dor e ao tratamento analgésico. A diminuição da função renal e hepática, comum em idosos, pode afetar a metabolização de medicamentos, levando à necessidade de ajustes nas dosagens e aumentando o risco de efeitos adversos.
5. Comorbidades Médicas
Condições como diabetes, doenças cardiovasculares e obesidade podem complicar a recuperação e aumentar a percepção da dor. Essas comorbidades podem afetar a resposta inflamatória do corpo e a capacidade de curar, resultando em uma experiência de dor mais significativa.
6. Tipo de Cirurgia Realizada
Procedimentos cirúrgicos mais invasivos ou que envolvem áreas sensíveis, como cirurgias abdominais ou torácicas, estão associados a um maior risco de dor intensa no pós-operatório. A extensão da cirurgia e o tipo de anestesia utilizada também influenciam a intensidade da dor experimentada.
Manejo Multimodal da Dor Pós-Operatória
O foco do tratamento deve ser a dor somática, por meio de:
- Analgesia preemptiva com injeção de anestésico local no local da incisão
- Bloqueios de nervos específicos para cada procedimento
- Abordagem multimodal com opioides, bloqueios de nervos periféricos (BNP) e analgésicos não opioides
Pacientes com dor crônica requerem otimização pré-operatória e redução gradual de opioides. Altas doses de opioides endovenosos são frequentemente necessárias, complementadas por tratamentos não opioides e não farmacológicos, como BNP, acetaminofeno, anti-inflamatórios e agentes como a dexmedetomidina.
Pontos-Chave
- A dor pós-operatória é comum, mas sua severidade pode ser reduzida com uma abordagem multimodal
- Fatores individuais e mecanismos neurais complexos influenciam a dor
- O tratamento deve focar na dor somática, usando analgesia preemptiva e bloqueios de nervos
- Pacientes com dor crônica requerem cuidados especiais, com redução gradual de opioides e uso de tratamentos não opioides
Conclusão
O manejo eficaz da dor pós-operatória em cirurgia digestiva requer uma abordagem multimodal, combinando técnicas farmacológicas e não farmacológicas, com ênfase na analgesia preemptiva e bloqueios de nervos. Essa estratégia melhora significativamente a experiência do paciente e sua recuperação pós-operatória.
“O alívio da dor é um dos deveres mais sagrados da profissão médica.” – Hippocrates
Gostou? Nos deixe um comentário, compartilhe em suas redes sociais e/ou mande sua dúvida pelo Chat On-line em nossa DM do Instagram.
#DorPósOperatória #AnalgesiaPósOperatória #CirurgiaDigestiva #ManejoMultimodal #BloqueiosdeNervos
Nutrição Perioperatória em Cirurgia Digestiva
Ferramenta para Reduzir Complicações e Acelerar a Recuperação
A terapia nutricional é um dos pilares fundamentais no cuidado de pacientes submetidos a cirurgias do aparelho digestivo. Frequentemente subestimada, sua importância vai muito além de apenas fornecer suporte calórico. A nutrição adequada antes e após a cirurgia pode determinar o sucesso do procedimento, impactando diretamente na recuperação, no tempo de internação hospitalar e na taxa de complicações. Neste post, abordaremos como a terapia nutricional pode ser aplicada de forma estratégica na cirurgia digestiva, explorando evidências e práticas recomendadas para otimizar os resultados cirúrgicos.
A Importância da Nutrição na Cirurgia Digestiva
O manejo nutricional em cirurgia digestiva é um aspecto crucial que pode influenciar drasticamente os desfechos clínicos. Em pacientes com câncer gastrointestinal, por exemplo, a perda de peso e a sarcopenia (perda de massa muscular) são comuns, exacerbando o risco de complicações pós-operatórias. Segundo dados do Ministério da Saúde, a desnutrição hospitalar atinge cerca de 48,1% dos pacientes internados no Brasil, muitos deles em unidades de cirurgia. Portanto, a terapia nutricional deve ser incorporada como uma estratégia preventiva e terapêutica no manejo perioperatório.
A Base Científica da Terapia Nutricional
Diversos estudos demonstram que a nutrição inadequada no período perioperatório está associada a um aumento significativo nas complicações cirúrgicas, incluindo infecções, deiscências de anastomose e falência multiorgânica. Um dos pontos-chave é a avaliação nutricional pré-operatória, que deve incluir indicadores como o Índice de Risco Nutricional (NRS-2002) e a albumina sérica. Pacientes com NRS ≥3 ou albumina abaixo de 30 g/L têm um risco elevado de complicações e devem ser submetidos a intervenções nutricionais imediatas.
Além disso, a sarcopenia, presente em até 83% dos pacientes geriátricos com doenças graves, é outro fator de risco crítico. A perda de massa muscular, particularmente em pacientes obesos, pode ser subdiagnosticada, uma vez que o excesso de gordura pode mascarar a perda muscular. Métodos de avaliação, como a bioimpedância e a tomografia computadorizada, são recomendados para uma avaliação precisa da composição corporal.
Aplicação na Cirurgia Digestiva | Estratégias Nutricionais
Na prática clínica, a terapia nutricional pode ser dividida em três fases principais: pré-operatória, intraoperatória e pós-operatória.
- Fase Pré-Operatória: Nesta fase, o objetivo é otimizar o estado nutricional do paciente antes da cirurgia, um processo conhecido como “preabilitarão”. Este processo pode incluir a suplementação com imuno nutrientes, como arginina e ômega-3, e uma dieta rica em proteínas, especialmente em pacientes com câncer. A literatura sugere que intervenções de 4 a 6 semanas, combinando nutrição e exercício físico, podem melhorar significativamente a condição física e reduzir as complicações cirúrgicas.
- Fase Intraoperatória: Durante a cirurgia, o manejo nutricional pode incluir a colocação de tubos de alimentação, como a jejunostomia, para garantir a continuidade do suporte nutricional em pacientes que terão dificuldades com a alimentação oral no pós-operatório imediato.
- Fase Pós-Operatória: Após a cirurgia, a nutrição enteral precoce é incentivada, sempre que possível, mesmo após ressecções gastrointestinais complexas. Quando a ingestão oral ou enteral é insuficiente, a nutrição parenteral pode ser utilizada como complemento, visando garantir que o paciente receba pelo menos 50% das suas necessidades calóricas dentro dos primeiros 7 dias após a cirurgia.
Indicação da Via Enteral ou Parenteral e Cálculo de Calorias Diárias
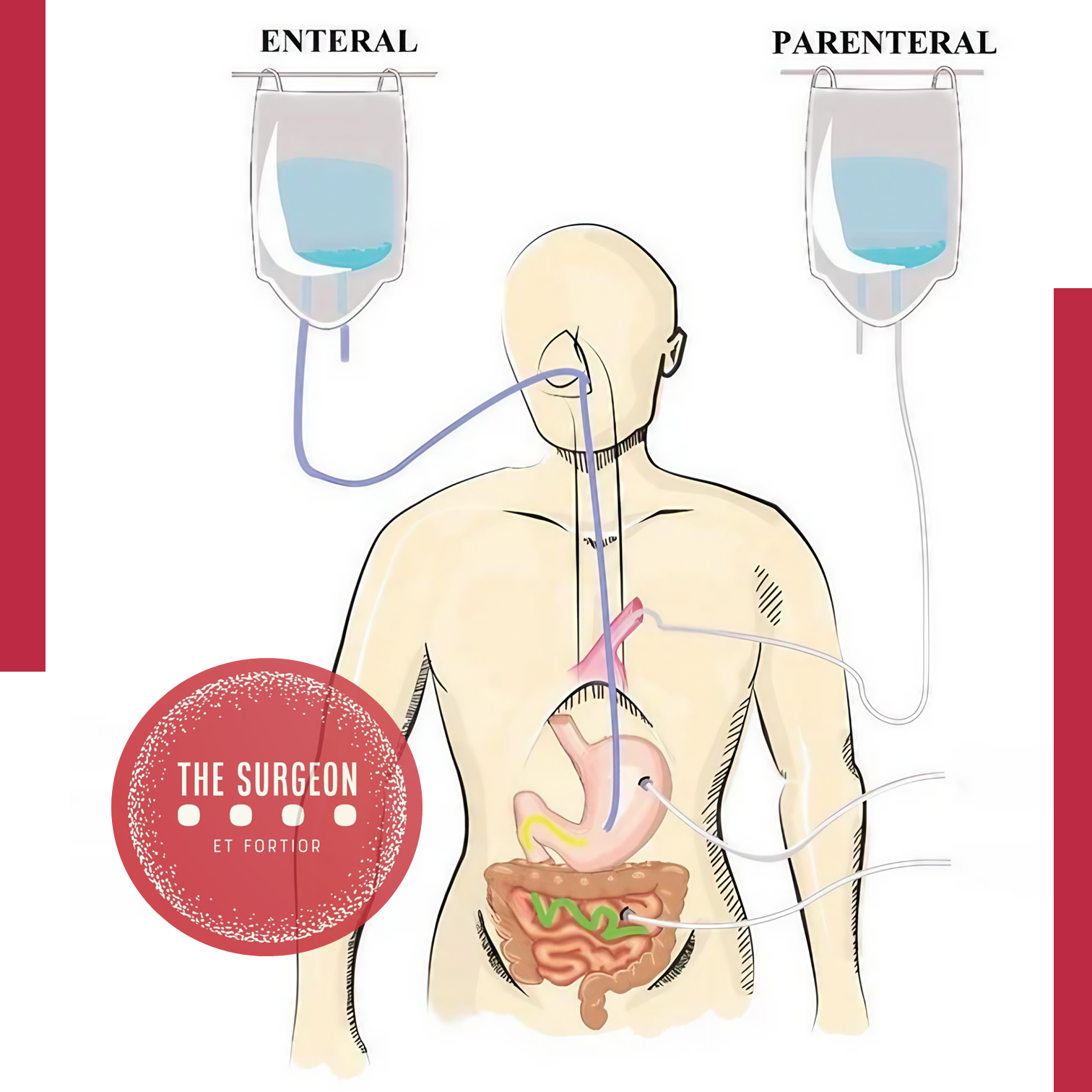
A escolha entre a nutrição enteral e parenteral é uma decisão crítica no manejo nutricional perioperatório de pacientes submetidos a cirurgias digestivas. A via enteral é preferida sempre que possível, pois está associada a menores taxas de complicações, como infecções e falência de múltiplos órgãos. No entanto, existem situações específicas em que a via parenteral se torna necessária.
Indicação da Via Enteral:
A nutrição enteral é indicada para pacientes que possuem o trato gastrointestinal funcional, ou seja, capaz de absorver nutrientes de maneira eficaz. Ela deve ser iniciada o mais precocemente possível, preferencialmente dentro das primeiras 24-48 horas após a cirurgia, mesmo após procedimentos complexos, como ressecções gastrointestinais. As principais indicações incluem:
- Função Gastrointestinal Preservada: Pacientes que podem deglutir ou em que o estômago e intestinos estão funcionais.
- Imunomodulação: Nutrição enteral pode incluir suplementos imunomoduladores, como arginina e glutamina, que ajudam a melhorar a resposta imune do paciente.
- Prevenção de Atrofia Intestinal: A nutrição enteral mantém a integridade da mucosa intestinal e previne a translocação bacteriana.
Indicação da Via Parenteral:
A nutrição parenteral é indicada em situações onde a via enteral é contraindicada ou insuficiente para atender às necessidades nutricionais do paciente. Exemplos incluem:
- Disfunção Gastrointestinal: Obstrução intestinal, íleo paralítico, fístulas de alto débito, ou síndromes de má absorção severas.
- Impossibilidade de Uso da Via Enteral: Pacientes com lesões graves na boca, esôfago ou estômago que impedem a alimentação por via oral ou enteral.
- Complemento à Nutrição Enteral Insuficiente: Quando a nutrição enteral não é suficiente para fornecer mais de 50% das necessidades calóricas do paciente por mais de 7 dias.
Cálculo de Calorias por kg por Dia:
Para garantir que o paciente receba a quantidade adequada de calorias, utiliza-se uma fórmula simples baseada no peso corporal. A necessidade calórica diária pode variar conforme o estado clínico do paciente, mas uma estimativa geral é:
- Pacientes em estado crítico: 25-30 kcal/kg/dia
- Pacientes em recuperação pós-operatória: 20-25 kcal/kg/dia
- Pacientes com baixo gasto energético: 20-22 kcal/kg/dia
Por exemplo, para um paciente de 70 kg em estado crítico, a necessidade calórica seria aproximadamente 1750 a 2100 kcal/dia (70 kg x 25-30 kcal/kg/dia).
O cálculo deve ser ajustado conforme as condições clínicas específicas do paciente, com monitoramento contínuo para garantir que as necessidades energéticas sejam atendidas de forma eficaz.
Pontos-Chave
- Avaliação Nutricional: Uso rotineiro de ferramentas como o NRS-2002 e a albumina sérica para identificar pacientes em risco.
- Preabilitarão: Implementação de protocolos de preabilitarão, incluindo suplementação e exercícios, especialmente em pacientes com câncer.
- Nutrição Enteral Precoce: Início precoce da alimentação enteral no pós-operatório, mesmo após cirurgias complexas.
- Monitoramento Contínuo: Avaliação contínua da ingestão calórica e ajuste da terapia nutricional conforme necessário.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A integração da terapia nutricional na rotina cirúrgica não deve ser vista como uma opção, mas como uma necessidade para otimizar os desfechos em cirurgias digestivas. A desnutrição e a sarcopenia, se não tratadas adequadamente, podem transformar uma cirurgia de risco moderado em uma operação de alto risco. Portanto, o cirurgião digestivo deve estar sempre atento às necessidades nutricionais dos seus pacientes, colaborando com nutricionistas e equipes multidisciplinares para garantir uma abordagem integral e personalizada.
“Que seu remédio seja seu alimento, e que seu alimento seja seu remédio.” – Hipócrates
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#NutriçãoCirúrgica #CirurgiaDigestiva #Prehabilitação #SaúdeGastrointestinal #TerapiaNutricional
Do Bisturi à Inteligência Artificial
Como a Tecnologia Está Revolucionando o Diagnóstico e Tratamento do Abdome Agudo
Introdução
O abdome agudo, uma condição que desafia médicos há séculos, continua sendo uma das principais causas de admissão nos serviços de emergência em todo o mundo. No Brasil, estima-se que cerca de 5-10% das visitas às emergências sejam devido a dor abdominal aguda. Desde os tempos de Zachary Cope, autor do clássico “Early Diagnosis of the Acute Abdomen” em 1921, até os dias atuais, muito mudou na abordagem dessa condição. Este artigo explora os avanços propedêuticos e terapêuticos no manejo do abdome agudo no século XXI, com foco especial nas aplicações para a cirurgia do aparelho digestivo.
- Evolução da Analgesia
Contrariamente à crença antiga de que analgésicos poderiam mascarar sintomas importantes, estudos recentes demonstram que a administração precoce de analgesia não interfere no diagnóstico e pode, na verdade, melhorar a acurácia do exame físico. Um estudo brasileiro mostrou que o uso de tramadol em pacientes com suspeita de apendicite aguda não alterou o diagnóstico final em 95% dos casos.
- Avanços em Imagem
A tomografia computadorizada (TC) com contraste intravenoso emergiu como o padrão-ouro para avaliação do abdome agudo. No Brasil, um estudo multicêntrico revelou que a implementação de protocolos de TC reduziu o tempo médio para diagnóstico em 40% e diminuiu a taxa de laparotomias não terapêuticas em 15%.
- Papel da Ultrassonografia
Embora a TC seja predominante, a ultrassonografia mantém seu valor, especialmente em gestantes e na avaliação de patologias biliares. No contexto brasileiro, onde o acesso à TC pode ser limitado em algumas regiões, a ultrassonografia point-of-care tem se mostrado uma ferramenta valiosa, com sensibilidade de 85% para apendicite aguda em um estudo nacional.
- Consulta Cirúrgica Oportuna
A importância da avaliação precoce por um cirurgião não pode ser subestimada. Dados do Sistema Único de Saúde (SUS) indicam que a redução do tempo entre a admissão e a avaliação cirúrgica de 6 para 3 horas resultou em uma diminuição de 20% na mortalidade por perfuração de víscera oca.
Aplicação na Cirurgia Digestiva, esses avanços trazem implicações significativas:
- Diagnóstico Preciso: A TC de alta resolução permite a identificação precisa de patologias como isquemia mesentérica, diverticulite complicada e neoplasias perfuradas, orientando a abordagem cirúrgica.
- Planejamento Cirúrgico: Imagens tridimensionais permitem um planejamento detalhado, especialmente útil em casos de obstrução intestinal complexa ou tumores localmente avançados.
- Cirurgia Minimamente Invasiva: O diagnóstico precoce e preciso tem aumentado as oportunidades para abordagens laparoscópicas, mesmo em cenários de urgência. No Brasil, a taxa de colecistectomias laparoscópicas de urgência aumentou de 30% para 60% na última década.
- Manejo Não Operatório: Em casos selecionados, como alguns abscessos intra-abdominais, o manejo não operatório guiado por imagem tem se mostrado uma alternativa segura e eficaz.
Pontos-Chave:
- A analgesia precoce é segura e não mascara o diagnóstico.
- A TC com contraste é o exame de escolha na maioria dos casos de abdome agudo.
- A ultrassonografia mantém seu valor, especialmente em cenários específicos.
- A consulta cirúrgica precoce está associada a melhores desfechos.
- O diagnóstico preciso tem expandido as opções de tratamento minimamente invasivo.
Conclusões:
O manejo do abdome agudo no século XXI representa uma síntese harmoniosa entre a arte clínica tradicional e os avanços tecnológicos. Para o cirurgião digestivo, a integração desses elementos – desde a anamnese cuidadosa até a interpretação sofisticada de imagens – é crucial para oferecer o melhor cuidado possível.
A era digital também traz novos desafios e oportunidades. A inteligência artificial está emergindo como uma ferramenta promissora na interpretação de imagens e na predição de desfechos. No entanto, é importante lembrar que a tecnologia é um complemento, não um substituto para o julgamento clínico experiente.
À medida que avançamos, a formação do cirurgião digestivo deve incorporar não apenas habilidades técnicas, mas também competências em interpretação de imagens avançadas e análise crítica de dados. O futuro promete diagnósticos ainda mais precisos e intervenções mais personalizadas, sempre com o objetivo de oferecer o melhor cuidado possível aos pacientes com abdome agudo.
AbdomeAgudo #CirurgiaDigestiva #DiagnósticoPorImagem #MedicinadeEmergência #EducaçãoMédica
“O médico que não pode fazer um diagnóstico sem muitos exames não é um bom médico.” – Martin H. Fischer
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
O Método 5As na Colecistectomia Videolaparoscópica
Uma Abordagem Inovadora para o Cirurgião Digestivo
A colecistectomia videolaparoscópica é um dos procedimentos cirúrgicos mais comuns realizados no aparelho digestivo, especialmente para o tratamento de litíase biliar. O uso do método “5 As” (Assess, Advise, Agree, Assist, Arrange) pode otimizar a abordagem cirúrgica, melhorando a experiência do paciente e os resultados clínicos. Neste artigo, discutiremos a aplicação desta metodologia na prática cirúrgica, com foco em sua importância na formação de estudantes de medicina e residentes em cirurgia geral.
Introdução
A colecistectomia, que envolve a remoção da vesícula biliar, é frequentemente indicada em casos de cálculos biliares sintomáticos. No Brasil, a prevalência de litíase biliar é significativa, afetando cerca de 10% da população, com maior incidência em mulheres e indivíduos com sobrepeso. A abordagem videolaparoscópica, menos invasiva, tem se mostrado eficaz, com taxas de complicações reduzidas e recuperação mais rápida. O método 5As oferece uma estrutura para melhorar a comunicação e a tomada de decisão entre a equipe cirúrgica e o paciente.
Desenvolvimento
O Método 5As
- Assess (Avaliar): Esta etapa envolve a avaliação inicial do paciente, incluindo a história clínica, exames laboratoriais e de imagem. É crucial identificar contraindicações e comorbidades que possam afetar a cirurgia.
- Advise (Orientar): Após a avaliação, o cirurgião deve fornecer informações claras sobre o procedimento, riscos e benefícios, ajudando o paciente a entender a necessidade da cirurgia.
- Agree (Concordar): O consenso entre o cirurgião e o paciente é fundamental. Esta fase deve incluir discussões sobre as expectativas do paciente e o plano cirúrgico.
- Assist (Assistir): Durante a cirurgia, a equipe deve estar atenta a quaisquer complicações que possam surgir. O uso de tecnologia assistiva, como vídeos e simulações, pode ser útil para treinar residentes e melhorar a segurança do procedimento.
- Arrange (Organizar): Após a cirurgia, a organização do seguimento e cuidados pós-operatórios é essencial. Isso inclui agendar consultas de acompanhamento e fornecer orientações sobre a recuperação.
Aplicação na Cirurgia Digestiva
A implementação do método 5As na colecistectomia videolaparoscópica pode resultar em uma abordagem mais centrada no paciente. Estudos mostram que a comunicação eficaz entre a equipe médica e o paciente está associada a melhores resultados clínicos e satisfação do paciente. Além disso, a metodologia pode ser uma ferramenta valiosa na formação de residentes, promovendo habilidades de comunicação e tomada de decisão.
Pontos-Chave
- A colecistectomia videolaparoscópica é um procedimento comum e eficaz para o tratamento de cálculos biliares.
- O método 5As melhora a experiência do paciente e a eficácia do procedimento cirúrgico.
- A formação contínua em comunicação e abordagem centrada no paciente é essencial para o desenvolvimento de cirurgiões competentes.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A adoção do método 5As na prática cirúrgica não apenas melhora os resultados clínicos, mas também enriquece a experiência de aprendizado dos residentes. A ênfase na comunicação e na colaboração entre a equipe cirúrgica e o paciente é um passo importante para a evolução da cirurgia do aparelho digestivo no Brasil. Com a crescente complexidade dos casos e a necessidade de abordagens personalizadas, a metodologia 5As se destaca como uma ferramenta essencial para o cirurgião moderno.
Como disse o renomado médico Sir William Osler: “A medicina é uma ciência da incerteza e uma arte da probabilidade”.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
colecistectomia #cirurgiadigestiva #metodo5as #medicina #educacaocontinuada
Método PANPA
Uma Abordagem Inovadora para a Mudança Comportamental na Cirurgia Digestiva
Introdução
Na prática cirúrgica, especialmente na cirurgia digestiva, a relação médico-paciente vai muito além do ato operatório. Ela envolve a promoção da saúde, a prevenção de complicações e a adesão a tratamentos, elementos cruciais para o sucesso terapêutico. O aconselhamento, portanto, é uma ferramenta essencial que permite aos profissionais de saúde atuar de forma integral, abordando não apenas a doença, mas o indivíduo como um todo. Nesse contexto, o Método PANPA surge como uma metodologia estruturada e eficaz para o aconselhamento na prática clínica, oferecendo uma abordagem sistemática para incentivar mudanças comportamentais que impactam diretamente os resultados cirúrgicos e a qualidade de vida do paciente.
Desenvolvimento
O aconselhamento em saúde é uma prática que se fundamenta em princípios de comunicação empática, escuta ativa e respeito às preferências e valores do paciente. No Brasil, onde as doenças do aparelho digestivo representam uma significativa carga para o sistema de saúde, com mais de 250.000 internações anuais relacionadas a condições como câncer de estômago e cirrose hepática, a necessidade de um aconselhamento eficaz é ainda mais evidente.
A “Metodologia 5 As” (Assess, Advise, Agree, Assist, Arrange) é amplamente reconhecida nos Estados Unidos como um modelo de aconselhamento em saúde. No entanto, sua adaptação para o contexto brasileiro, conhecida como Método PANPA (Perguntar, Aconselhar, Negociar, Preparar, Acompanhar), desenvolvida por Khouri et al., oferece uma abordagem mais contextualizada às realidades locais. Esta metodologia visa não apenas a prevenção de doenças, mas também a promoção de comportamentos saudáveis através de uma interação colaborativa entre o médico e o paciente.
Aplicação na Cirurgia Digestiva
No campo da cirurgia digestiva, onde os pacientes frequentemente enfrentam condições graves e complexas, como câncer de cólon, úlceras gástricas ou doenças inflamatórias intestinais, o Método PANPA pode ser aplicado em várias etapas do atendimento clínico:
- Perguntar: A coleta de dados detalhada é fundamental para entender as necessidades e motivações do paciente. Questionários validados e perguntas abertas permitem uma avaliação holística, considerando fatores como hábitos alimentares, consumo de álcool, tabagismo e nível de atividade física.
- Aconselhar: Com base nos dados coletados, o cirurgião digestivo deve fornecer informações claras e baseadas em evidências sobre a importância de comportamentos saudáveis. Por exemplo, em pacientes com obesidade mórbida, o aconselhamento sobre a mudança alimentar e a prática regular de exercícios é crucial para a preparação para a cirurgia bariátrica.
- Negociar: Estabelecer metas realistas e alcançáveis, utilizando critérios SMART (Specific, Measurable, Attainable, Relevant, Time-bound), é essencial para garantir que o paciente esteja comprometido com o plano de tratamento. Na cirurgia digestiva, isso pode incluir metas como a perda de peso pré-operatória ou a cessação do tabagismo antes de um procedimento.
- Preparar: Durante esta fase, o cirurgião deve trabalhar com o paciente para desenvolver estratégias que facilitem a adoção de novos comportamentos. Isso pode incluir a indicação de materiais educativos sobre nutrição pós-operatória ou a recomendação de apoio psicológico para lidar com a ansiedade pré-operatória.
- Acompanhar: A mudança comportamental é um processo contínuo. O acompanhamento regular, seja por meio de consultas presenciais ou telemedicina, é crucial para monitorar o progresso do paciente e fazer ajustes no plano de ação conforme necessário.
Pontos-Chave
- Empatia e Escuta Ativa: São fundamentais para compreender o contexto de vida do paciente e suas motivações.
- Metodologia Estruturada: O Método PANPA oferece uma abordagem sistemática para o aconselhamento, aumentando a probabilidade de sucesso nas mudanças comportamentais.
- Apoio Continuado: O acompanhamento a longo prazo é vital para garantir que as mudanças sejam sustentáveis e para prevenir recaídas.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A aplicação do Método PANPA na cirurgia digestiva não apenas promove uma melhor adesão ao tratamento e otimiza os resultados cirúrgicos, mas também fortalece a relação de confiança entre o cirurgião e o paciente. Ao abordar o paciente de forma integral, considerando seus aspectos biopsicossociais, o cirurgião não só melhora a eficácia do tratamento, mas também contribui para o bem-estar geral do indivíduo. Como disse Sir William Osler, um dos pioneiros da medicina moderna: “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” Essa citação reflete a essência do Método PANPA, que coloca o paciente no centro do processo terapêutico, valorizando suas necessidades, preferências e contextos de vida.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #MétodoPANPA #AconselhamentoEmSaúde #PromoçãoDaSaúde #EducaçãoMédica
Relação Médico-Paciente
Como a Conexão Humana Influencia o Sucesso Operatório.
Introdução
A relação médico-paciente é um dos pilares centrais da medicina, especialmente em áreas complexas como a cirurgia do aparelho digestivo. Embora o foco principal de um cirurgião seja a resolução técnica das patologias, a qualidade da interação com o paciente pode influenciar diretamente os resultados clínicos e a satisfação geral do tratamento. Este artigo examina como a construção de um vínculo eficaz e empático entre médico e paciente pode impactar positivamente o sucesso cirúrgico, com base em modelos consagrados de interação médica e evidências contemporâneas da prática cirúrgica.
Desenvolvimento
Desde os tempos antigos, a medicina tem sido guiada por princípios éticos e humanísticos que transcendem o mero conhecimento técnico. Hipócrates, considerado o pai da medicina, já afirmava a importância de cuidar do paciente como um todo, e não apenas da doença. No contexto atual, essa visão se mantém viva, especialmente na cirurgia digestiva, onde procedimentos muitas vezes invasivos e com risco elevado demandam uma abordagem que considere o bem-estar físico e emocional do paciente.
Estudos indicam que uma comunicação aberta e empática pode reduzir a ansiedade pré-operatória em até 30%, melhorar a adesão ao tratamento e diminuir o tempo de recuperação. No Brasil, onde o número de cirurgias digestivas cresce a cada ano, com mais de 150.000 procedimentos realizados anualmente, a habilidade do cirurgião em estabelecer uma relação de confiança com o paciente se torna ainda mais crucial. A adoção de modelos de interação, como a participação mútua descrita por Szasz e Hollender, onde o paciente é encorajado a participar ativamente das decisões médicas, tem se mostrado eficaz em promover melhores resultados.
Modelo de Consulta do Cirurgião Digestivo
O modelo de consulta ideal para o cirurgião digestivo deve ser estruturado de forma a estabelecer uma comunicação clara e empática desde o primeiro contato. Isso inclui:
- Identificação e Apresentação: O cirurgião deve se apresentar claramente, informando seu nome e função, criando um ambiente de confiança desde o início.
- Cumprimento e Ligação Inicial: Cumprimentar o paciente adequadamente e estabelecer uma boa ligação, indo além das questões médicas.
- Questionamento e Exploração: Perguntar sobre os motivos da consulta e explorar tanto os fatores físicos quanto psicossociais que influenciam a condição do paciente.
- Explanação e Orientação: Explicar as razões para os procedimentos diagnósticos e terapêuticos, garantindo que o paciente compreenda todas as etapas do tratamento.
- Encerramento e Reavaliação: Ao final da consulta, verificar se há algo mais que o paciente deseja discutir e revisar os próximos passos.
Valores e Princípios da Relação Médico-Paciente
Na relação médico-paciente, especialmente no contexto cirúrgico, certos valores e princípios são fundamentais:
- Sigilo e Privacidade: A confidencialidade das informações deve ser mantida em todas as circunstâncias, salvo em casos que envolvam um bem maior.
- Respeito ao Pudor: Durante exames e procedimentos, o respeito ao paciente deve ser rigorosamente observado, assegurando conforto e dignidade.
- Justiça e Equidade: O tratamento deve ser justo e equitativo, sem discriminação, com base em normas que garantam uma distribuição apropriada de recursos e atenção.
- Beneficência e Não Maleficência: A conduta do médico deve sempre visar o benefício do paciente, evitando causar danos intencionais.
- Autonomia: Respeitar a autonomia do paciente é crucial, promovendo um diálogo aberto onde o paciente se sinta capaz de tomar decisões informadas sobre seu tratamento.
Componentes da Qualidade na Relação Médico-Paciente
A qualidade da relação médico-paciente é composta por diversos elementos que podem melhorar a interação e os resultados clínicos:
- Empatia: Reduzir a distância entre médico e paciente, tratando-o pelo nome e reconhecendo suas necessidades e desafios.
- Interesse Genuíno: Mostrar interesse genuíno pela condição e bem-estar do paciente, investindo tempo suficiente para ouvi-lo e orientá-lo.
- Tempo de Qualidade: Dedicar o tempo necessário ao paciente, sem apressar a consulta, e proporcionando informações claras e detalhadas.
- Escuta Ativa: Permitir que o paciente fale livremente nos primeiros minutos de consulta, demonstrando que suas preocupações são valorizadas e compreendidas.
- Orientação e Esclarecimento: Garantir que o paciente entenda todos os aspectos de sua condição e tratamento, oferecendo uma visão clara e um plano de ação definido.
Conclusão
A prática da cirurgia digestiva não se limita à sala de operação; ela começa muito antes, na construção de uma relação de confiança entre médico e paciente. Ao adotar uma abordagem centrada no paciente, o cirurgião não apenas melhora os resultados clínicos, mas também fortalece o vínculo humano que é a base da medicina. Assim, a habilidade técnica deve ser sempre acompanhada pela capacidade de escuta e empatia, elementos que, juntos, podem transformar o processo cirúrgico em uma experiência mais positiva para ambos os lados.
Como afirmou Sir William Osler, um dos fundadores da medicina moderna: “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#MedicinaCirúrgica #RelaçãoMédicoPaciente #CirurgiaDigestiva #EducaçãoMédica #SaúdeeBemEstar
Cuidados Paliativos na Cirurgia do Aparelho Digestivo
Integração Essencial para a Prática Cirúrgica Contemporânea
Introdução
Os cuidados paliativos (CP) desempenham um papel vital na medicina contemporânea, particularmente em pacientes com doenças graves do aparelho digestivo. Tradicionalmente associados ao cuidado de pacientes em fase terminal, os CP evoluíram para uma abordagem mais ampla e integrada, voltada para o alívio do sofrimento e a melhoria da qualidade de vida, independentemente do estágio da doença. Este artigo tem como objetivo esclarecer a importância dos CP na cirurgia digestiva, explorando como essa prática pode ser incorporada ao manejo clínico de forma eficaz e humanizada.
Desenvolvimento
Até o início do século XXI, os CP eram erroneamente percebidos como sinônimo de cuidados exclusivamente para pacientes em fase terminal. Essa visão dicotômica, em que o paciente “virava” um caso de CP apenas ao se aproximar da morte, tem sido progressivamente superada. Em 2002, a Organização Mundial da Saúde (OMS) redefiniu os CP como uma abordagem para o alívio do sofrimento em pacientes e suas famílias diante de doenças que ameaçam a vida, independentemente do estágio da doença. Essa mudança de paradigma promoveu uma integração entre tratamentos curativos e paliativos, destacando que os CP são uma competência essencial para todos os profissionais de saúde.
No contexto da cirurgia do aparelho digestivo, essa integração se torna ainda mais crucial. Pacientes com câncer gastrointestinal, por exemplo, frequentemente enfrentam desafios físicos e emocionais que vão além do tratamento cirúrgico. A aplicação dos princípios dos CP permite aos cirurgiões digestivos oferecer um cuidado mais holístico, abordando não apenas a doença, mas também o impacto dela na vida do paciente e de sua família.
Aplicação na Cirurgia Digestiva
A aplicação dos cuidados paliativos na cirurgia digestiva envolve várias etapas críticas. Desde o diagnóstico inicial, o cirurgião deve incorporar uma abordagem paliativa que englobe o controle eficaz dos sintomas, a comunicação clara sobre prognóstico e a definição conjunta dos objetivos de cuidado.
- Controle de Sintomas: Dor, náuseas, fadiga e outros sintomas comuns em pacientes com doenças digestivas avançadas devem ser avaliados e tratados de forma proativa. Técnicas como analgesia com opioides, tratamentos adjuvantes para dores neuropáticas e intervenções específicas, como a radioterapia para metástases ósseas, são essenciais para o manejo adequado desses pacientes.
- Prognóstico: A incerteza no prognóstico é um desafio, especialmente em pacientes graves. No entanto, essa incerteza pode ser abordada de maneira estruturada, usando escalas padronizadas e estimativas probabilísticas, que ajudam a guiar as decisões de tratamento.
- Comunicação de Objetivos de Cuidado: Discutir e definir os objetivos de cuidado é uma etapa fundamental. Para muitos pacientes com doenças do aparelho digestivo, as decisões sobre intervenções cirúrgicas ou a limitação de tratamentos invasivos devem ser alinhadas com seus valores e preferências pessoais.

Pontos-Chave para o Cirurgião Digestivo
- Integração Precoce dos CP: Iniciar os cuidados paliativos desde o diagnóstico de uma doença grave melhora a qualidade de vida do paciente e facilita a tomada de decisões.
- Controle Adequado da Dor: Avaliar sistematicamente a dor e utilizar uma combinação de analgesia preemptiva e de resgate é crucial para o conforto do paciente.
- Comunicação Clara e Empática: Explicar o prognóstico e as opções de tratamento de forma clara, respeitando as emoções e expectativas dos pacientes e suas famílias.
- Planejamento de Cuidados: Definir objetivos de cuidado com base nas preferências do paciente, seja priorizando o conforto ou optando por tratamentos agressivos.
- Uso Adequado de Opioides: Conhecimento sobre a meia-vida, equipotência e efeitos colaterais dos opioides é essencial para evitar complicações.
- Abordagem Multidisciplinar: Trabalhar em conjunto com outros especialistas, como oncologistas e anestesiologistas, para oferecer um cuidado integrado.
- Avaliação Funcional: Monitorar continuamente a funcionalidade do paciente para ajustar as intervenções conforme necessário.
- Gestão de Sintomas Não-Dolorosos: Controle de náuseas, fadiga e dispneia são tão importantes quanto o controle da dor.
- Evitar Tratamentos Fúteis: Identificar quando as intervenções cirúrgicas ou outras medidas invasivas não trarão benefícios significativos ao paciente.
- Educação Continuada: Manter-se atualizado sobre as melhores práticas em cuidados paliativos para garantir que os pacientes recebam o melhor cuidado possível.
Conclusão
A integração dos cuidados paliativos na prática cirúrgica digestiva não apenas melhora a qualidade de vida dos pacientes, mas também promove uma prática médica mais ética, centrada no paciente e em sua dignidade. O cirurgião digestivo que domina essas competências está melhor equipado para enfrentar os desafios clínicos e emocionais de seus pacientes, contribuindo para um cuidado mais humano e eficaz. Como disse William Osler, um dos pais da medicina moderna:
“A boa medicina é a que cuida do paciente como um todo, e não apenas da doença.”
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CuidadosPaliativos #CirurgiaDigestiva #MedicinaPaliativa #EducaçãoMédica #QualidadeDeVida
Cicatrização de Feridas
A cicatrização de feridas operatórias é um processo fundamental para o sucesso de qualquer intervenção cirúrgica, especialmente nas complexas cirurgias do aparelho digestivo. Este post visa explorar detalhadamente o processo de cicatrização, destacando os mecanismos biológicos envolvidos e sua aplicação prática na cirurgia digestiva, com enfoque em fornecer uma visão compreensiva para estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
A Complexidade da Cicatrização em Cirurgias Digestivas
A cicatrização de uma ferida operatória é um fenômeno biológico essencial que visa restaurar a integridade tecidual após uma intervenção cirúrgica. Em cirurgias do aparelho digestivo, onde o risco de complicações infecciosas é elevado, entender as fases e os fatores que influenciam a cicatrização é crucial para otimizar os resultados e prevenir complicações como deiscências, infecções e formação de fístulas.
Fisiologia e Fases da Cicatrização Operatória
Hemostasia e Fase Inflamatória
Imediatamente após o trauma cirúrgico, ocorre a fase de hemostasia, na qual a vasoconstrição e a ativação da cascata de coagulação interrompem o sangramento. Esse processo não só previne a hemorragia como também forma uma matriz de fibrina, que serve como um arcabouço inicial para a cicatrização. A fase inflamatória segue imediatamente, durando entre 1 a 4 dias. Durante esse período, células inflamatórias como neutrófilos e macrófagos migram para o local da ferida, desempenhando um papel vital na fagocitose de detritos celulares e na liberação de citocinas que promovem a reparação tecidual.
Fase Proliferativa e Angiogênese
A fase proliferativa, que inicia após o terceiro ou quarto dia, envolve a migração e proliferação de fibroblastos, células mesenquimais e a formação de novos vasos sanguíneos—a angiogênese. Esses processos são críticos para a formação do tecido de granulação, que preenche a ferida e estabelece uma nova matriz extracelular rica em colágeno.
Remodelamento e Maturação
Finalmente, a fase de remodelamento, que pode se estender por meses, é caracterizada pela deposição de colágeno e reorganização da matriz extracelular. Nesta fase, o tecido cicatricial se fortalece, atingindo cerca de 80% da resistência do tecido original após seis meses.
Aplicação na Cirurgia Digestiva: Desafios e Abordagens
Na cirurgia do aparelho digestivo, as feridas operatórias apresentam desafios específicos devido ao alto risco de contaminação e infecção, especialmente em anastomoses intestinais. Segundo estatísticas do Ministério da Saúde, as infecções de sítio cirúrgico (ISC) estão entre as principais complicações pós-operatórias no Brasil, com uma incidência de aproximadamente 11,7% em cirurgias abdominais.
Fechamento Primário e Secundário: Escolhas Estratégicas
O fechamento primário, onde as margens da ferida são aproximadas diretamente, é ideal em cirurgias limpas, com baixo risco de infecção. No entanto, em situações onde há contaminação, como em ressecções intestinais com peritonite, o fechamento secundário, onde a ferida é deixada aberta para cicatrizar por segunda intenção, pode ser mais seguro.
Uso de Tecnologias Avançadas
O uso de produtos como hidrocolóides, hidrofibras e até mesmo fatores de crescimento recombinantes tem sido explorado para melhorar a cicatrização de feridas complexas em cirurgias digestivas. Estudos recentes indicam que esses tratamentos podem acelerar a formação de tecido de granulação e reduzir a taxa de complicações infecciosas, especialmente em pacientes com comorbidades como diabetes.
Pontos-Chave
- A cicatrização de feridas operatórias segue um processo ordenado de hemostasia, inflamação, proliferação e remodelamento.
- Nas cirurgias digestivas, o manejo adequado da cicatrização é crucial para prevenir complicações como infecções e deiscências.
- O fechamento primário é preferível em condições limpas, enquanto o fechamento secundário é recomendado em casos de alta contaminação.
- Avanços tecnológicos, como o uso de fatores de crescimento e novos materiais de curativos, oferecem promissoras abordagens para melhorar a cicatrização de feridas em cirurgias digestivas.
Aplicações na Prática Cirúrgica
A compreensão detalhada dos processos de cicatrização e a aplicação adequada das técnicas de fechamento e tratamento de feridas são essenciais para o sucesso em cirurgias do aparelho digestivo. Cirurgiões devem estar atentos às novas tecnologias e abordagens para otimizar os resultados pós-operatórios e reduzir as taxas de complicações, garantindo, assim, uma recuperação mais rápida e eficaz para seus pacientes.
Como bem disse o cirurgião pioneiro Joseph Lister: “A cicatrização das feridas é o teste do cirurgião.” A excelência no cuidado pós-operatório é tão vital quanto a habilidade na sala de cirurgia.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CicatrizaçãoCirúrgica #CirurgiaDigestiva #CuidadosPósOperatórios #CicatrizaçãoDeFeridas #MedicinaCirúrgica
Infecções de Sítio Cirúrgico: Um Desafio Crítico na Cirurgia Digestiva e Como Combatê-las
Introdução
As infecções de sítio cirúrgico (ISC) representam um dos maiores desafios enfrentados por cirurgiões e equipes de saúde em todo o mundo. Elas não só aumentam a morbidade e mortalidade entre os pacientes, mas também geram um significativo impacto econômico, prolongando o tempo de internação e aumentando os custos hospitalares. No Brasil, estima-se que a taxa de ISC possa atingir até 19% em cirurgias do aparelho digestivo, dependendo do tipo de procedimento realizado. Neste contexto, compreender as causas, riscos e, principalmente, as estratégias de prevenção das ISCs é fundamental para a prática cirúrgica segura e eficaz.
Desenvolvimento
As ISCs são infecções que ocorrem no local da incisão cirúrgica ou nos tecidos profundos, onde a cirurgia foi realizada, dentro de 30 dias após a operação, ou até mais tempo caso um dispositivo protético tenha sido implantado. Esses tipos de infecções representam cerca de 20% a 25% de todas as infecções associadas aos cuidados de saúde e são especialmente prevalentes em pacientes submetidos a procedimentos no aparelho digestivo, devido à natureza das cirurgias e à potencial contaminação do campo operatório.
Diversos fatores influenciam o risco de desenvolvimento de uma ISC, divididos em variáveis endógenas (relacionadas ao paciente) e exógenas (relacionadas ao procedimento). Entre os fatores do paciente, destacam-se a idade avançada, má nutrição, obesidade, diabetes e tabagismo. Já os fatores relacionados ao procedimento incluem a classificação da cirurgia (por exemplo, cirurgias contaminadas ou sujas), a duração da operação e o cuidado pós-operatório da incisão. A falha na administração correta de profilaxia antibiótica perioperatória também é um fator de risco independente, com estudos mostrando que a administração inadequada pode aumentar em até 6 vezes a taxa de infecções.
Aplicação na Cirurgia Digestiva
No campo da cirurgia digestiva, as ISCs são particularmente prevalentes e exigem uma abordagem meticulosa para prevenção. Cirurgias que envolvem o trato gastrointestinal, como as ressecções de intestino e procedimentos de esofagectomia, apresentam um risco aumentado devido à possibilidade de vazamento de conteúdo intestinal e contaminação do campo cirúrgico.
A profilaxia antibiótica adequada, associada à técnicas assépticas rigorosas, desempenha um papel crucial na prevenção das ISCs. A escolha do antibiótico correto, administrado no momento ideal, geralmente dentro de uma hora antes da incisão, é fundamental para reduzir a carga bacteriana no sítio cirúrgico. Além disso, a manutenção da normotermia durante a cirurgia, o controle glicêmico rigoroso em pacientes diabéticos e o manejo adequado de drenagens e curativos são práticas essenciais que devem ser implementadas.
Pontos-Chave
- Prevalência e Impacto: As ISCs são responsáveis por uma parte significativa das complicações pós-operatórias, especialmente em cirurgias digestivas.
- Fatores de Risco: Incluem características do paciente e aspectos do procedimento cirúrgico.
- Prevenção: A profilaxia antibiótica e o manejo adequado durante o perioperatório são cruciais para a prevenção.
- Abordagem Multidisciplinar: A prevenção eficaz exige a colaboração de toda a equipe cirúrgica, incluindo enfermeiros, anestesistas e farmacêuticos.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
Para o cirurgião digestivo, a prevenção de ISCs deve ser uma prioridade durante todo o processo cirúrgico. A implementação de protocolos baseados em evidências, juntamente com a educação contínua da equipe de saúde, é vital para reduzir a incidência dessas infecções. Além disso, a abordagem individualizada ao paciente, levando em consideração os fatores de risco específicos e as características do procedimento, pode otimizar os resultados e melhorar a segurança do paciente.
A cirurgia é uma arte e uma ciência que exige precisão e cuidado meticuloso. Como disse Hipócrates, “Primum non nocere” — Primeiro, não causar dano. Em nenhum outro lugar essa máxima é mais relevante do que na prevenção de infecções de sítio cirúrgico.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
SurgicalSiteInfection #InfeccaoCirurgica #CirurgiaDigestiva #ControleDeInfecções #ProfilaxiaAntibiotica
Pacientes de Alto Risco em Cirurgia Digestiva: Otimizando os Resultados
As intervenções cirúrgicas, especialmente no campo da cirurgia digestiva, estão repletas de riscos, particularmente para pacientes de alto risco. Esses indivíduos frequentemente apresentam múltiplas comorbidades e exigem uma gestão perioperatória cuidadosa para minimizar complicações e melhorar os resultados. Este artigo explora as complexidades da gestão de pacientes cirúrgicos de alto risco no contexto da cirurgia digestiva, fornecendo insights cruciais para estudantes de medicina, residentes em cirurgia e pós-graduandos especializados nesta área.
Introdução
O cenário cirúrgico está evoluindo, com um número crescente de pacientes apresentando-se para procedimentos eletivos e de emergência, apesar de comorbidades significativas. No Brasil, assim como em muitos países, a população cirúrgica de alto risco—composta por pacientes idosos e aqueles com doenças crônicas—constitui uma parte significativa dos casos cirúrgicos. Aproximadamente 10-15% dos procedimentos cirúrgicos hospitalares se enquadram nesta categoria de alto risco, representando mais de 80% das mortes cirúrgicas. Compreender as sutilezas do cuidado perioperatório para esses pacientes é essencial para melhorar os resultados cirúrgicos e reduzir as taxas de mortalidade.
O Perfil do Paciente de Alto Risco
Pacientes cirúrgicos de alto risco frequentemente exibem uma combinação das seguintes características:
- Idade Avançada: A idade é um fator crítico, pois as reservas fisiológicas diminuem com os anos.
- Condições Comórbidas: Condições como doença cardíaca isquêmica, doença pulmonar obstrutiva crônica (DPOC) e diabetes elevam significativamente o risco cirúrgico.
- Procedimentos de Emergência: Muitos pacientes de alto risco necessitam de intervenções cirúrgicas urgentes, deixando pouco tempo para otimização pré-operatória.
No Brasil, a crescente prevalência de doenças crônicas entre a população idosa exige uma abordagem proativa ao cuidado perioperatório, particularmente na cirurgia digestiva, onde as complicações podem ser severas.
Pontos Chave na Gestão Perioperatória
- Avaliação Pré-operatória
Uma avaliação pré-operatória abrangente é vital para identificar pacientes de alto risco e otimizar suas condições médicas. Esta avaliação deve incluir:
- Avaliação Cardiovascular: Utilizar as diretrizes do American College of Cardiology/American Heart Association (ACC/AHA) para estratificar o risco cardíaco com base em equivalentes metabólicos (METs).
- Estado Nutricional: Avaliar e tratar a desnutrição, comum em pacientes que necessitam de cirurgia digestiva.
Durante a cirurgia, vários fatores devem ser meticulosamente geridos:
- Gestão de Fluidos: A estimativa precisa das necessidades de fluidos é crucial para prevenir desidratação e sobrecarga de fluidos, especialmente em cirurgias envolvendo resseção intestinal.
- Controle da Dor: Analgesia eficaz é essencial para promover mobilidade e prevenir complicações respiratórias pós-cirúrgicas.
- Técnicas de Cirurgia Minimamente Invasivas : Diminuem a resposta metábolica ao trauma cirúrgico.
A gestão pós-operatória de pacientes de alto risco inclui:
- Monitoramento em Unidade de Terapia Intensiva: Muitos pacientes de alto risco requerem monitoramento intensivo em uma unidade de terapia intensiva para garantir a detecção precoce de complicações cardiovasculares e pulmonares.
- Suporte Nutricional: A reintrodução precoce da nutrição, quando viável, é essencial para a recuperação.
Conclusão
A gestão perioperatória de pacientes de alto risco em cirurgia digestiva é um desafio multifacetado que exige uma abordagem sistemática. Ao integrar avaliações pré-operatórias minuciosas, gestão intraoperatória vigilante e cuidados pós-operatórios abrangentes, as equipes cirúrgicas podem reduzir significativamente o risco de complicações e melhorar os resultados dos pacientes. No Brasil, onde a carga de doenças crônicas está aumentando, é imperativo que os profissionais cirúrgicos estejam equipados com o conhecimento e as habilidades para navegar nas complexidades dos pacientes cirúrgicos de alto risco.
Como afirmou sabiamente Sir William Osler:
“O bom médico trata a doença; o grande médico trata o paciente que tem a doença.”
Esta filosofia destaca a importância de uma abordagem holística na gestão de pacientes cirúrgicos de alto risco.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #PacientesDeAltoRisco #CuidadosPerioperatórios #GestãoCirúrgica #EducaçãoMédica
Manejo Perioperatório da Icterícia: Uma Perspectiva Cirúrgica
A icterícia, uma condição caracterizada pelo amarelamento da pele e da esclera devido à hiperbilirrubinemia, é uma preocupação perioperatória crítica na cirurgia digestiva. Gerenciar a icterícia efetivamente no período perioperatório é essencial para minimizar complicações e melhorar os resultados dos pacientes. Este artigo aprofunda-se nas complexidades do manejo perioperatório da icterícia, particularmente no contexto da cirurgia digestiva, e destaca estratégias-chave para equipes cirúrgicas.
Introdução
A icterícia em pacientes cirúrgicos é frequentemente uma manifestação de doença hepática ou biliar subjacente, como icterícia obstrutiva devido a cálculos biliares ou neoplasias. No Brasil, as doenças do trato biliar são prevalentes, com cálculos biliares afetando aproximadamente 10-15% da população adulta, tornando-se uma causa comum de icterícia. O manejo da icterícia no período perioperatório é crucial, pois pode impactar significativamente o risco de complicações cirúrgicas, incluindo coagulopatia, disfunção renal e sepse.
Ciclo Enterohepático da Bile

O ciclo enterohepático da bile é um processo fisiológico fundamental que ilustra a complexa interação entre o fígado e o sistema digestivo. Este ciclo inicia-se com a produção de bile pelos hepatócitos, uma secreção crucial que contém ácidos biliares, bilirrubina, colesterol e eletrólitos. A bile, armazenada temporariamente na vesícula biliar, é liberada no duodeno em resposta à ingestão de alimentos, onde desempenha um papel vital na digestão e absorção de lipídios. Após cumprir sua função digestiva, aproximadamente 95% dos sais biliares são reabsorvidos no íleo terminal, retornando ao fígado via circulação portal, completando assim o ciclo enterohepático.
A bilirrubina, um componente-chave da bile, existe em duas formas principais: não conjugada (indireta) e conjugada (direta). A bilirrubina não conjugada, lipossolúvel, é produzida pela degradação da hemoglobina e transportada no sangue ligada à albumina. No fígado, ela é conjugada com ácido glicurônico, tornando-se hidrossolúvel e, portanto, passível de excreção biliar. Em condições normais, os níveis séricos de bilirrubina total variam entre 0,3 e 1,0 mg/dL, com a fração direta não excedendo 0,3 mg/dL. Alterações nesse equilíbrio podem resultar em icterícia, uma manifestação clínica caracterizada pela coloração amarelada da pele e mucosas.
A etiologia da icterícia é diversa e sua apresentação varia conforme a causa subjacente. Na hepatite viral, observa-se um aumento tanto da bilirrubina direta quanto da indireta, acompanhado de elevação das enzimas hepáticas, refletindo o dano hepatocelular. Em contraste, a hemólise resulta predominantemente em elevação da bilirrubina indireta, sem alterações significativas nas enzimas hepáticas, mas frequentemente associada a anemia e reticulocitose. Por outro lado, a obstrução do ducto hepático por tumor caracteriza-se por um aumento marcante da bilirrubina direta, elevação da fosfatase alcalina e GGT, além de possível dilatação das vias biliares detectável por exames de imagem. Cada um desses cenários demanda uma abordagem diagnóstica e terapêutica específica, ressaltando a importância do entendimento detalhado do metabolismo da bilirrubina e do funcionamento do sistema hepatobiliar para o manejo adequado das doenças que afetam esse sistema.
Semiologia Cirúrgica
Na avaliação pré-operatória de um paciente ictérico que será submetido a uma cirurgia hepatobiliar, a semiologia desempenha um papel essencial para identificar estigmas clínicos, sinais de hipertensão porta, parâmetros de desnutrição e sinais específicos de tumores periampulares. Uma análise minuciosa desses elementos, aliada ao uso das escalas de Child-Pugh e MELD, é fundamental para planejar a intervenção cirúrgica e prever riscos perioperatórios.
Estigmas Clínicos de Cirrose
A cirrose hepática é frequentemente associada a uma série de manifestações clínicas, conhecidas como estigmas de cirrose. Entre eles, telangiectasias ou “aranhas vasculares” são pequenas dilatações dos vasos sanguíneos visíveis na pele, geralmente no tronco e face. O eritema palmar, caracterizado por uma vermelhidão nas palmas das mãos, é outro sinal indicativo. Nos homens, é comum observar ginecomastia (aumento das mamas) e atrofia testicular (diminuição do tamanho dos testículos), frequentemente acompanhados pela perda de pelos corporais. A icterícia, amarelamento da pele e das mucosas, resulta da disfunção hepática no metabolismo da bilirrubina. Outros sinais importantes incluem a contratura de Dupuytren, que causa o espessamento e encurtamento da fáscia palmar, e as unhas de Terry, que apresentam uma coloração esbranquiçada com uma borda distal avermelhada.
- Courvoisier: Vesícula biliar palpável e icterícia – Carcinoma da cabeça do pâncreas.
- Cullen: Equimose peri-umbilical – Pancreatite hemorrágica ou gravidez ectópica.
- Grey Turner: Equimose no flanco – Pancreatite hemorrágica.
- Rovsing: Dor à extensão da articulação do quadril (devido à irritação do psoas) – Apendicite retrocecal.
- Murphy: Sensibilidade no quadrante superior direito exacerbada pela inspiração – Colecistite aguda.
- Virchow: Linfonodo palpável na fossa supraclavicular esquerda – Carcinoma esofagogástrico.
- Tríade de Charcot: Dor abdominal no quadrante superior direito, icterícia e febre com calafrios – Colangite.
- Pêntade de Reynolds: Tríade de Charcot (dor abdominal no quadrante superior direito, icterícia e febre com calafrios) acrescida de hipotensão e confusão mental – Colangite supurativa aguda.
- Sinal de Blumer: Massa palpável no fundo de saco de Douglas – Carcinomatose peritoneal.
- Sinal de Kehr: Dor referida no ombro esquerdo ao aplicar pressão no quadrante superior esquerdo – Irritação diafragmática, como em ruptura esplênica.
- Sinal de Boas: Hipersensibilidade à palpação no ângulo costovertebral direito – Colecistite aguda.
- Sinal de Trousseau: Episódios recorrentes de tromboflebite migratória – Associado a adenocarcinoma pancreático.
- Sinal de Fox: Descoloração azulada da região inguinal – Pancreatite hemorrágica.
- Sinal de Lasegue Hepático: Dor à compressão no hipocôndrio direito durante a inspiração profunda – Distensão da cápsula hepática.
- Sinal de Traube Positivo: Presença de som maciço à percussão na região de Traube (localizada entre a margem inferior esquerda do tórax e a linha axilar anterior) – Indicativo de esplenomegalia, que pode ocorrer em doenças hepatobiliares, como hipertensão portal.
Esses sinais são importantes para o diagnóstico clínico da ascite e ajudam a distinguir a presença de líquido na cavidade abdominal de outras possíveis causas de aumento do volume abdominal, como distensão gasosa ou massas tumorais:
- Abdome Globoso: O abdome assume uma forma globosa, com aumento do volume abdominal, especialmente em pacientes deitados em decúbito dorsal.
- Sinal do Piparote: Com uma das mãos posicionada em um dos lados do abdome, aplica-se um pequeno golpe com a outra mão no lado oposto. Se houver ascite, o líquido no interior da cavidade abdominal transmite o golpe, e a sensação é sentida na mão oposta.
- Macicez Móvel: Ao percutir o abdome, o som será maciço nas regiões onde o líquido se acumula. Quando o paciente muda de posição (por exemplo, deitado de lado), a área de macicez se desloca, indicando a presença de líquido livre na cavidade peritoneal.
- Sinal de Sucussão: Ao agitar suavemente o abdome do paciente, se houver líquido ascítico em grande quantidade, é possível ouvir o som de agitação do líquido (com o auxílio de um estetoscópio).
- Sinal de Oleada: Durante a palpação, a sensação de “oleada” ou “flutuação” pode ser sentida, indicando a presença de líquido sob a parede abdominal.
- Sinal de Fogueira: Na percussão do abdome, encontra-se uma área central de timpanismo (área onde o intestino flutua no líquido) cercada por áreas de macicez, que pode ser interpretada como um “fogo cercado por lenha”.
Sinais de Hipertensão Porta
A hipertensão porta, complicação comum em pacientes cirróticos, manifesta-se por uma série de sinais clínicos. A ascite, ou acúmulo de líquido na cavidade abdominal, é um dos sinais mais evidentes e frequentemente observado ao exame físico. A esplenomegalia, aumento do baço, também pode estar presente e é decorrente do aumento da pressão no sistema portal. A circulação colateral abdominal ou “cabeça de medusa” refere-se à visualização de veias dilatadas ao redor do umbigo, indicando desvio do fluxo sanguíneo devido à obstrução portal. As varizes esofágicas, detectadas pela endoscopia, e as hemorroidas são outros sinais que indicam hipertensão portal e representam riscos de complicações hemorrágicas graves.
Parâmetros Clínicos de Desnutrição
A desnutrição é um fator crítico que deve ser cuidadosamente avaliado em pacientes cirróticos, pois influencia diretamente o prognóstico cirúrgico. A perda de massa muscular, também conhecida como sarcopenia, é um dos principais indicadores de desnutrição. Associada a ela, a perda de gordura subcutânea e o edema por hipoalbuminemia (baixa albumina sérica) são sinais clínicos relevantes. Outros indicadores incluem queda de cabelos, unhas quebradiças e pele seca e descamativa. O cálculo do Índice de Massa Corporal (IMC) e a avaliação da força de preensão palmar complementam a análise nutricional, fornecendo dados objetivos para a avaliação do estado nutricional.
Sinais Semiológicos Relacionados aos Tumores Periampulares
No contexto dos tumores periampulares, a icterícia progressiva e indolor é um sinal de alerta precoce e significativo. O sinal de Courvoisier-Terrier, caracterizado pela presença de uma vesícula biliar palpável e indolor, é um achado importante que sugere obstrução biliar, frequentemente associada a neoplasias malignas. A perda de peso inexplicada é outro sintoma comum nesses pacientes, muitas vezes relacionada à natureza crônica da doença. Dor abdominal, geralmente em estágios mais avançados, prurido (devido à colestase) e febre (em casos de colangite associada) são outros sinais relevantes a serem investigados.
Escala de Child-Pugh
A escala de Child-Pugh é um sistema de pontuação utilizado para avaliar o prognóstico da cirrose hepática. Ela considera cinco parâmetros: bilirrubina total, albumina sérica, tempo de protrombina (ou INR), ascite e encefalopatia hepática. Cada parâmetro recebe uma pontuação de 1 a 3, resultando em uma classificação que varia de Child A (5-6 pontos) a Child C (10-15 pontos). Essa classificação é crucial para a avaliação da reserva funcional hepática e do risco cirúrgico.
- Child A (5-6 pontos): Pacientes com cirrose compensada, apresentando a menor morbimortalidade perioperatória. A mortalidade cirúrgica é geralmente inferior a 10%.
- Child B (7-9 pontos): Pacientes com cirrose descompensada moderada. A mortalidade perioperatória pode variar de 10% a 30%, dependendo da complexidade do procedimento cirúrgico e da presença de complicações associadas, como infecções ou sangramentos.
- Child C (10-15 pontos): Pacientes com cirrose descompensada grave. Esses pacientes têm a maior taxa de morbimortalidade perioperatória, que pode ultrapassar 50%, sendo que em muitos casos, a cirurgia só é indicada em situações de emergência ou quando não existem alternativas terapêuticas.
Escore MELD
O escore MELD (Model for End-Stage Liver Disease) é utilizado para avaliar a gravidade da doença hepática crônica, baseando-se em três parâmetros laboratoriais: bilirrubina total, creatinina sérica e INR. A pontuação varia de 6 a 40, com escores mais altos indicando uma maior gravidade da doença hepática e maior risco de mortalidade. A fórmula do MELD é complexa e leva em consideração os níveis de bilirrubina, creatinina e INR para fornecer uma avaliação precisa do estado do paciente.
- MELD < 9: Pacientes com escore MELD abaixo de 9 geralmente têm um risco relativamente baixo de morbimortalidade perioperatória.
- MELD 10-19: Pacientes com escore MELD nessa faixa apresentam um risco moderado a elevado de complicações, com uma mortalidade que pode variar de 10% a 25% dependendo do procedimento e do estado geral do paciente.
- MELD 20-29: Pacientes com MELD entre 20 e 29 têm um risco significativamente elevado de morbimortalidade perioperatória, frequentemente superior a 25%.
- MELD ≥ 30: Pacientes com MELD igual ou superior a 30 possuem um risco extremamente alto de mortalidade, que pode ultrapassar 50%, especialmente em cirurgias de grande porte.
Avaliação e Otimização Pré-operatória
O manejo perioperatório da icterícia começa com uma avaliação minuciosa do paciente. Isso inclui uma história detalhada, exame físico e testes laboratoriais direcionados para determinar a causa e a gravidade da icterícia. Testes de função hepática, incluindo bilirrubina sérica, fosfatase alcalina e transaminases, fornecem insights sobre o grau de disfunção hepática. Estudos de imagem, como ultrassonografia, tomografia computadorizada (TC) ou colangiopancreatografia por ressonância magnética (CPRM), são essenciais para identificar a causa subjacente, seja icterícia obstrutiva ou não obstrutiva. Em casos de icterícia obstrutiva, a drenagem biliar pré-operatória pode ser necessária para reduzir os níveis de bilirrubina, diminuindo assim o risco de complicações pós-operatórias. A colangiopancreatografia retrógrada endoscópica (CPRE) é frequentemente o procedimento de escolha para drenagem biliar em pacientes com icterícia obstrutiva devido a coledocolitíase ou malignidade.
Considerações Intraoperatórias
Durante a cirurgia, o manejo da icterícia requer uma abordagem multidisciplinar. Os anestesiologistas desempenham um papel vital na otimização do manejo de fluidos e na manutenção da estabilidade hemodinâmica, já que pacientes com icterícia são propensos à hipovolemia e desequilíbrios eletrolíticos. O estado de coagulação deve ser cuidadosamente monitorado, e qualquer coagulopatia corrigida pré ou intraoperatoriamente, pois pacientes com icterícia têm um risco aumentado de sangramento. A abordagem cirúrgica deve ser meticulosamente planejada, levando em conta a causa subjacente da icterícia. Por exemplo, em casos de icterícia obstrutiva maligna, a ressecção do tumor poderá ser necessária, enquanto em condições benignas como coledocolitíase, uma colecistectomia com exploração do ducto biliar pode ser realizada. Os cirurgiões devem estar preparados para gerenciar potenciais complicações, como vazamentos biliares, sangramentos por varizes e falência hepática pós operatória que podem ter consequências sérias em pacientes ictéricos.
Cuidados Pós-operatórios
O manejo pós-operatório de pacientes ictéricos concentra-se no monitoramento de complicações e no suporte à função hepática. O monitoramento próximo das enzimas hepáticas, níveis de bilirrubina e parâmetros de coagulação é essencial. A detecção precoce de complicações, como colangite, sepse ou disfunção renal, é crítica para intervenção oportuna. O suporte nutricional também é um componente-chave dos cuidados pós-operatórios. Pacientes com icterícia frequentemente têm status nutricional comprometido devido à má absorção ou anorexia. A alimentação enteral deve ser iniciada o mais cedo possível, com nutrição parenteral reservada para pacientes que não podem tolerar alimentação enteral.
Pontos-Chave
Avaliação Pré-operatória Abrangente: Avaliação minuciosa e otimização da função hepática e do estado de coagulação são essenciais para minimizar riscos perioperatórios em pacientes ictéricos.
Abordagem Multidisciplinar: O manejo efetivo de pacientes ictéricos requer colaboração entre cirurgiões, anestesiologistas e hepatologistas para atender às necessidades complexas desses pacientes.
Abordagem Cirúrgica Personalizada: A escolha da intervenção cirúrgica deve ser guiada pela causa subjacente da icterícia, com cuidadoso manejo intraoperatório para evitar complicações.
Vigilância Pós-operatória: Monitoramento contínuo e intervenção precoce para complicações são críticos para melhorar os resultados em pacientes ictéricos.
Conclusão
O manejo perioperatório da icterícia é um desafio complexo e multifacetado na cirurgia digestiva. Uma abordagem abrangente e multidisciplinar é crucial para otimizar os resultados dos pacientes. Ao compreender a fisiopatologia da icterícia, adaptar estratégias cirúrgicas às necessidades individuais dos pacientes e fornecer cuidados pós-operatórios vigilantes, os cirurgiões podem minimizar complicações e melhorar a recuperação. No Brasil, onde as doenças do trato biliar são comuns, os princípios do manejo perioperatório efetivo da icterícia são particularmente relevantes. Aderindo a essas diretrizes, as equipes cirúrgicas podem contribuir para melhorar os resultados dos pacientes e o avanço das práticas de cirurgia digestiva.
“Operar um paciente ictérico é como pilotar um avião através de uma tempestade; você deve estar preparado para turbulência a qualquer momento.” – Moshe Schein
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CuidadosPerioperatórios #ManejoDaIcterícia #CirurgiaDigestiva #EducaçãoCirúrgica #CirurgiaHepatobiliar
Semiologia Cirúrgica Abdominal: O Alicerce para uma Cirurgia Precisa
Sir William Osler, um dos mais influentes médicos do século XIX e XX, afirmou:
“Ouça o seu paciente, ele está lhe dizendo o diagnóstico”.
Esta frase resume a importância do exame clínico e da semiologia na prática médica, destacando que a atenção aos detalhes e à história do paciente muitas vezes fornece as pistas mais valiosas para o diagnóstico.
Introdução
A semiologia cirúrgica abdominal é a base fundamental para a prática cirúrgica de qualidade. No campo da cirurgia do aparelho digestivo, onde a precisão é essencial, a habilidade de interpretar corretamente os sinais e sintomas apresentados pelos pacientes é crucial. A semiologia não apenas orienta o diagnóstico, mas também desempenha um papel vital na definição da estratégia cirúrgica, na escolha das técnicas apropriadas e na antecipação de possíveis complicações. Compreender a semiologia abdominal é, portanto, um pré-requisito indispensável para qualquer cirurgião que aspire à excelência em sua prática.
Fisiopatologia da Dor Abdominal e Sua Diferenciação
A dor abdominal é um sintoma frequente na prática clínica e pode ser um desafio diagnóstico devido à sua etiologia multifatorial. A compreensão da fisiopatologia da dor abdominal é fundamental para sua correta avaliação. A dor pode ser visceral, somática ou referida, cada uma com características clínicas distintas.
- Dor Visceral: Geralmente causada pela distensão ou inflamação de órgãos internos, como intestinos ou estômago. Essa dor é frequentemente mal localizada e descrita como uma sensação de cólica ou pressão.
- Dor Somática: Origina-se da irritação do peritônio parietal ou da musculatura abdominal, é bem localizada e tende a ser descrita como uma dor aguda e constante. Exemplos incluem a dor causada por apendicite ou peritonite.
- Dor Referida: Ocorre quando a dor originada em um órgão é percebida em uma área distante do local de origem. Um exemplo clássico é a dor no ombro esquerdo associada a condições como pancreatite ou colecistite.
Mecanismo Fisiopatológico
As zonas de Head são áreas da pele onde a dor pode ser referida a partir de órgãos internos devido à convergência de fibras nervosas viscerais e somáticas nos mesmos segmentos da medula espinhal. Quando um órgão interno, como a vesícula biliar ou o apêndice, é inflamado ou irritado, as fibras nervosas viscerais transmitem sinais de dor para a medula espinhal. Essas fibras convergem com fibras somáticas no mesmo nível da medula espinhal. Como o cérebro não distingue perfeitamente entre a dor visceral e somática, ele pode interpretar a dor visceral como se estivesse vindo da pele ou músculos inervados pelos mesmos segmentos da medula espinhal.
Colecistite Aguda
Na colecistite aguda, que é a inflamação da vesícula biliar, a dor é inicialmente localizada no quadrante superior direito do abdome, refletindo a localização anatômica da vesícula biliar. No entanto, devido ao envolvimento do nervo frênico, que compartilha origem segmentar com a vesícula biliar, a dor pode ser referida para o ombro direito. Esse fenômeno ocorre porque o nervo frênico, que inerva o diafragma, também é derivado dos segmentos cervicais (C3-C5) da medula espinhal, os mesmos que inervam a pele sobre o ombro.
Apendicite Aguda
Na apendicite aguda, a dor inicial geralmente é referida para a região periumbilical. O apêndice é inervado por fibras viscerais provenientes do plexo celíaco, cujas fibras nervosas entram na medula espinhal ao nível de T10. Por causa dessa inervação, o cérebro inicialmente localiza a dor no umbigo, que também é inervado pelo mesmo nível segmentar (T10). À medida que a inflamação do apêndice progride e envolve o peritônio parietal, a dor torna-se localizada no quadrante inferior direito do abdome, o que reflete a irritação somática mais precisa do peritônio.
A correta diferenciação desses tipos de dor é essencial para o cirurgião, pois direciona a investigação diagnóstica e, em última análise, a abordagem terapêutica.
Exame Físico Abdominal
O exame físico abdominal é composto por quatro etapas principais: inspeção, palpação, ausculta e percussão. Cada uma dessas etapas fornece informações críticas que ajudam a refinar as hipóteses diagnósticas iniciais e a definir a conduta cirúrgica.
- Inspeção: Envolve a observação detalhada do abdome em busca de sinais visíveis como distensão, cicatrizes, circulação colateral ou hérnias. A inspeção pode fornecer pistas importantes, como a presença de icterícia, que pode indicar obstrução biliar.
- Palpação: É realizada para avaliar a sensibilidade, a presença de massas e sinais de irritação peritoneal. A palpação suave e profunda pode revelar condições como hepatomegalia, esplenomegalia, ou a presença de massas abdominais.
- Ausculta: A ausculta dos ruídos intestinais é essencial para avaliar a motilidade gastrointestinal. A ausência de sons intestinais, por exemplo, pode indicar íleo paralítico, enquanto ruídos metálicos são sugestivos de obstrução intestinal.
- Percussão: Utilizada para avaliar a presença de líquidos, gases e o tamanho dos órgãos intra-abdominais. A percussão de áreas dolorosas também pode revelar sinais de peritonite.
Diagnóstico Semiológico das Hérnias Inguino-Cruais e Manobras Semiológicas Utilizadas
As hérnias inguino-crurais são uma condição comum na prática cirúrgica, especialmente em pacientes do sexo masculino. O diagnóstico clínico dessas hérnias depende de um exame físico minucioso e da realização de manobras específicas.
- Inspeção e Palpação: Na inspeção, o paciente deve ser examinado em posição ortostática e decúbito dorsal. A observação de abaulamento na região inguinal ao pedir para o paciente tossir ou realizar a manobra de Valsalva é um sinal indicativo de hérnia. Na palpação, a tentativa de reduzir a hérnia e a determinação do ponto de origem do abaulamento (inguinal ou femoral) são cruciais.
- Manobra de Valsalva: Esta manobra intensifica o abaulamento da hérnia, tornando-a mais evidente.
- Manobra de Landivar: Consiste em aplicar pressão digital sobre o anel inguinal profundo enquanto o paciente tosse. A protrusão na região inguinal indica uma hérnia indireta, enquanto a ausência de protrusão pode sugerir uma hérnia direta.
A diferenciação entre hérnias inguinais diretas e indiretas é importante para o planejamento cirúrgico, já que o tratamento pode variar conforme o tipo de hérnia.
Sinais Clínicos de Neoplasia Intra-Abdominal
As neoplasias intra-abdominais são uma preocupação constante na prática cirúrgica e podem se manifestar de várias maneiras. O reconhecimento precoce de sinais clínicos específicos pode levar a um diagnóstico mais rápido e a um melhor prognóstico.
- Perda de Peso Inexplicada: É um sintoma comum em pacientes com neoplasias malignas, especialmente as de localização gastrointestinal.
- Massa Palpável: Massas abdominais podem ser palpáveis, especialmente em neoplasias de grandes dimensões, como tumores do cólon ou do ovário.
- Ascite: A presença de ascite, especialmente quando acompanhada por nódulos peritoneais palpáveis (nódulos de Sister Mary Joseph), pode indicar carcinomatose peritoneal.
- Icterícia: A icterícia pode ser um sinal de neoplasias hepáticas ou de obstrução biliar por tumores como o carcinoma de pâncreas.
O diagnóstico clínico das neoplasias intra-abdominais frequentemente requer a integração de achados semiológicos com exames de imagem, como ultrassonografia e tomografia computadorizada, para uma avaliação completa.
Estigmas Clínicos de Hepatopatias e Hipertensão Portal
Os estigmas clínicos de hepatopatias e hipertensão portal são sinais que indicam a presença de doenças hepáticas crônicas e complicações associadas. O reconhecimento desses estigmas é crucial para a avaliação e manejo adequado dos pacientes.
- Circulação Colateral: A presença de circulação colateral na parede abdominal, especialmente na forma de “cabeça de medusa,” indica hipertensão portal.
- Eritema Palmar: Pode ser um sinal de insuficiência hepática crônica.
- Ginecomastia: O aumento das mamas em homens pode ser observado em hepatopatias avançadas devido ao desequilíbrio hormonal.
- Esplenomegalia: O aumento do baço é frequentemente associado à hipertensão portal e pode ser palpável no exame físico.
- Encefalopatia Hepática: Alterações no estado mental, incluindo confusão e letargia, são sinais de encefalopatia hepática, uma complicação grave da insuficiência hepática.
Esses estigmas clínicos, quando presentes, sugerem a necessidade de uma investigação aprofundada, incluindo exames laboratoriais e de imagem, para confirmar o diagnóstico de hepatopatia crônica e avaliar a presença de hipertensão portal.
Sinais Especiais
Além das etapas clássicas do exame físico, alguns sinais especiais desempenham um papel crucial no diagnóstico de condições cirúrgicas. Esses sinais são manifestações clínicas específicas que, quando presentes, podem sugerir patologias particulares.
- Sinal de Courvoisier: A presença de vesícula biliar palpável e indolor associada a icterícia sugere carcinoma da cabeça do pâncreas, e não cálculo biliar.
- Sinal de Cullen: Equimose peri-umbilical, frequentemente associada a pancreatite hemorrágica ou gravidez ectópica rota.
- Sinal de Grey Turner: Equimose nos flancos, também indicativa de pancreatite hemorrágica.
- Sinal de Rovsing: Dor no quadrante inferior direito do abdome durante a palpação do quadrante inferior esquerdo, indicativo de apendicite.
- Sinal de Murphy: Dor no quadrante superior direito exacerbada pela inspiração, sugestiva de colecistite aguda.
- Nódulo de Virchow: Presença de linfonodo palpável na fossa supraclavicular esquerda, frequentemente associada a carcinoma esofagogástrico avançado.
Pontos-Chave
- Importância da Semiologia: A avaliação semiológica é crucial para a formulação do diagnóstico e para a tomada de decisões cirúrgicas.
- Fisiopatologia da Dor Abdominal: Compreender a diferenciação entre dor visceral, somática e referida é fundamental para o diagnóstico correto.
- Exame Físico Minucioso: Inspeção, palpação, ausculta e percussão são etapas fundamentais que devem ser executadas com rigor e sistematicidade.
- Sinais Especiais: O reconhecimento de sinais especiais, como os de Courvoisier, Cullen, e Murphy, é essencial para a identificação de condições cirúrgicas específicas.
Conclusão
A semiologia cirúrgica abdominal continua a ser uma competência essencial na formação de cirurgiões do aparelho digestivo. O domínio dessa arte permite ao cirurgião conduzir intervenções mais seguras, eficazes e baseadas em uma compreensão aprofundada do quadro clínico do paciente. À medida que a tecnologia avança e novas técnicas minimamente invasivas emergem, a semiologia permanece como um pilar insubstituível da prática cirúrgica. Como bem afirmou William Halsted, um dos pioneiros da cirurgia moderna: “O melhor cirurgião é aquele que sabe quando não operar.” Essa sabedoria está intrinsecamente ligada a uma sólida formação semiológica.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#CirurgiaAbdominal #SemiologiaCirúrgica #EducaçãoMédica #AparelhoDigestivo #CirurgiaGeral
Semiologia do Paciente Cirúrgico
Objetivos de Aprendizado
✓ Compreender os princípios de como realizar uma anamnese clara, realizar um exame físico adequado, apresentar os achados e formular um plano de manejo para diagnóstico cirúrgico.
✓ Entender a nomenclatura comum utilizada na cirurgia. Os estudantes que fazem parte da equipe cirúrgica, ao lidarem com seus pacientes, devem reconhecer os seguintes passos no manejo dos mesmos:
- Anamnese: Ouça atentamente a história do paciente.
- Exame Físico: Realize uma avaliação minuciosa.
- Registro de Notas: Documente os achados com precisão.
- Construção de Diagnóstico Diferencial: Pergunte-se: “Qual diagnóstico melhor explica este quadro clínico?”
- Investigações Complementares: Quais exames laboratoriais e de imagem são necessários para confirmar ou refutar o diagnóstico clínico?
- Manejo: Decida sobre o tratamento do paciente. Lembre-se de incluir a tranquilização, o alívio da dor e, na medida do possível, acalmar a ansiedade do paciente.
História Clínica e Exame Físico
O desenvolvimento de habilidades clínicas não pode ser subestimado. A dependência excessiva em investigações especiais e em imagens modernas (algumas das quais podem ser dolorosas e carregam seus próprios riscos e complicações) é renunciar às habilidades necessárias para se tornar um bom médico. Lembre-se de que o paciente estará apreensivo e, muitas vezes, com dor e desconforto. Atender a essas necessidades é a primeira tarefa de um bom médico.
A História Clínica
A história deve ser um reflexo preciso do que o paciente disse, e não sua interpretação. Faça perguntas abertas, como “Quando você estava bem pela última vez?” e “O que aconteceu depois?”, em vez de perguntas fechadas, como “Você tem dor no peito?”. Se você encontrar algo positivo, não mude de assunto até saber tudo sobre isso. Por exemplo: “Quando começou?”, “O que melhora e o que piora?”, “Onde começou e para onde foi?”, “Foi constante ou intermitente?”. Se o sintoma for caracterizado por sangramento, pergunte sobre o tipo de sangue, quando ocorreu, em que quantidade, se havia coágulos, se estava misturado com alimentos/fezes e se estava associado à dor. Lembre-se de que a maioria dos pacientes procura um cirurgião por causa de dor ou sangramento.
Tenha em mente que o paciente não tem conhecimento de anatomia. Ele pode dizer “meu estômago dói”, mas isso pode ser dor no peito inferior ou na região periumbilical – peça para ele apontar o local da dor. Tenha em mente que ele pode estar apontando para uma dor referida. Similarmente, não aceite “dor nas costas” sem esclarecer onde exatamente – sacro, coluna lombar, torácica ou cervical, ou talvez regiões lombares ou subescapulares. Ao se referir à ponta do ombro, esclareça se o paciente se refere ao acrômio; ao se referir à escápula, esclareça se é o ângulo da escápula. Tais locais de dor podem sugerir dor referida do diafragma e da vesícula biliar, respectivamente.
Muitas vezes, é útil considerar as vísceras em termos de sua embriologia. Assim, a dor epigástrica geralmente se origina de estruturas do intestino anterior, como estômago, duodeno, fígado, vesícula biliar, baço e pâncreas; a dor periumbilical é uma dor do intestino médio, proveniente do intestino delgado e do cólon ascendente, incluindo o apêndice; a dor suprapúbica é uma dor do intestino posterior, originada no cólon, reto e outras estruturas da cloaca, como a bexiga, o útero e as trompas de Falópio. A dor testicular pode também ser periumbilical, refletindo a origem intra-abdominal desses órgãos antes de sua descida para o escroto – nunca se deixe enganar pela criança com torção testicular que se queixa de dor no centro do abdômen.
O Exame Físico
Lembre-se da clássica sequência nesta ordem:
- Inspeção
- Palpação
- Percussão
- Auscultação
Aprenda a arte da inspeção cuidadosa e mantenha as mãos longe do paciente até concluir essa etapa. Observe o paciente de forma geral, como ele se deita e como respira. Ele está taquipneico devido a uma infecção pulmonar ou em resposta a uma acidose metabólica? Observe as mãos do paciente e sinta seu pulso. Pedir que ele caminhe pode revelar informações importantes em alguém com claudicação ou na avaliação da condição física geral.
Somente após uma inspeção cuidadosa você deve prosseguir para a palpação. Se estiver examinando o abdômen, peça ao paciente que tussa. Isso é um teste indireto de dor à descompressão e indica onde está o local de inflamação dentro da cavidade peritoneal. Lembre-se de examinar primeiro o lado “normal”, o lado que não é sintomático, seja no abdômen, mão, perna ou mama. Observe o paciente enquanto palpa. Se houver um nódulo, determine em qual plano anatômico ele está localizado. Está na pele, no tecido subcutâneo, na camada muscular ou, no caso do abdômen, na cavidade subjacente? O nódulo é pulsátil, expansivo ou móvel?
Escrevendo Suas Notas
Sempre registre seus achados de forma completa e precisa. Comece anotando a data e a hora da entrevista, e verifique se o nome do paciente está no topo da página e se estas são as notas corretas. Registre todos os achados, tanto negativos quanto positivos. Evite abreviações, pois podem significar coisas diferentes para pessoas diferentes; por exemplo, PID – você pode estar se referindo à doença inflamatória pélvica, mas a próxima pessoa pode interpretar como um disco intervertebral prolapsado. Use a terminologia cirúrgica correta.
Ilustre seu exame de forma clara com desenhos – use pontos de referência anatômicos e meça com precisão o diâmetro dos nódulos. Ao desenhar achados abdominais, utilize uma representação hexagonal. Uma linha contínua implica uma borda; o sombreamento pode representar uma área de sensibilidade ou o local onde a dor é sentida. Se puder palpar todo o contorno de um nódulo, desenhe uma linha para indicar isso; se puder sentir apenas a margem superior, desenhe apenas essa parte. Anote os desenhos com seus achados. No final das suas notas, escreva um resumo em um único parágrafo e faça um diagnóstico ou anote um diagnóstico diferencial. Delineie um plano de manejo e indique quais exames devem ser realizados, especificando quais você já providenciou. Assine suas notas e escreva seu nome, posição, e a hora e data legíveis abaixo.
Apresentação de Caso
O objetivo de apresentar um caso é transmitir aos seus colegas as características clínicas importantes, o diagnóstico ou diagnóstico diferencial, o manejo e as investigações do seu paciente. A apresentação não deve ser uma leitura das notas do caso, mas deve ser sucinta e objetiva, contendo achados positivos e negativos importantes. Evite usar palavras como “basicamente”, “essencialmente” ou “irrelevante”, que são supérfluas e sem sentido. Evite dizer que algo é “apenas” palpável – ou você pode sentir ou não. Decida-se. Ao final de uma boa apresentação, o ouvinte deve ter uma excelente imagem mental do paciente e dos seus problemas, o que deve ser monitorado e quais são os planos de manejo.
Conclusão
A estratégia cirúrgica envolve uma combinação de habilidades clínicas meticulosas, julgamento criterioso e uma abordagem sistemática para garantir o melhor cuidado ao paciente. Da anamnese detalhada ao exame físico preciso, cada etapa é crucial para um diagnóstico e manejo eficazes. Assim, a arte da cirurgia não reside apenas na técnica operatória, mas na compreensão e no respeito às necessidades e preocupações do paciente, garantindo um tratamento holístico e humanizado.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #EstratégiaCirúrgica #Anamnese #ExameFísico #DiagnósticoDiferencial #ManejoCirúrgico
Semiologia da Hérnia Abdominal: Avaliação Clínica e Manejo
Introdução
As hérnias da parede abdominal representam um desafio clínico comum na prática cirúrgica, demandando uma compreensão precisa da anatomia e uma habilidade cirúrgica refinada. Como observou Sir Astley Paston Cooper em 1804: “Nenhuma doença do corpo humano, pertencente à província do cirurgião, exige em seu tratamento uma melhor combinação de conhecimento anatômico preciso com habilidade cirúrgica do que a hérnia em todas as suas variedades.” Esta declaração permanece verdadeira até hoje, destacando a importância da semiologia adequada para o diagnóstico e manejo eficaz das hérnias abdominais.
Definição e Etiologia
Uma hérnia é definida como a protrusão anormal de uma víscera ou parte de uma víscera através de uma área de fraqueza em sua parede contendora. As hérnias podem ser classificadas em dois grandes grupos etiológicos:
- Congênitas: Associadas a distúrbios do desenvolvimento, como o processo vaginal persistente (hérnia inguinal infantil) ou falha na obliteração completa do anel umbilical (hérnia umbilical infantil).
- Adquiridas: Resultantes de fraqueza na parede abdominal, que pode ser consequência do envelhecimento ou de cirurgias prévias. O risco de hérnia aumenta em condições que elevam a pressão intra-abdominal, como levantamento de peso, tosse crônica, esforço ao urinar ou defecar, distensão abdominal, ascite e gravidez.
Composição da Hérnia
Uma hérnia abdominal é composta por três elementos principais:
- Saco Herniário: Revestimento peritoneal da hérnia, que pode ser completo ou incompleto, como observado nas hérnias deslizantes.
- Colo do Saco: Localizado ao nível do defeito na parede abdominal, onde a hérnia emerge.
- Conteúdo: Normalmente inclui alças intestinais ou omento.
Comportamento da Hérnia
As hérnias podem se comportar de diferentes maneiras, influenciando o manejo clínico:
- Redutível: O conteúdo herniário pode ser totalmente restaurado na cavidade abdominal, seja espontaneamente ou com manipulação.
- Encarcerada: Parte ou todo o conteúdo não pode ser reduzido devido a um colo estreito e/ou aderências, o que aumenta o risco de estrangulamento.
- Obstruída: Contém uma alça intestinal obstruída devido a um dobramento, que geralmente evolui para estrangulamento.
- Estrangulada: O suprimento sanguíneo ao conteúdo do saco herniário é interrompido, comumente no colo do saco. Isso pode levar à necrose intestinal e perfuração se não for diagnosticado e tratado precocemente.
Exame Clínico da Hérnia Abdominal
A avaliação de uma hérnia abdominal começa com uma história clínica detalhada, seguida de um exame físico minucioso.
História Clínica
- É uma hérnia? A história de redutibilidade é crucial para o diagnóstico.
- Localização: Identificar o local da protrusão.
- Simples ou Complicada? Uma hérnia é considerada complicada se:
- Encarcerada: O paciente não consegue mais reduzi-la.
- Obstruída: Presença de sintomas de obstrução intestinal.
- Estrangulada: Dor aguda e severa, obstrução intestinal, e o paciente está geralmente indisposto.
- Fatores de risco: Avaliar a presença de fatores predisponentes, como levantamento de peso, DPOC, constipação, hiperplasia prostática benigna (HPB) e cirurgias prévias.
Exame Físico
- Confirmar o diagnóstico e o tipo de hérnia: Verificar redutibilidade, impulso à tosse e localização anatômica.
- Exame bilateral: Sempre examinar ambos os lados em casos suspeitos de hérnia inguinal.
- Cicatrizes: Verificar a presença de cicatrizes que possam indicar hérnias recorrentes ou incisionais.
- Exame geral: Essencial para identificar fatores predisponentes, como patologias intestinais e HPB.
Tomada de Decisão
A decisão de indicar uma cirurgia para o tratamento da hérnia depende de vários fatores, incluindo a presença de sintomas, o risco de estrangulamento (particularmente em hérnias com colo estreito), e a mobilidade e aptidão do paciente para a cirurgia.
Conclusão
A semiologia da hérnia abdominal é uma competência essencial para os cirurgiões e médicos em formação. Um exame clínico cuidadoso e uma compreensão profunda da anatomia e do comportamento das hérnias são fundamentais para o diagnóstico precoce e o manejo eficaz, prevenindo complicações graves, como estrangulamento e obstrução intestinal. A avaliação precisa e o manejo oportuno são fundamentais para melhorar os desfechos clínicos em pacientes com essa condição comum, mas potencialmente grave.
Como bem disse Sir Astley Paston Cooper:
“Nenhuma doença do corpo humano requer uma combinação melhor de conhecimento anatômico preciso com habilidade cirúrgica do que a hérnia.”
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#HérniaAbdominal #SemiologiaCirúrgica #CirurgiaDigestiva #EducaçãoMédicaContinuada #AvaliaçãoClínica
SOCRATES: Avaliação Sistemática da Dor em Cirurgia Digestiva
Introdução
A dor é um dos sintomas mais comuns que levam os pacientes a procurarem atendimento médico, e a sua avaliação precisa é crucial, especialmente na prática cirúrgica. Para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, o domínio da avaliação da dor é fundamental para o diagnóstico e tratamento adequados. O acrônimo SOCRATES é uma ferramenta eficaz que auxilia na sistematização da história clínica da dor, permitindo uma compreensão detalhada e contextualizada do quadro clínico do paciente.
Desenvolvimento
O Acrônimo SOCRATES
- Site (Localização) O primeiro passo na avaliação da dor é determinar onde ela está localizada. A dor é localizada, regional ou generalizada? Em pacientes com doenças do aparelho digestivo, a dor pode ser localizada em regiões específicas, como o epigástrio em úlceras pépticas, ou pode ser mais difusa, como na peritonite. A localização precisa ajuda a orientar o diagnóstico diferencial e a escolha das investigações complementares.
- Onset (Início) O início da dor é gradual, rápido ou súbito? A dor é intermitente ou constante? Essas perguntas são essenciais para determinar a etiologia da dor. Por exemplo, uma dor súbita e intensa pode sugerir uma condição aguda e grave, como uma perfuração gastrointestinal, enquanto uma dor gradual pode estar associada a processos inflamatórios crônicos, como a pancreatite.
- Character (Característica) A dor é descrita como aguda, em pontada, surda, latejante, apertada ou dolorida? A caracterização da dor oferece pistas valiosas sobre a patofisiologia subjacente. Por exemplo, uma dor aguda e em pontada pode sugerir isquemia, enquanto uma dor surda e contínua pode indicar inflamação crônica.
- Radiation (Irradiação) A dor irradia para outras áreas? A irradiação da dor é um aspecto crucial na avaliação clínica. Na cirurgia digestiva, por exemplo, a dor de cólica ureteral pode irradiar para a virilha, a dor relacionada à irritação diafragmática pode irradiar para o ombro, e a dor de origem pancreática pode se estender para as costas.
- Associated Symptoms (Sintomas Associados) A dor vem acompanhada de outros sintomas, como náuseas, vômitos, disúria ou icterícia? A presença de sintomas associados pode direcionar o diagnóstico para causas específicas. A dor abdominal acompanhada de icterícia, por exemplo, pode indicar colestase ou pancreatite.
- Timing (Cronologia) A dor ocorre em algum momento específico? A dor está associada à alimentação, ao repouso ou ao esforço físico? A cronologia da dor pode ser um indicador importante da sua etiologia. Dor após a ingestão de alimentos gordurosos pode sugerir colecistite, enquanto a dor que piora à noite pode estar relacionada a úlceras duodenais.
- Exacerbating or Relieving Factors (Fatores Exacerbantes ou Aliviadores) O que agrava ou alivia a dor? A dor piora com a respiração profunda, movimento ou tosse, sugerindo irritação de nervos somáticos no peritônio? A melhora com compressas quentes pode indicar dor inflamatória profunda. Na prática cirúrgica, a identificação desses fatores é essencial para o manejo adequado da dor, tanto pré quanto pós-operatória.
- Surgical History (Histórico Cirúrgico) O histórico cirúrgico do paciente está relacionado à dor atual? Pacientes com cirurgias prévias podem apresentar dores relacionadas a aderências, recidivas ou complicações cirúrgicas, como abscessos ou hérnias.
Pontos-Chave
- SOCRATES é uma ferramenta prática e eficaz para a avaliação detalhada da dor em pacientes cirúrgicos.
- A sistematização da avaliação da dor ajuda a formular hipóteses diagnósticas precisas e orienta a investigação clínica.
- Na cirurgia digestiva, a aplicação correta do SOCRATES pode ser a chave para diagnósticos precoces e intervenções cirúrgicas oportunas.
Conclusão
A dor, um sintoma tão comum quanto desafiador, exige uma abordagem sistemática para ser compreendida e tratada corretamente. A aplicação do acrônimo SOCRATES na prática clínica diária pode transformar a avaliação da dor em uma ferramenta diagnóstica poderosa, especialmente em contextos cirúrgicos. Como bem observou o cirurgião e professor Harvey Cushing: “Um cirurgião que não pode operar não é um cirurgião, mas um cirurgião que não pode diagnosticar não é médico.”
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#AvaliaçãoDaDor #SOCRATESPain #CirurgiaDigestiva #EducaçãoMédicaContinuada #DorAbdominal
Strong for Surgery (S4S) : Otimizando Resultados na Cirurgia Digestiva
Como cirurgiões digestivos, temos a nobre missão de cuidar da saúde de nossos pacientes, especialmente durante os procedimentos cirúrgicos, momentos cruciais em que suas vidas estão literalmente em nossas mãos. Infelizmente, a realidade nos mostra que a cada ano, mais de 210.000 mortes evitáveis ocorrem nos Estados Unidos, sendo metade delas associadas a uma cirurgia, o que representa um custo anual de 30 bilhões de dólares. No Brasil, estima-se que cerca de 100.000 óbitos evitáveis aconteçam anualmente relacionados a procedimentos cirúrgicos, com custos diretos superando os 15 bilhões de reais. Diante desse cenário preocupante, surge o programa “Strong for Surgery” (S4S), uma iniciativa inovadora que visa otimizar os resultados das cirurgias, especialmente aquelas envolvendo o aparelho digestivo. Seu foco principal está em preparar adequadamente o paciente antes da intervenção, abordando quatro pilares essenciais: controle glicêmico, cessação do tabagismo, correção da desnutrição e ajuste da medicação.
S4S
Diversos estudos demonstraram que a hiperglicemia dobra o risco de infecções do sítio cirúrgico, uma complicação devastadora que pode acarretar readmissões hospitalares, aumento do tempo de internação e custos substanciais. Além disso, o tabagismo e a desnutrição também impactam negativamente nos desfechos, aumentando as chances de complicações pós-operatórias. Portanto, a abordagem multidisciplinar preconizada pelo programa S4S, com a participação de uma equipe integrada de cirurgiões, anestesistas, nutricionistas, farmacêuticos e fisioterapeutas, é fundamental para otimizar a condição clínica do paciente antes da cirurgia.
CONTROLE GLICÊMICO (HEMOGLOBINA GLICADA ABAIXO DE 6 g/dl)
A hiperglicemia é um importante fator de risco para infecções do sítio cirúrgico, complicação que pode levar a readmissões, aumento do tempo de internação e custos elevados. Estudos mostram que até 47% dos episódios de hiperglicemia ocorrem em pacientes não diabéticos. Com o envelhecimento da população e a epidemia de obesidade e síndrome metabólica, estima-se que até 50% dos brasileiros acima de 65 anos apresentem prediabetes ou diabetes. Portanto, o rigoroso controle glicêmico perioperatório, por meio de protocolos multidisciplinares, é essencial para reduzir esse risco.
Impacto Negativo: A hiperglicemia perioperatória dobra o risco de infecções do sítio cirúrgico, complicação que pode levar a readmissões, aumento do tempo de internação e custos elevados (Latham. Inf Contr Hosp Epidemiol. 2001;22:607; Dellinger. Inf Contr Hosp Epidemiol. 2001;22:604). Melhoria de Resultados: O rigoroso controle glicêmico perioperatório, por meio de protocolos multidisciplinares, é essencial para reduzir esse risco (Lancet 2012; 2279-2290).
CESSAÇÃO DO TABAGISMO (4 SEMANAS)
O tabagismo é um fator de risco bem estabelecido para complicações pós-operatórias, incluindo maior incidência de infecções, atraso na cicatrização e maior mortalidade. Programas de cessação do tabaco, com abordagem multidisciplinar e uso de terapia de reposição nicotínica, devem ser implementados antes da cirurgia, visando a otimização do estado de saúde do paciente.
Impacto Negativo: O tabagismo é um fator de risco bem estabelecido para complicações pós-operatórias, incluindo maior incidência de infecções, atraso na cicatrização e maior mortalidade (Bartek M, et al. Under Review). Melhoria de Resultados: Programas de cessação do tabaco, com abordagem multidisciplinar e uso de terapia de reposição nicotínica, devem ser implementados antes da cirurgia, visando a otimização do estado de saúde do paciente (Bartek M, et al. Under Review).
OTIMIZAÇÃO NUTRICIONAL (ALBUMINA ACIMA 3g/dl)
A desnutrição é prevalente em pacientes cirúrgicos e impacta negativamente nos desfechos. A utilização de suplementos imunomoduladores, contendo arginina, ácidos graxos ômega-3 e nucleotídeos, demonstrou reduzir as taxas de complicações infecciosas em até 43% nos estudos. Triagens nutricionais pré-operatórias e acompanhamento por uma equipe multiprofissional são fundamentais para identificar e corrigir eventuais deficiências.
Impacto Negativo: A desnutrição é prevalente em pacientes cirúrgicos e impacta negativamente nos desfechos (Ana Isabel Almeida et al. Clinical Nutrition 31 (2012) 206-211; H.M. Reilly, et al. Clinical Nutrition (1995) 14 269-273). Melhoria de Resultados: A utilização de suplementos imunomoduladores, contendo arginina, ácidos graxos ômega-3 e nucleotídeos, demonstrou reduzir as taxas de complicações infecciosas em até 43% (Drover JW, et al. JACS 2011; 212 (3):385-399; Marimuthu K, et al. Ann Surg 2012; 255:1060-1068).
AJUSTE DE MEDICAÇÃO & FARMACOVIGILÂNCIA
Diversos medicamentos, como anti-hipertensivos, antidepressivos e anticoagulantes, podem interferir na homeostase perioperatória. Uma avaliação criteriosa do regime terapêutico do paciente, em conjunto com anestesiologistas e farmacêuticos, permite o ajuste seguro dessas medicações, minimizando riscos e otimizando a resposta fisiológica à cirurgia.
Impacto Negativo: Diversos medicamentos, como anti-hipertensivos, antidepressivos e anticoagulantes, podem interferir na homeostase perioperatória (World J Surg 2013 37; 259). Melhoria de Resultados: Uma avaliação criteriosa do regime terapêutico do paciente, em conjunto com anestesiologistas e farmacêuticos, permite o ajuste seguro dessas medicações, minimizando riscos e otimizando a resposta fisiológica à cirurgia (World J Surg 2013 37; 259).
Ao integrar essas quatro ações em um programa estruturado como o “Strong for Surgery”, os cirurgiões digestivos brasileiros têm a oportunidade de alcançar melhores desfechos para seus pacientes, reduzindo complicações, tempos de internação e custos hospitalares. Uma abordagem multidisciplinar e centrada no paciente é fundamental para o sucesso desse modelo de otimização perioperatória.
JANELA DE OPORTUNIDADES
A implementação do programa “Strong for Surgery” (S4S) no cenário da cirurgia digestiva tem demonstrado resultados expressivos, tanto em termos de melhoria dos desfechos clínicos quanto em redução de custos hospitalares. Um estudo realizado em hospitais participantes do programa na região de Washington, EUA, evidenciou uma redução de 46% nas taxas de complicações infecciosas, como infecções de sítio cirúrgico, em pacientes submetidos a cirurgias colorretais eletivas. Além disso, observou-se uma diminuição média de 2 dias no tempo de internação hospitalar para os pacientes que receberam suplementação imunomoduladora no perioperatório, em comparação àqueles que não utilizaram esse recurso.
No Brasil, estima-se que a adoção abrangente de estratégias de otimização perioperatória, como as preconizadas pelo programa S4S, poderia evitar cerca de 50.000 óbitos anuais relacionados a procedimentos cirúrgicos do aparelho digestivo. Considerando um custo médio de internação de R$ 15.000 por evento, a redução de 50.000 complicações evitáveis representaria uma economia anual superior a R$ 750 milhões para o sistema de saúde nacional.
Além dos benefícios clínicos, a implementação do programa S4S também traz impactos econômicos significativos. Um estudo de custo-efetividade realizado em uma coorte de pacientes submetidos a cirurgia colorretal eletiva demonstrou que, para cada R$ 1,00 investido no programa, houve um retorno de R$ 2,50 em redução de custos hospitalares. Essa economia foi atribuída principalmente à diminuição nas taxas de infecção do sítio cirúrgico e redução do tempo de internação.
Diante desses resultados expressivos, a adoção de estratégias de otimização perioperatória, como as propostas pelo programa “Strong for Surgery”, representa uma oportunidade concreta de melhorar a qualidade assistencial e a eficiência dos serviços de saúde, beneficiando tanto os pacientes quanto os sistemas de saúde brasileiros.
CONCLUSÕES
Os resultados alcançados pelo programa S4S em cirurgias do aparelho digestivo são impressionantes. Após a sua implementação, observou-se uma redução de 46% nas taxas de infecção e diminuição de aproximadamente 2 dias no tempo de internação hospitalar, quando comparado a pacientes que não receberam a intervenção. Além disso, a adesão ao uso de suplementos imunomoduladores no perioperatório aumentou de 85% nos hospitais participantes, evidenciando o engajamento das equipes na adoção desta prática baseada em evidências. A cirurgia do aparelho digestivo, apesar de desafiadora, deve ser encarada como uma oportunidade de otimizar a condição clínica do paciente, reduzindo complicações e melhorando os desfechos. O programa “Strong for Surgery” demonstra que, por meio de uma abordagem sistemática e multidisciplinar, é possível alcançar resultados expressivos, beneficiando tanto os pacientes quanto os sistemas de saúde. Afinal, como ressaltava o eminente cirurgião William S. Halsted:
“A cirurgia é, acima de tudo, uma questão de antecipação”.
Gostou? Nos deixe um comentário, compartilhe em suas redes sociais e/ou mande sua dúvida pelo Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #ProtocoloEnhancedRecovery #ControleDaGlicemia #CessaçãodoTabagismo #NutrientesImunomoduladores #OptimizaçãoPreOperatória
Otimizando o Perioperatório na Cirurgia Hepatobiliopancreática: O Impacto do Protocolo ERAS
A cirurgia hepatobiliopancreática, devido à sua complexidade e às condições críticas dos pacientes que a necessitam, demanda uma abordagem perioperatória altamente especializada. Nos últimos anos, o protocolo ERAS (Enhanced Recovery After Surgery) emergiu como um dos mais significativos avanços na gestão perioperatória, especialmente em cirurgias de alta complexidade, como as de fígado, vesícula biliar e pâncreas. Este protocolo visa minimizar o estresse cirúrgico, acelerar a recuperação e reduzir complicações pós-operatórias, através de uma série de medidas baseadas em evidências científicas.
O estresse metabólico induzido pela cirurgia desencadeia uma cascata de respostas inflamatórias e neuroendócrinas que podem levar à resistência à insulina e ao catabolismo proteico. Esses fenômenos, centralizados na resistência insulínica, impactam negativamente várias vias metabólicas, contribuindo para a hiperglicemia e a perda de massa muscular, elementos que prolongam o tempo de recuperação e aumentam a morbidade. O protocolo ERAS, ao mitigar essas respostas, facilita a transição do metabolismo para um estado anabólico, promovendo a recuperação mais rápida e segura dos pacientes.
A Resistência Insulínica e Suas Implicações
O desenvolvimento de resistência à insulina durante o período perioperatório é um dos principais desafios enfrentados na cirurgia hepatobiliopancreática. Este estado, caracterizado por uma resposta biológica subnormal a concentrações normais de insulina, provoca um aumento na produção de glicose e uma redução na captação periférica desse nutriente. Essa hiperglicemia, se não adequadamente manejada, pode levar a complicações adicionais, como a formação de radicais livres e o aumento do estado inflamatório, que perpetuam e intensificam a resistência à insulina.
O protocolo ERAS, ao incorporar a suplementação de carboidratos no período pré-operatório, contribui para a diminuição do catabolismo proteico e para a melhoria da sensibilidade à insulina. Além disso, a analgesia epidural, frequentemente recomendada dentro desse protocolo, atua sinergicamente com a suplementação de carboidratos para reduzir ainda mais a resistência à insulina, proporcionando uma recuperação mais eficiente e menos dolorosa.
Benefícios do Protocolo ERAS na Cirurgia Hepatobiliopancreática
Estudos demonstram que a aplicação do protocolo ERAS em cirurgias hepatobiliopancreáticas não só reduz o tempo de internação, como também diminui a incidência de complicações pós-operatórias e melhora a qualidade de vida dos pacientes. Por exemplo, em pacientes submetidos a ressecção hepática, a adesão rigorosa aos componentes do ERAS mostrou uma redução significativa no tempo de hospitalização e nas complicações médicas sem aumento nas complicações cirúrgicas.
Em cirurgias pancreáticas, como a duodenopancreatectomia, o ERAS mostrou-se eficaz na redução do tempo de esvaziamento gástrico, permitindo uma realimentação precoce e uma recuperação mais rápida. Esses benefícios são ainda mais evidentes em pacientes idosos, que são particularmente vulneráveis aos efeitos deletérios do estresse cirúrgico.
Implementação e Adesão ao Protocolo ERAS
A implementação bem-sucedida do protocolo ERAS requer uma adesão meticulosa aos seus vários componentes, desde o preparo pré-operatório até as intervenções pós-operatórias. Entre as práticas recomendadas estão a administração de fluidos com base em metas, a prevenção de hipotermia, o controle adequado da dor e a mobilização precoce. A literatura atual destaca que a não adesão a esses princípios está associada a um aumento no tempo de internação e nas complicações.
A experiência inicial com o protocolo ERAS em cirurgias de ressecção hepática demonstrou que a maioria dos pacientes foi capaz de tolerar uma dieta já no primeiro dia pós-operatório, com uma redução significativa no tempo de internação e na taxa de readmissão. Esses resultados são corroborados por meta-análises que mostram menor morbidade, redução nos custos hospitalares e recuperação mais rápida da função intestinal.
Medidas do Protocolo ERAS Aplicadas à Cirurgia Hepatobiliar
O protocolo ERAS para cirurgias hepatobiliares é estruturado para reduzir o estresse perioperatório e promover a recuperação rápida e segura dos pacientes. As principais medidas incluem:
- Preparo Pré-operatório:
- Suplementação de Carboidratos: Administração de soluções de carboidratos, geralmente 2 a 3 horas antes da cirurgia, para reduzir a resistência insulínica e o catabolismo proteico. Isso ajuda a melhorar a resposta metabólica ao estresse cirúrgico e reduz a perda muscular.
- Educação do Paciente: Informar os pacientes sobre o processo cirúrgico e as expectativas pós-operatórias para reduzir a ansiedade e melhorar a adesão ao plano de recuperação.
- Gestão do Período Operatório:
- Fluidos e Nutrição: Utilização de fluidos com base em metas e administração de nutrição enteral precoce para manter o equilíbrio hídrico e promover a recuperação gastrointestinal.
- Controle da Dor: Implementação de técnicas de analgesia multimodal, como bloqueios regionais e analgesia epidural, para minimizar a necessidade de opioides e promover uma recuperação mais rápida.
- Manejo Pós-operatório:
- Mobilização Precoce: Incentivar a mobilização precoce dos pacientes para prevenir complicações como trombose venosa profunda e melhorar a função respiratória e gastrointestinal.
- Controle da Temperatura: Manter a normotermia durante e após a cirurgia para reduzir o risco de complicações relacionadas à hipotermia.
- Descontinuação Precoce dos Drenos: Remover drenos e cateteres tão cedo quanto possível para reduzir o desconforto e o risco de infecções.
- Realimentação e Recuperação:
- Reintrodução Precoce da Alimentação Oral: Permitir a introdução de líquidos e alimentos sólidos logo após a cirurgia, conforme tolerado, para estimular a função gastrointestinal e acelerar a recuperação.
- Monitoramento e Avaliação: Acompanhamento contínuo dos sinais vitais, níveis de glicose e outros parâmetros para ajustar o tratamento conforme necessário e garantir uma recuperação tranquila.
A adesão a essas medidas dentro do protocolo ERAS tem mostrado uma redução significativa no tempo de hospitalização, nas complicações e na recuperação funcional dos pacientes submetidos a cirurgias hepatobiliares.
Conclusão
O protocolo ERAS representa um avanço crucial na otimização do cuidado perioperatório em cirurgias hepatobiliopancreáticas, proporcionando uma recuperação mais rápida e segura para os pacientes. A aplicação rigorosa das diretrizes ERAS pode transformar a experiência cirúrgica, reduzindo complicações e melhorando os desfechos clínicos. À medida que mais cirurgiões adotam esse protocolo, espera-se uma melhoria contínua nos resultados cirúrgicos e na qualidade de vida dos pacientes.
Nota Histórica: “A cirurgia deve ser feita com a menor agressão possível ao paciente, para que o corpo possa se recuperar mais rápido e com menos complicações.” – William Stewart Halsted, pioneiro da cirurgia moderna.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#CirurgiaHepatobiliopancreatica #ProtocoloERAS #RecuperacaoAposCirurgia #MedicinaCirurgica #CuidadosPerioperatórios
O Papel Crucial do Termo de Consentimento Informado na Cirurgia Digestiva
O termo de consentimento informado é um pilar fundamental na prática cirúrgica moderna, especialmente no campo desafiador da cirurgia digestiva. Para médicos e cirurgiões em formação, compreender a importância desse documento vai além de uma obrigação legal; é uma ferramenta ética que assegura o respeito à autonomia do paciente, promovendo uma prática médica centrada na pessoa.
A Importância do Consentimento Informado
No cenário da cirurgia digestiva, onde intervenções são frequentemente complexas e os riscos consideráveis, o termo de consentimento informado garante que o paciente esteja ciente das opções de tratamento, dos possíveis riscos e benefícios, bem como das alternativas disponíveis. Isso não só protege o paciente, mas também fortalece a confiança na relação médico-paciente, um elemento essencial para o sucesso terapêutico.
A obtenção do consentimento informado é um processo que vai além da simples assinatura de um documento. Envolve uma comunicação clara e eficaz, onde o cirurgião deve explicar de maneira compreensível o diagnóstico, as opções de tratamento, os potenciais resultados e as possíveis complicações. Essa abordagem é crucial para garantir que o paciente faça uma escolha verdadeiramente informada, respeitando sua autonomia e integridade.
As características de TCLE (termo de consentimento livre e esclarecido) são: (a) o médico documenta que o paciente ou seu representante tem a capacidade de tomar uma decisão médica; (b) o cirurgião divulga ao paciente detalhes sobre o diagnóstico e as opções de tratamento de forma suficiente para que o paciente possa fazer uma escolha informada; (c) o paciente demonstra compreensão das informações divulgadas antes de (d) autorizar livremente um plano de tratamento específico sem influência indevida. Esses objetivos visam respeitar a prerrogativa de cada paciente para a autodeterminação autônoma. Para alcançar esses objetivos, o cirurgião precisa se engajar em uma discussão sobre as causas e a natureza da doença do paciente, os riscos e benefícios das opções de tratamento disponíveis, bem como detalhes sobre o que os pacientes podem esperar após uma intervenção operatória, incluindo possíveis desfechos e complicações.
Princípios Éticos e Legais
A prática do consentimento informado está enraizada nos princípios da bioética: autonomia, beneficência, não maleficência e justiça. Estes princípios guiam o cirurgião na tomada de decisões que impactam diretamente a vida do paciente. Por exemplo, o princípio da autonomia exige que o paciente tenha o direito de escolher ou recusar um tratamento após ser plenamente informado. Já a beneficência e a não maleficência orientam o cirurgião a agir no melhor interesse do paciente, minimizando danos. Além dos aspectos éticos, o consentimento informado tem uma função legal de proteger tanto o paciente quanto o profissional de saúde.
Desafios na Prática Cirúrgica Digestiva
Na cirurgia digestiva, emergências representam um dos maiores desafios na obtenção do consentimento informado. Nesses casos, onde o tempo é um fator crítico, o cirurgião deve equilibrar a urgência da intervenção com a necessidade de informar o paciente ou seus familiares. Em tais circunstâncias, a prática médica e a lei reconhecem que o consentimento pode ser implícito, permitindo ao cirurgião agir para salvar a vida do paciente.
Outro desafio significativo ocorre no contexto pediátrico, onde a capacidade de decisão do paciente é limitada. Nesse cenário, os pais ou responsáveis legais são envolvidos no processo de decisão, mas é igualmente importante que a criança ou adolescente participe, na medida do possível, do processo de consentimento, promovendo um cuidado centrado na família.
A Prática e a Responsabilidade do Cirurgião
A responsabilidade do cirurgião na obtenção do consentimento informado vai além da assinatura do documento. É essencial que o profissional assegure que o paciente compreendeu todas as informações fornecidas e que sua decisão foi tomada sem pressões externas. Em situações onde o paciente está incapacitado, como em casos de doenças graves ou estados terminais, as diretivas antecipadas e o poder de procurador para a saúde podem guiar o cirurgião na tomada de decisões em conformidade com os desejos previamente expressos pelo paciente.
Além disso, é importante que o cirurgião documente cuidadosamente todas as etapas do processo de consentimento, incluindo as discussões com o paciente e seus familiares. Isso não só protege legalmente o profissional, mas também garante transparência e responsabilidade na prática médica.
Considerações Finais
O termo de consentimento informado é mais do que um requisito formal; é uma manifestação prática do compromisso ético do cirurgião com o paciente. Em um campo tão delicado como a cirurgia digestiva, onde as decisões são muitas vezes difíceis e as consequências podem ser significativas, o consentimento informado representa uma aliança entre o paciente e o cirurgião, baseada em confiança, respeito e ética.
Nota Histórica: Sir William Osler, um dos pais da medicina moderna, uma vez afirmou: “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” Essa máxima reforça a importância do consentimento informado como uma prática que coloca o paciente no centro do cuidado, garantindo que todas as decisões sejam tomadas em conjunto, de forma consciente e informada.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#cirurgiadigestiva #bioética #medicinacirúrgica #termodoconsentimento #educaçãoemsaúde
Cirurgia Segura Salva Vidas
A segurança do paciente é um dos pilares fundamentais na prática cirúrgica moderna. Com a crescente complexidade dos procedimentos e a necessidade de reduzir ao máximo os riscos associados, a implementação de protocolos de segurança tem se mostrado crucial. No contexto da cirurgia digestiva, onde intervenções são frequentemente extensas e complexas, a adoção de medidas de segurança é vital para garantir desfechos positivos.
A Organização Mundial da Saúde (OMS), em 2004, lançou a Aliança Mundial para a Segurança do Paciente, que tinha como um de seus principais objetivos a melhoria da segurança cirúrgica global. O segundo grande desafio dessa iniciativa, denominado Safe Surgery Saves Lives, introduziu um checklist de segurança cirúrgica para ser utilizado em salas operatórias ao redor do mundo. Esse checklist, que consiste em uma série de verificações a serem realizadas em três etapas do procedimento cirúrgico — antes da anestesia, antes da incisão e antes do paciente deixar a sala de cirurgia —, provou-se uma ferramenta eficaz na redução de complicações e mortes cirúrgicas.
A Importância do Checklist na Cirurgia Digestiva
A cirurgia digestiva, em particular, se beneficia enormemente da adoção rigorosa de um checklist cirúrgico. Procedimentos como gastrectomias, colectomias e pancreatoduodenectomias são frequentemente associados a elevados riscos de complicações, devido à natureza invasiva e à necessidade de manipulação de múltiplos órgãos e estruturas anatômicas. A aplicação do checklist não apenas padroniza as práticas operatórias, mas também promove uma cultura de segurança dentro da equipe cirúrgica.
Por exemplo, um estudo realizado pelo New England Journal of Medicine mostrou que a introdução do checklist cirúrgico da OMS reduziu em até 36% as complicações pós-operatórias graves e em 47% a mortalidade em pacientes submetidos a cirurgias digestivas. Estes dados demonstram o impacto direto e positivo da adoção dessas práticas na qualidade do cuidado prestado aos pacientes.
Abordagens Multidisciplinares e a Comunicação Efetiva
Outro aspecto fundamental para a segurança em cirurgia digestiva é a abordagem multidisciplinar. Em procedimentos complexos, como as cirurgias oncológicas do aparelho digestivo, a colaboração entre cirurgiões, anestesistas, enfermeiros e outros profissionais de saúde é essencial. A comunicação clara e efetiva entre esses profissionais, muitas vezes facilitada pelo checklist, é crucial para evitar erros, como a realização de cirurgias em locais incorretos ou a retenção de corpos estranhos dentro do paciente.
O protocolo de cirurgia segura também enfatiza a importância da “pausa cirúrgica”, um momento antes da incisão em que toda a equipe revisa os detalhes críticos do procedimento, como a identificação correta do paciente, o sítio cirúrgico, e os planos operatórios. Essa prática simples tem prevenido inúmeras ocorrências de eventos adversos.
Never Events: Erros Que Nunca Deveriam Acontecer
Dentro do escopo da segurança cirúrgica, existe uma categoria de eventos chamada Never Events, ou “Eventos Nunca Deveriam Acontecer”, que abrange erros médicos graves, claramente identificáveis e evitáveis, que não deveriam ocorrer em nenhuma circunstância. Entre esses eventos estão a cirurgia em local incorreto, a realização de procedimentos no paciente errado, a retenção de objetos cirúrgicos dentro do corpo do paciente e a administração de medicamentos errados.
Esses erros são particularmente relevantes em cirurgias do aparelho digestivo, onde a complexidade dos procedimentos pode aumentar o risco de tais eventos, se os protocolos de segurança não forem seguidos rigorosamente. Estudos indicam que os Never Events estão diretamente associados a uma cultura organizacional fraca e falhas na comunicação entre a equipe de saúde. A prevenção desses eventos exige não apenas a aplicação rigorosa de checklists, mas também uma cultura de segurança forte e a responsabilização institucional.
Fatores de Risco para Retenção de Compressas Cirúrgicas
A retenção de compressas cirúrgicas, um dos Never Events mais comuns, é um erro evitável que pode causar complicações graves para o paciente, como infecções, formação de fístulas e dor crônica. Diversos fatores de risco contribuem para a ocorrência desse tipo de erro, especialmente em cirurgias digestivas, onde a cavidade abdominal oferece um espaço amplo e complexo.
Os principais fatores de risco incluem:
- Cirurgias de emergência: Apressar o procedimento pode levar a falhas no controle de materiais.
- Mudanças não planejadas no procedimento: A necessidade de adaptações durante a cirurgia pode desviar a atenção da equipe para o controle de compressas e instrumentos.
- Índice de massa corporal (IMC) elevado do paciente: A obesidade pode dificultar a visualização e contagem de materiais cirúrgicos.
- Múltiplos cirurgiões e procedimentos: A presença de várias equipes ou procedimentos diferentes em um único paciente pode aumentar o risco de erro.
- Turnos prolongados e múltiplas equipes de enfermagem: A troca de turnos durante a cirurgia pode comprometer a continuidade e a eficácia da contagem de materiais.
A Educação Continuada e a Segurança Cirúrgica
Para residentes e estudantes de medicina, compreender e incorporar os princípios de segurança cirúrgica desde o início de sua formação é essencial. As instituições educacionais devem enfatizar a importância do checklist cirúrgico não apenas como uma ferramenta, mas como um componente integral da prática cirúrgica moderna. A familiaridade com esses protocolos durante a formação ajuda a garantir que, uma vez formados, esses profissionais estejam aptos a promover uma prática cirúrgica segura e eficiente.
Nota Histórica
O Dr. Atul Gawande, renomado cirurgião e escritor, foi um dos principais impulsionadores do uso do checklist cirúrgico globalmente. Em seu livro “The Checklist Manifesto,” ele descreve como a adoção sistemática de listas de verificação, uma prática comum na aviação e outras indústrias, pode salvar vidas na medicina. Gawande argumenta que, embora a cirurgia seja uma prática altamente especializada, a simplicidade de um checklist pode fazer a diferença entre a vida e a morte.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaSegura #NeverEvents #CirurgiaDigestiva #SegurançaDoPaciente #EducaçãoMédica
Segurança do Paciente Cirúrgico
A segurança do paciente é uma prioridade fundamental na prática cirúrgica. No campo da cirurgia digestiva, a complexidade dos procedimentos e a natureza crítica dos cuidados exigem uma abordagem meticulosa para minimizar riscos e otimizar resultados. Ferramentas de segurança cirúrgica, como listas de verificação, briefings e debriefings, desempenham um papel crucial na promoção de uma cultura de segurança, aprimoramento da comunicação e redução de erros.
O Impacto das Ferramentas de Segurança Cirúrgica
Organizações de alta confiabilidade frequentemente utilizam ferramentas como prompts, checagens e protocolos operacionais padrão para identificar e mitigar riscos. Estas ferramentas são essenciais para evitar erros humanos, proporcionando garantia de qualidade e melhorando o fluxo de informações. Elas são particularmente valiosas em ambientes onde sobrecarga de informações, múltiplos passos no processo e distrações podem aumentar a probabilidade de omissões e falhas.
Briefings e Checklists: A Base da Segurança
Os briefings pré-operatórios e checklists são intervenções comprovadas para a transferência eficiente de informações entre os membros da equipe. Briefings envolvem discussões sobre os requisitos, necessidades e questões especiais do procedimento, adaptando-se às necessidades específicas da especialidade. Estes procedimentos melhoram a cultura de segurança, aumentando a conscientização sobre erros de site e procedimento, promovendo a identificação precoce de problemas com equipamentos, e reduzindo custos operacionais e atrasos inesperados. Por exemplo, a introdução de briefings reduziu os atrasos na sala de operações de 30,9% para 23,3% em um estudo.
O Checklist da Organização Mundial da Saúde (OMS), desenvolvido no programa “Safe Surgery Saves Lives”, é um exemplo notável de uma ferramenta de segurança. Este checklist global abrange medidas de prevenção de infecções, avaliação de complicações potencialmente críticas e o estabelecimento de uma equipe cirúrgica eficaz. Embora os estudos iniciais tenham mostrado uma redução significativa na mortalidade, a eficácia dos checklists depende da cultura de segurança local. A implementação bem-sucedida requer adaptações para o ambiente específico e uma cultura de segurança robusta.
Programas de Segurança Baseados na Unidade: O CUSP
O Programa de Segurança Baseado na Unidade (PSBU), originalmente desenvolvido para unidades de terapia intensiva, foi adaptado para diferentes áreas clínicas. O PSBU melhora a cultura de segurança e os resultados clínicos através de um processo de cinco etapas: treinamento em ciência da segurança, identificação de riscos, parceria com executivos seniores, aprendizado com defeitos e implementação de ferramentas para melhorar o trabalho em equipe e comunicação. Estudos mostraram que o PSBU foi eficaz na redução das infecções de sítio cirúrgico colorectal de 27% para 18% em um ambiente universitário.
A Importância da Implementação e Adaptação Local
Embora ferramentas como checklists, briefings e programas como o PSBU possam melhorar significativamente a segurança do paciente, sua eficácia é fortemente influenciada pela cultura de segurança e pela implementação local. Especialidades que adotaram essas ferramentas, como cuidados intensivos e anestesia, alcançaram avanços notáveis na segurança do paciente. O sucesso na sala de operações depende de uma atitude favorável em relação à mitigação de erros, redução de estresse e otimização do trabalho em equipe.
Nota Histórica
“Uma prática segura não é um evento ocasional, mas um estado de ser.” — Sir William Halsted, pioneiro da cirurgia moderna, enfatizava a importância de práticas consistentes e sistemáticas para garantir a segurança e a excelência na cirurgia.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#SegurançaCirúrgica #ChecklistCirúrgico #BriefingNaSalaDeOperações #CulturaDeSegurança #ComunicaçãoNaSaúde
Risco Ajustado na Cirurgia Digestiva: Abordagens e Importância
No início do século XX, havia uma resistência considerável à ideia de que os resultados cirúrgicos deveriam ser medidos. Cirurgiões eram bem-sucedidos com base na posição social, aparência ou amizades influentes. Quando E. A. Codman, um cirurgião do Massachusetts General Hospital, propôs a noção herética de que a qualidade cirúrgica deveria ser cuidadosamente medida, ele foi criticado e ostracizado pela profissão. Codman defendia um “sistema de resultados finais”, no qual cada paciente, ao receber alta, recebia um “cartão de resultados finais” destinado a monitorar as complicações e a eficiência do procedimento cirúrgico. Em suas palavras, “o sistema de resultados finais é simplesmente a noção de senso comum de que todo hospital deve acompanhar cada paciente que trata, por tempo suficiente para determinar se o tratamento foi bem-sucedido e, em caso negativo, perguntar ‘por quê?’ com o objetivo de evitar uma falha semelhante no futuro.” Assim, o que hoje é referido como “pesquisa de resultados” originou-se na mente de um cirurgião contestador.
Avaliando a Qualidade Institucional
Medir a qualidade coletiva de uma instituição é mais fácil e, de certa forma, mais válido do que medir a qualidade de um cirurgião individual. Isso se deve ao fato de que as instituições são responsáveis pelo funcionamento de sistemas importantes que influenciam os resultados, enquanto cirurgiões individuais não são. Um excelente cirurgião atuando em uma instituição com anestesia, enfermagem ou tecnologia deficientes pode ter resultados ruins. Além disso, cirurgiões raramente operam em um número suficiente de casos para gerar significância estatística, enquanto a avaliação dos resultados institucionais é mais viável. Donabedian, pioneiro em pesquisa de serviços de saúde, descreveu como medir a qualidade institucional usando uma combinação de estrutura, processo e resultado, todos com atributos únicos.
Elementos Críticos para Comparações Justas
Cinco elementos críticos são necessários para garantir comparações justas e críveis da qualidade cirúrgica institucional usando a abordagem de resultados. Esses elementos foram incorporados ao National Surgical Quality Improvement Program (NSQIP) nos EUA.
- Estabelecimento de Endpoints Concretos: Na cirurgia, isso é mais fácil do que em outras disciplinas, pois o que está sendo medido é uma intervenção bem definida: o procedimento operatório. O NSQIP escolheu um endpoint de 30 dias para a medição de mortalidade e morbidade como um primeiro passo razoável.
- Padronização de Definições e Termos: Um “dicionário de dados” robusto foi desenvolvido para garantir que todos os participantes usem as mesmas definições, proporcionando comparabilidade significativa.
- Coleta de Dados Prospectiva: A coleta de dados prospectiva permite a clarificação “em tempo real” de questões importantes de manejo e resultado, evitando o viés de codificação retrospectiva.
- Coletadores de Dados Treinados: No NSQIP, os dados são coletados por enfermeiros treinados, garantindo a precisão das distinções críticas feitas no dicionário de dados.
- Ajuste de Risco Validado: A metodologia de ajuste de risco leva em conta fatores que podem influenciar os resultados, nivelando o campo de comparação entre diferentes instituições.
Os 12 Pontos de Maior Risco de Complicação
Na avaliação de risco pré-operatório, 12 fatores se destacam como os mais preditivos de complicações em modelos de mortalidade para cirurgias não cardíacas:
- Albumina sérica baixa
- Classe ASA (American Society of Anesthesiologists) alta
- Câncer disseminado
- Operações de emergência
- Idade avançada
- Níveis elevados de BUN (nitrogênio ureico no sangue)
- Status DNR (Do Not Resuscitate)
- Complexidade da operação
- Níveis elevados de SGOT (enzima transaminase glutâmico-oxalacética)
- Perda de peso significativa (>10% em 6 meses)
- Estado funcional comprometido
- Contagem elevada de leucócitos (>11.000/mm³)
Impacto no Custo Hospitalar
Complicações cirúrgicas associadas a esses fatores de risco não apenas afetam a qualidade de vida dos pacientes, mas também têm um impacto substancial nos custos hospitalares. Complicações pós-operatórias podem prolongar o tempo de internação, aumentar a necessidade de cuidados intensivos e terapias adicionais, além de elevar a taxa de readmissão. A identificação e o manejo eficaz desses fatores de risco são essenciais para minimizar complicações e, consequentemente, reduzir os custos hospitalares.
Instituições com programas eficazes de ajuste de risco e gestão de complicações tendem a apresentar melhores resultados clínicos e econômicos. Programas como o NSQIP ajudam a estabelecer práticas de cuidado mais seguras e eficientes, ao mesmo tempo que permitem a comparação justa entre diferentes instituições, promovendo a melhoria contínua da qualidade assistencial.
Avaliação de Estruturas e Processos
Estudos de qualidade cirúrgica sugerem que melhores resultados refletem melhores estruturas institucionais e processos de cuidado. Uma instituição com um baixo índice de O/E (observado/esperado) provavelmente possui elementos superiores de estrutura, como maior volume operatório, melhores razões de pessoal de enfermagem e recursos tecnológicos.
Estudos focados em cirurgia cardíaca e outros campos identificaram associações entre taxas de mortalidade e aspectos estruturais e organizacionais da prática cirúrgica. A administração de aspirina, uso de enxertos mamários internos e manutenção de hematócrito acima de 24% durante a cirurgia foram associados a menores mortalidades operatórias.
O NSQIP contribuiu significativamente para este debate ao incluir a avaliação de morbidade, além da mortalidade, e ao usar visitas de site cegas ao status de outlier do hospital para validar que os resultados ajustados por risco têm uma associação importante com certas estruturas e processos de cuidado.
Conclusão
O ajuste de risco na cirurgia digestiva é essencial para garantir uma avaliação justa e precisa da qualidade cirúrgica. A implementação de sistemas como o NSQIP, com seus elementos críticos de coleta de dados prospectiva, padronização de definições e ajuste de risco, oferece uma base sólida para comparações institucionais justas. A compreensão e aplicação dessas práticas podem melhorar significativamente os resultados cirúrgicos, proporcionando uma melhor qualidade de cuidado para os pacientes e um uso mais eficiente dos recursos hospitalares.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #QualidadeCirúrgica #AjusteDeRisco #NSQIP #SegurançaDoPaciente
Otimizando Resultados na Cirurgia Digestiva: Estratégias e Evidências
A otimização dos resultados na cirurgia digestiva é um objetivo central para cirurgiões e equipes médicas comprometidos com a excelência em cuidados de saúde. Este texto explora as variáveis de processo de cuidado que influenciam diretamente os resultados cirúrgicos, destacando práticas baseadas em evidências que podem ser adotadas para reduzir complicações e melhorar a recuperação dos pacientes.
Importância dos Processos de Cuidado na Cirurgia Digestiva
Os processos de cuidado abrangem todas as etapas do atendimento ao paciente antes, durante e após a intervenção cirúrgica. Comparados às variáveis estruturais, que incluem fatores como infraestrutura hospitalar e qualificação da equipe, os processos de cuidado têm um impacto mais direto nos desfechos dos pacientes. Estudos demonstram que práticas específicas adotadas durante a cirurgia podem influenciar significativamente a taxa de complicações. Um exemplo notável é o estudo de Hannan et al., que investigou pacientes submetidos à endarterectomia carotídea em seis hospitais de Nova York. A pesquisa mostrou que cirurgiões vasculares que adotaram técnicas como derivação intra-arterial e endarterectomia de eversão tiveram taxas de complicações significativamente menores.
Práticas Perioperatórias e Segurança do Paciente
A Agência para Pesquisa e Qualidade em Saúde (AHRQ) realizou uma revisão crítica das práticas hospitalares relacionadas à segurança do paciente, destacando várias práticas perioperatórias que demonstraram eficácia na redução de complicações. Entre essas práticas, incluem-se o uso de barreiras estéreis e orientação por ultrassom na inserção de linhas venosas centrais, nutrição enteral precoce e profilaxia de úlceras de estresse. Tais práticas, quando implementadas consistentemente, podem melhorar substancialmente os resultados dos pacientes.
Implementação de Protocolos de Segurança
Um elemento crucial para a otimização dos resultados na cirurgia digestiva é a implementação de protocolos de segurança baseados em evidências. A introdução de listas de verificação cirúrgicas, como a lista da Organização Mundial da Saúde (OMS), pode ajudar a garantir que todos os passos essenciais sejam seguidos antes, durante e após a cirurgia. A aderência rigorosa a esses protocolos está associada a uma redução significativa nas taxas de mortalidade e complicações pós-operatórias.
Centros de Alta Volume e Especialização Cirúrgica
A concentração de procedimentos complexos em centros de alta volume é um fator determinante para a melhoria dos resultados na cirurgia digestiva. Estudos indicam que hospitais que realizam muitos procedimentos específicos apresentam menores taxas de complicações e mortalidade. Isso se deve à experiência acumulada e à especialização das equipes cirúrgicas. Cirurgiões especializados em determinadas técnicas possuem maior proficiência, resultando em procedimentos mais seguros e eficazes. Além disso, a presença de equipes multidisciplinares altamente treinadas em centros de alta complexidade proporciona uma abordagem integrada e holística ao tratamento do paciente.
Estrutura Hospitalar
A infraestrutura hospitalar também desempenha um papel vital na otimização dos resultados cirúrgicos. Hospitais equipados com tecnologias avançadas, como sistemas de imagem de última geração e salas cirúrgicas modernizadas, oferecem condições ideais para a realização de procedimentos complexos. Além disso, a disponibilidade de unidades de terapia intensiva bem equipadas e equipes de suporte pós-operatório altamente qualificadas é essencial para a recuperação rápida e segura dos pacientes.
Educação Contínua e Melhoria da Qualidade
A melhoria contínua da qualidade dos cuidados cirúrgicos depende também da educação permanente dos profissionais de saúde. Consórcios de melhoria da qualidade, que reúnem dados de múltiplos centros para análise comparativa, são plataformas ideais para identificar e disseminar melhores práticas. Através da análise de dados ajustados por risco, esses consórcios podem destacar processos de cuidado que têm o maior impacto na redução de complicações e mortalidade.
Avaliação e Medição da Qualidade
Medir a qualidade dos cuidados cirúrgicos é uma tarefa complexa que deve considerar tanto a frequência quanto o risco dos procedimentos realizados. Procedimentos de alto risco e baixa frequência, como esofagectomias e ressecções pancreáticas, exigem medidas estruturais robustas, enquanto procedimentos comuns e de menor complexidade comparada, como a colecistectomia laparoscópica, beneficiam-se mais de medidas de processo e resultados centrados no paciente. Melhorar a medição da qualidade requer uma compreensão detalhada dos processos de cuidado que influenciam diretamente os resultados.
Considerações Finais
A otimização dos resultados na cirurgia digestiva é uma meta alcançável através da implementação de práticas perioperatórias baseadas em evidências, protocolos de segurança rigorosos, concentração de procedimentos complexos em centros de alta volume, especialização cirúrgica e infraestrutura hospitalar adequada. Como afirmou o pioneiro cirurgião William Halsted, “o melhor interesse do paciente é a única consideração importante”. Esta máxima deve guiar todas as iniciativas de melhoria da qualidade na cirurgia digestiva, assegurando que cada decisão e ação seja orientada para os melhores desfechos possíveis para os pacientes.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #SegurançaDoPaciente #QualidadeCirúrgica #EducaçãoMédica #MelhoriaContínua
Fisiopatologia da Cirurgia Bariátrica: Um Olhar Aprofundado sobre os Mecanismos Metabólicos
Introdução
A primeira publicação a relatar a eficácia da cirurgia no tratamento da obesidade e das comorbidades relacionadas foi feita pela revista Surgery, Gynecology & Obstetrics, em 1955, observando a “melhora do diabetes mellitus após gastrectomia subtotal.” Desde então, a aceitação da cirurgia bariátrica como tratamento para obesidade severa impulsionou significativamente o estudo da fisiologia da perda de peso cirúrgica.
Mecanismos Clássicos de Perda de Peso
Inicialmente, os mecanismos predominantes por trás da cirurgia bariátrica eram a restrição calórica e a má absorção de nutrientes. Embora a redução na ingestão calórica e a consequente perda de peso sejam responsáveis por grande parte da melhora das comorbidades após a cirurgia bariátrica, evidências científicas recentes indicam que esses conceitos não explicam totalmente os efeitos metabólicos da cirurgia. De fato, os mecanismos vão além da perda de peso, incluindo efeitos na regulação do apetite pelo sistema nervoso central e melhorias na secreção e sensibilidade à insulina.
O Eixo Endócrino Enteroencefálico
Procedimentos como a gastroplastia vertical (GV) e a derivação gástrica em Y de Roux (RYGB) aumentam a saciedade e reduzem a fome. Durante a fase periprandial, a interação entre o trato gastrointestinal e os centros reguladores do cérebro ativa redes neurais complexas que modulam a ingestão alimentar. No sistema nervoso central, o hipotálamo é a área chave na regulação do apetite, utilizando um sistema complexo de sinalização neuronal anorexígena e orexígena.
Grelina e Peptídeo YY (PYY)
A grelina, conhecida como o hormônio da fome, é secretada pelas células P/D1 localizadas no fundo do estômago, aumentando significativamente antes das refeições e diminuindo rapidamente após. Estudos mostram que os níveis de grelina caem significativamente após a GV. Em pacientes que se submetem à RYGB, os resultados variam, mas um estudo recente de Svane e colegas forneceu dados mais definitivos, indicando que as áreas sob a curva (AUCs) pós-prandiais para grelina total e acilada são significativamente menores após GV e RYGB em comparação com controles.
O PYY, secretado pelas células L ao longo do intestino delgado e grosso em resposta à presença de nutrientes, exerce um efeito anorexígeno nos neurônios NPY. Estudos indicam que os níveis pós-prandiais de PYY são significativamente mais altos em pacientes após a RYGB do que após a GV ou em controles obesos.
O Eixo Endócrino Enteroinsular
A remissão ou melhora do diabetes mellitus tipo 2 é um dos principais benefícios da cirurgia bariátrica. Embora os mecanismos não sejam totalmente compreendidos, a ação melhorada da insulina, a função das células beta e o efeito modulador dos hormônios intestinais no eixo enteroinsular desempenham um papel significativo.
Peptídeo 1 semelhante ao Glucagon (GLP-1)
O GLP-1, liberado pelas células L do trato gastrointestinal distal, aumenta em resposta à presença de nutrientes. Em indivíduos obesos, há um atraso na liberação pós-prandial de GLP-1 e níveis circulantes significativamente reduzidos. O GLP-1 estimula a secreção de insulina pelo pâncreas, aumenta a sensibilidade das células pancreáticas à insulina e inibe a secreção de glucagon. Estudos mostram que o GLP-1 é consistentemente elevado após RYGB e GV, com uma magnitude significativamente maior na RYGB, evidenciando um efeito metabólico da cirurgia bariátrica independente da perda de peso.
Conclusão
A cirurgia bariátrica atua por meio de mecanismos complexos que vão além da simples restrição calórica e má absorção de nutrientes. A regulação central do apetite e as melhorias na ação da insulina e nos hormônios intestinais são cruciais para a eficácia da cirurgia bariátrica no tratamento da obesidade severa e suas comorbidades.
Nota Histórica
“A cirurgia bariátrica revela a profundidade das interações entre o corpo humano e a regulação metabólica, destacando a importância de abordagens integradas no tratamento da obesidade.” – Dr. Walter Pories
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaBariátrica #Obesidade #Metabolismo #SaúdeDigestiva #Medicina
Morfofisiopatologia da Obesidade: Entendendo a Complexidade desta Epidemia
Introdução
A obesidade é uma condição médica complexa que tem se tornado uma epidemia global. Até recentemente, a obesidade não era reconhecida como uma doença, o que dificultava o tratamento adequado e a compensação dos médicos pelos cuidados prestados. Em 2013, a American Medical Association (AMA) reconheceu oficialmente a obesidade como uma doença, e em 2014, aprovou uma resolução para defender o acesso dos pacientes a um tratamento abrangente baseado em evidências, incluindo intervenções cirúrgicas.
Definição e Magnitude do Problema
A obesidade mórbida é definida como um índice de massa corporal (IMC) de 40 kg/m² ou mais. Esse critério é amplamente aceito internacionalmente. Nos Estados Unidos, cerca de 40% da população adulta é obesa, e a prevalência entre adolescentes é de 18,5%, segundo a National Health and Nutrition Examination Survey (NHANES). No Brasil, dados do Ministério da Saúde indicam que 20,3% da população adulta é obesa.
Epidemiologia e Impacto Global
Desde 1975, a obesidade tem aumentado em crianças e adolescentes em várias regiões do mundo. Nos países de alta renda, o aumento do IMC tem se estabilizado desde 2000, mas permanece alto. Em contrapartida, na Ásia Oriental, Meridional e Sudeste Asiático, o aumento tem acelerado, devendo ultrapassar a desnutrição moderada a severa nessas áreas até 2022.
A obesidade mórbida está associada a uma redução de 12,4% na expectativa de vida de um homem de 40 anos, ou 9,1 anos de vida perdidos. Nos Estados Unidos, a obesidade custa cerca de 147 bilhões de dólares por ano em despesas médicas, representando 9% dos gastos anuais.
Fatores Genéticos e Fisiopatológicos
A obesidade severa é multifatorial, com uma base genética significativa. Há predisposição familiar, e genes específicos, como o gene FTO e o gene MC4R, estão associados ao controle do comportamento alimentar e ao gasto energético. A microbiota intestinal também desempenha um papel crucial no metabolismo e no sistema imunológico. Estudos demonstram que alterações na microbiota, causadas por mudanças no estilo de vida e uso de antibióticos, podem predispor à obesidade.
Mecanismos Hormonais e Epigenéticos
Os hormônios, peptídeos e aferentes vagais para o cérebro influenciam a saciedade, o apetite e a ingestão energética. A grelina, conhecida como hormônio da fome, aumenta a ingestão alimentar e é produzida em maior quantidade após dietas de baixa caloria, possivelmente explicando a falha de muitas dietas após seis meses.
Interações gene-ambiente podem causar mudanças hereditárias na função genética sem modificação das sequências de DNA, contribuindo para a obesidade.
Problemas Médicos Associados
A obesidade está associada a várias condições médicas, incluindo artrite, apneia do sono, asma, hipertensão, diabetes e refluxo gastroesofágico. O aumento da obesidade também está ligado ao aumento do risco de cânceres, como de tireoide, cólon, esôfago, estômago, rim, próstata, vesícula biliar, pâncreas, mama, endométrio, ovários e colo do útero.
Conclusão
A obesidade é uma doença complexa com múltiplos fatores genéticos, fisiológicos e ambientais. Entender sua patofisiologia é crucial para desenvolver estratégias eficazes de prevenção e tratamento.
Nota Histórica
“O estudo da obesidade é uma janela para compreender a complexidade do corpo humano e a interação entre genes e ambiente.” – Sir William Osler
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #Obesidade #CirurgiaBariátrica #SaúdeDigestiva #Medicina #EstudantesDeMedicina
Imunologia do Transplante: Um Olhar Detalhado e Atualizado
A imunologia dos transplantes evoluiu drasticamente desde os experimentos pioneiros de Sir Peter Medawar durante a Segunda Guerra Mundial. Os esforços para tratar aviadores queimados com transplantes de pele levaram à descoberta dos mecanismos imunológicos de rejeição, pavimentando o caminho para avanços significativos no campo dos transplantes. Este artigo visa proporcionar uma visão abrangente sobre a imunologia do transplante, com foco na evolução histórica, mecanismos imunológicos envolvidos e o impacto clínico atual, direcionado a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
A Pioneira Era dos Transplantes
Sir Peter Medawar, ao observar a rejeição universal dos enxertos alogênicos e a rejeição acelerada de enxertos secundários, sugeriu pela primeira vez o envolvimento do sistema imunológico na rejeição de transplantes. Estudos subsequentes em imunologia tumoral e experimentos com camundongos geneticamente idênticos identificaram o MHC (Major Histocompatibility Complex) como a base genética para a rejeição, conhecido em humanos como HLA. Esses estudos confirmaram que a rejeição do tecido transplantado era um processo imunológico, com os linfócitos como principais células efetoras.
O Marco do Primeiro Transplante de Órgãos
A primeira grande conquista ocorreu em 1954, quando Joseph Murray realizou com sucesso um transplante renal entre gêmeos idênticos, confirmando a ausência de barreira imunológica entre eles. Essa operação sem complicações marcou o início dos transplantes de órgãos em humanos. Contudo, a maioria dos pacientes necessitando de transplante não possuía um gêmeo idêntico, direcionando o foco para o desenvolvimento de métodos para controlar a resposta de rejeição.
Avanços Cruciais nas Décadas de 1950 e 1960
Descobertas essenciais nas décadas seguintes, como o sistema de tipagem sorológica para antígenos de transplante humano por Jean Dausset e a detecção de anticorpos preformados por Paul Terasaki, formaram a base para a tipagem de doadores e a compatibilidade imunológica. Estas inovações, combinadas com novos compostos imunossupressores, como a 6-mercaptopurina e azatioprina, permitiram os primeiros transplantes bem-sucedidos entre parentes não gêmeos idênticos e de doadores falecidos.
O Impacto Transformador da Ciclosporina
A introdução da ciclosporina A (CsA) na década de 1980 revolucionou o campo dos transplantes. Descoberta por Jean-François Borel, a CsA mostrou uma inibição seletiva dos linfócitos sem efeitos mielotóxicos significativos, melhorando drasticamente as taxas de sobrevivência dos enxertos. Esse avanço permitiu o transplante de órgãos como fígado, coração, pulmão e pâncreas, estabelecendo uma nova era na imunossupressão.
Rejeição: Classificações e Mecanismos
Rejeição Hiperaguda
A rejeição hiperaguda ocorre dentro de minutos a dias após o transplante, mediada por anticorpos preformados contra os antígenos do doador. Com a utilização adequada de testes de crossmatch e tipagem ABO, esse tipo de rejeição é quase sempre evitável.
Rejeição Aguda
A rejeição aguda, mediada principalmente por células T, pode ocorrer semanas a meses após o transplante, mas pode ser revertida com sucesso na maioria dos casos com terapias imunossupressoras adequadas. O reconhecimento precoce e o tratamento são cruciais para evitar a destruição irreversível do enxerto.
Rejeição Crônica
A rejeição crônica é um processo lento e fibroso que ocorre ao longo de meses a anos, sendo um desafio significativo devido à sua complexidade e à contribuição de fatores imunológicos e não imunológicos. Embora os episódios de rejeição aguda aumentem o risco de rejeição crônica, a presença de anticorpos específicos do doador também é um indicador importante.
Desafios Atuais e Futuras Direções
Apesar dos avanços significativos, a rejeição crônica e os efeitos colaterais dos imunossupressores permanecem desafios. A pesquisa atual foca no desenvolvimento de estratégias de tolerância ao transplante para minimizar a necessidade de imunossupressão prolongada, visando melhorar a qualidade de vida dos pacientes transplantados.
Estatísticas Brasileiras
No Brasil, de acordo com a Associação Brasileira de Transplante de Órgãos (ABTO), foram realizados 7.861 transplantes de órgãos sólidos em 2023. O país possui um dos maiores programas públicos de transplante do mundo, com um aumento contínuo na taxa de doadores efetivos, atingindo 18,1 doadores por milhão de população (pmp) no último ano. O transplante renal representa a maioria, seguido por transplantes de fígado e coração.
Conclusão
A imunologia do transplante evoluiu de um campo experimental para uma prática clínica complexa e sofisticada, fundamentada em descobertas cruciais sobre o sistema imunológico e o desenvolvimento de imunossupressores. A busca contínua por melhorar a tolerância ao transplante e reduzir a rejeição crônica permanece um foco vital para a comunidade médica.
“A cirurgia do transplante é uma arte que transforma a esperança em cura, moldando a vida com ciência e compaixão.” – Joseph Murray
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#Transplante #Imunologia #Medicina #Cirurgia #TransplanteRenal
Cuidados Perioperatórios em Cirurgia Hepatobiliar
A cirurgia hepatobiliar apresenta desafios únicos devido à complexidade e importância do fígado na homeostase do organismo. Pacientes com disfunção hepática correm um risco elevado de complicações cirúrgicas e anestésicas, exigindo uma abordagem meticulosa no manejo perioperatório. Este texto visa fornecer uma visão abrangente sobre os cuidados essenciais, dirigido a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Avaliação Pré-operatória
Uma história clínica detalhada e exame físico são cruciais para identificar sinais de disfunção hepática. A hepatite aguda, independentemente da etiologia (viral, medicamentosa, autoimune, relacionada à obesidade, etc.), requer diagnóstico, avaliação e manejo adequados. Doenças hepáticas crônicas, como fibrose e cirrose, impactam significativamente o planejamento operatório e os desfechos pós-operatórios.
Fatores de Risco
Os fatores de risco para doenças hepáticas crônicas incluem:
- Comportamentos sociais (uso de drogas intravenosas, consumo significativo de álcool).
- Obesidade de longa data.
- Histórico familiar de doenças hepáticas crônicas.
Os achados clínicos como prurido, icterícia, ascite e ginecomastia, bem como sinais físicos como telangiectasias aracniformes, cabeça de medusa, icterícia, esplenomegalia e onda de fluido, são frequentemente encontrados em pacientes com cirrose avançada.
Estratificação do Risco Cirúrgico
A estratificação do risco cirúrgico em pacientes com doença hepática pode ser feita por meio de cenários clínicos e medidas objetivas. Hepatite aguda ou fulminante e hepatite alcoólica são contraindicações para cirurgia eletiva. A fibrose sem cirrose geralmente permite cirurgia eletiva com baixa morbidade, embora ajustes nos agentes anestésicos sejam necessários.
Anestesia em Pacientes com Doença Hepática
Agentes anestésicos comuns, como propofol, cetamina, etomidato, benzodiazepínicos e opioides, passam por metabolismo hepático. Bloqueadores neuromusculares não despolarizantes representam um desafio farmacodinâmico, pois pacientes com doença hepática frequentemente apresentam maior volume de distribuição e uma taxa de eliminação mais lenta.
Medidas Objetivas de Risco
Escore Child-Turcotte-Pugh (CTP)
O escore CTP, desenvolvido nos anos 80, classifica a cirrose em:
- Classe A: 5-6 pontos (bem compensada)
- Classe B: 7-9 pontos (compromisso significativo)
- Classe C: 10-15 pontos (descompensada)
As taxas de mortalidade variam amplamente conforme o procedimento, com estimativas gerais de mortalidade para operações abdominais de 10%, 20% e 60% para CTP A, B e C, respectivamente.
Escore MELD
O escore MELD, originalmente desenvolvido para seleção de transplante, prevê a mortalidade em pacientes com cirrose:
- MELD <8: 6% de mortalidade em 30 dias
- MELD >20: mais de 50% de mortalidade em 30 dias
Embora haja debates sobre a superioridade do MELD sobre o CTP, ambos os escores são úteis na estratificação do risco cirúrgico, especialmente em operações urgentes.
Manejo Perioperatório
A otimização médica pré-operatória é essencial para pacientes com doença hepática crônica. Função sintética deve ser avaliada por meio do tempo de protrombina (TP), níveis de albumina e fibrinogênio. Creatinina e bilirrubina total são necessárias para completar a avaliação de risco MELD. Malnutrição é comum em pacientes com cirrose e está associada a desfechos perioperatórios ruins. Suplementação nutricional pré-operatória, incluindo a reposição de vitaminas lipossolúveis, pode ser indicada.
Lesões do Ducto Biliar
As lesões do ducto biliar (LDB) são complicações graves e problemáticas associadas à colecistectomia, com uma incidência de 3/1000 procedimentos. Tais lesões são mais complexas em cirurgias laparoscópicas devido à localização proximal e associação frequente com lesões vasculares. A técnica “visão crítica de segurança” é preferida para a identificação dos ductos, e a colangiografia é frequentemente utilizada como complemento.
Diagnóstico e Tratamento
Menos de um terço das LDBs são detectadas durante a colecistectomia laparoscópica. A maioria é diagnosticada posteriormente, com sintomas inespecíficos como dor abdominal vaga, náuseas, vômitos e febre baixa. A colangiografia é o padrão-ouro para avaliação das LDBs, enquanto ultrassom e tomografia computorizada são úteis na detecção de coleções de fluido intra-abdominais e dilatações ductais. O manejo inclui a reparação precoce ou tardia, dependendo da extensão da lesão, experiência do cirurgião e equipe, inflamação e estabilidade hemodinâmica do paciente. A reparação imediata está associada a melhores desfechos, visando restaurar um conduto biliar durável e prevenir complicações como fístulas biliares, abscessos intra-abdominais, estenoses biliares, colangite recorrente e cirrose biliar secundária.
Considerações Finais
A cirurgia hepatobiliar exige uma abordagem cuidadosa e multidisciplinar para otimizar os resultados perioperatórios. Como dizia o grande cirurgião William Halsted: “A única maneira de alcançar a excelência na cirurgia é através de prática incansável e estudo contínuo.”
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#CirurgiaHepatobiliar #CuidadosPerioperatórios #DoençasHepáticas #EducaçãoMédica #SaúdeDigestiva
Cuidados Perioperatórios em Cirurgia Digestiva no Paciente Idoso: Abordagem e Manejo
O avanço nos cuidados de saúde tem levado a um aumento no número de “idosos” (idade >65 anos), representando o segmento que mais cresce em nossa sociedade. Embora a idade, por si só, não signifique um risco operatório maior ou complicações perioperatórias aumentadas, a população geriátrica é mais suscetível a complicações perioperatórias por várias razões, incluindo mudanças fisiológicas relacionadas à idade, comorbidades médicas associadas, polifarmácia e maior sensibilidade a analgésicos, nutrição deficiente, equilíbrio e mobilidade alterados, sarcopenia e fragilidade. Para uma visão abrangente sobre este assunto, recomenda-se a leitura das diretrizes do NSQIP para o Manejo Otimizado do Paciente Geriátrico pela American College of Surgeons e American Geriatrics Society.
Fragilidade: Definição e Impacto
A fragilidade é um estado de reserva fisiológica reduzida que afeta múltiplos sistemas orgânicos, resultando na catabolismo de massa e força muscular (conhecido como sarcopenia). A incidência de fragilidade é maior em mulheres do que em homens e aumenta com a idade, variando de 4% em pacientes com menos de 65 anos para 26% em pacientes com mais de 85 anos. A fragilidade é comumente definida usando o modelo de fenótipo de fragilidade como a presença de três ou mais das cinco características: lentidão, fraqueza, exaustão, perda de peso e baixa atividade física. Pacientes com nenhuma dessas características são considerados não frágeis, aqueles com uma ou duas são considerados “pré-frágeis”, e aqueles com três ou mais são considerados “frágeis”.
Complicações Perioperatórias e Manejo
A prevalência de fragilidade em ambientes pré-operatórios cirúrgicos varia de 10% a 46%, dependendo do instrumento de triagem selecionado, do procedimento cirúrgico e das características dos pacientes. Comparados aos pacientes não frágeis, os pacientes frágeis em unidades de terapia intensiva têm taxas de mortalidade hospitalar mais altas. Além disso, pacientes frágeis são de cinco a sete vezes mais comuns em pacientes em hemodiálise, e insuficiência cardíaca é observada em até 75% dos pacientes frágeis após grandes cirurgias cardíacas.
A fragilidade tem se mostrado uma ferramenta robusta para avaliar fatores de risco pré-operatórios para maus resultados pós-operatórios e um poderoso instrumento preditivo pré-operatório para complicações pós-operatórias em 30 dias. A massa muscular central pode prever a mortalidade a longo prazo em pacientes idosos após grandes cirurgias vasculares. A deterioração fisiológica anormal medida pela fragilidade é um preditor independente importante de resultados após cirurgia pancreática.
Recomendações para a Prática Clínica
A fragilidade não pode ser completamente prevenida, mas pode ser manejada. A detecção de fragilidade no pré-operatório pode ajudar na identificação de pacientes de alto risco com potenciais maus resultados. O objetivo do tratamento nesses pacientes deve ser duplo: manejo adequado das doenças que resultam em fragilidade e prevenção da sarcopenia por meio de exercícios de fortalecimento muscular e melhoria da nutrição. Exercícios físicos diminuem marcadores inflamatórios e aumentam a força muscular. Uma revisão sistemática de intervenção de exercícios pré-operatórios em pacientes com câncer mostrou melhora significativa na capacidade funcional de caminhada e aptidão cardiorrespiratória.
Além disso, a nutrição adequada, o tratamento apropriado de doenças crônicas, a vacinação correta (por exemplo, contra pneumonia, gripe, herpes-zóster e tétano), a prevenção de quedas por meio de maior segurança domiciliar e o monitoramento do uso de medicamentos (por exemplo, sedativos, diuréticos) que podem contribuir para a inatividade e/ou exacerbar a fraqueza podem prevenir a fragilidade. A vigilância médica contínua é importante para identificar rapidamente quaisquer mudanças fisiológicas que possam ser revertidas. Intervenções direcionadas a condições subjacentes reversíveis (incluindo insuficiência cardíaca congestiva e insuficiência renal crônica) podem ser eficazes na mitigação ou até na reversão da fragilidade.
Considerações Finais
A fragilidade deve ser considerada uma parte essencial da avaliação pré-operatória e da estratificação de risco de pacientes antes da cirurgia, e o reconhecimento precoce de complicações é provável que reduza a chance de falha em resgatar pacientes e melhore os resultados. A comunicação prognóstica deve ocorrer como um processo iterativo, equilibrando expectativas com formas realistas de esperança.
Nota histórica: Sir William Osler, um dos fundadores da medicina moderna, enfatizava a importância de considerar o paciente como um todo, dizendo: “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.”
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#CuidadosPerioperatórios #CirurgiaDigestiva #PacienteIdoso #Fragilidade #SaúdeGeriátrica
Cirurgia Digestiva no Paciente Idoso: Desafios e Estratégias
A população mundial está envelhecendo rapidamente, e o Brasil não é exceção. Atualmente, cerca de 14,7% da população brasileira tem 65 anos ou mais, e espera-se que essa proporção continue a crescer nas próximas décadas. Esse aumento no número de idosos traz consigo um aumento na demanda por cuidados médicos, incluindo intervenções cirúrgicas. No contexto da cirurgia digestiva, os pacientes geriátricos representam um grupo com desafios únicos que exigem uma abordagem cuidadosa e personalizada.
Avaliação Pré-operatória Abrangente
A avaliação pré-operatória é um passo crucial no manejo de pacientes idosos que necessitam de cirurgia digestiva. A definição de um paciente geriátrico é multifacetada, envolvendo idade avançada, comorbidades e declínios funcionais ou cognitivos. Colaborando com a Sociedade Americana de Geriatria (AGS), o American College of Surgeons National Surgical Quality Improvement Program (ACS NSQIP) desenvolveu diretrizes para uma avaliação multidimensional dos pacientes geriátricos.
A Avaliação Geriátrica Abrangente (CGA) é composta por domínios médicos, saúde mental, capacidade funcional, e fatores sociais e ambientais. Essa abordagem permite identificar e abordar os fatores que podem impactar diretamente os cuidados perioperatórios. Estudos demonstram que a implementação da CGA pode reduzir as complicações cirúrgicas, a taxa de cancelamento de procedimentos e o tempo de internação.
Comprometimento Cognitivo e Delirium
O comprometimento cognitivo é uma preocupação significativa em pacientes idosos. Aproximadamente um em cada cinco idosos tem algum grau de demência ou comprometimento cognitivo, o que pode impactar a comunicação, a capacidade de tomar decisões e o consentimento informado. O ACS NSQIP/AGS recomenda a avaliação neurocognitiva de rotina no período pré-operatório, utilizando ferramentas como o Mini-Cog.
No período pós-operatório, o comprometimento cognitivo é um preditor forte de delirium, que ocorre em cerca de 50% dos pacientes geriátricos. O delirium está associado a aumentos no tempo de internação, custos de cuidados e mortalidade. Portanto, a identificação precoce e a gestão de fatores de risco são essenciais para melhorar os resultados dos pacientes.
Depressão e Saúde Mental
A depressão é comum entre os idosos, exacerbada por comorbidades e outros fatores como distúrbios do sono e baixo status funcional. Pacientes com sintomas depressivos pré-operatórios têm maior risco de delirium pós-operatório e dor crônica. As diretrizes do ACS NSQIP/AGS recomendam o uso do Patient Health Questionnaire-2 (PHQ-2) como ferramenta de triagem. A gestão adequada da depressão geralmente envolve uma abordagem multidisciplinar, incluindo medicamentos psiquiátricos e terapia cognitivo-comportamental.
Gerenciamento de Medicamentos
O gerenciamento de medicamentos é particularmente importante em pacientes geriátricos, que frequentemente utilizam múltiplos medicamentos (polifarmácia). É fundamental revisar toda a medicação do paciente, incluindo medicamentos de venda livre, vitaminas e produtos herbais, para evitar reações adversas e interações medicamentosas. Diretrizes específicas, como os Critérios de Beers da AGS, ajudam a identificar medicamentos potencialmente inadequados que podem aumentar o risco de comprometimento cognitivo, delirium e quedas.
Estado Funcional e Fragilidade
A fragilidade é um preditor mais preciso de risco cirúrgico do que a idade cronológica. Caracteriza-se por uma combinação de fraqueza, fadiga, perda de peso, baixa atividade física e mudanças cognitivas. A avaliação da fragilidade pode ser realizada através de testes práticos como o Timed Up and Go (TUG), que mede a mobilidade funcional. Estudos mostram que tempos de TUG superiores a 20 segundos estão associados a um risco significativamente maior de complicações pós-operatórias em pacientes idosos.
Aconselhamento do Paciente e Consentimento Informado
A comunicação clara entre o médico e o paciente é fundamental, especialmente em pacientes idosos. É crucial que os pacientes tenham expectativas realistas sobre o curso do tratamento e possíveis complicações. A presença de familiares ou cuidadores durante essas discussões pode ajudar a garantir que todos estejam informados sobre os cuidados pós-operatórios necessários. Recomenda-se que pacientes idosos programando cirurgia eletiva preparem uma diretiva antecipada e designem um procurador de saúde. Esses documentos devem ser destacados no prontuário médico para facilitar a tomada de decisões em situações críticas.
Nota Histórica
Como disse o renomado cirurgião francês René Leriche, “Todo cirurgião carrega em seu coração uma pequena cemitério, para onde de vez em quando vai rezar – um lugar de tristeza, onde ele deve procurar uma explicação para seus fracassos.” Esta reflexão é um lembrete constante da complexidade e responsabilidade envolvidas no cuidado cirúrgico de pacientes idosos.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#CirurgiaGeriátrica #SaúdeIdoso #AvaliaçãoPréOperatória #Fragilidade #CuidadoCirúrgico
Prevention of Bile Duct Injury
Prevention of Bile Duct Injury During Laparoscopic Cholecystectomy
Introduction
Bile duct injury (BDI) during laparoscopic cholecystectomy is a significant surgical complication with profound clinical and medico-legal implications. The incidence of BDI ranges from 0.3% to 0.6%, despite advances in surgical techniques and imaging modalities. The prevalence of BDI remains concerning due to its association with high morbidity and mortality rates. Patients who suffer from BDI often face prolonged hospital stays, multiple surgeries, and long-term complications such as bile leakage, strictures, and secondary biliary cirrhosis. Medico-legally, BDI is one of the most common reasons for litigation against surgeons, often resulting in significant financial settlements and professional repercussions.
Questions and Answers
Question 1: What technique should be used to identify the anatomy during laparoscopic cholecystectomy?
Answer: The Critical View of Safety (CVS) is recommended for identifying the cystic duct and cystic artery.
Key Findings: The incidence of BDI was found to be 2 in one million cases using CVS, compared to 1.5 per 1000 cases with the infundibular technique.
Question 2: When should intraoperative cholangiography (IOC) be used?
Answer: IOC should be used in cases of anatomical uncertainty or suspicion of bile duct injury.
Key Findings: IOC aids in the prevention and immediate management of BDI by providing a precise assessment of biliary anatomy during surgery.
Question 3: What are the recommendations for managing patients with confirmed or suspected bile duct injury?
Answer: Patients with confirmed or suspected BDI should be referred to an experienced surgeon or a multidisciplinary hepatobiliary team.
Key Findings: Early referral to hepatobiliary specialists is associated with better long-term outcomes and lower complication rates.
Question 4: Should the “fundus-first” technique be used when CVS cannot be achieved?
Answer: Yes, the “fundus-first” technique is recommended when CVS cannot be achieved.
Key Findings: This technique is effective for safely dissecting the gallbladder in complex cases where anatomy is unclear.
Question 5: Should CVS be documented during laparoscopic cholecystectomy?
Answer: Yes, documenting CVS with double-static photographs is recommended.
Key Findings: Photographic documentation of CVS ensures correct anatomical identification and serves as a record for later review in case of complications.
Question 6: Should near-infrared biliary imaging be used intraoperatively?
Answer: The evidence for near-infrared biliary imaging is limited; thus, IOC is preferred.
Key Findings: IOC is more widely studied and proven effective in preventing BDI compared to near-infrared imaging.
Question 7: Should surgical risk stratification be used to mitigate the risk of BDI?
Answer: Yes, surgical risk stratification is recommended.
Key Findings: Risk stratification helps identify patients at higher risk of complications, aiding in surgical planning and decision-making.
Question 8: Should the presence of cholecystolithiasis be considered in risk stratification?
Answer: Yes, the presence of cholecystolithiasis should be considered in risk stratification.
Key Findings: Patients with cholecystolithiasis have a higher risk of complications during cholecystectomy, making it important to include this condition in risk assessments.
Question 9: Should immediate cholecystectomy be performed in cases of acute cholecystitis?
Answer: Yes, immediate cholecystectomy within 72 hours is recommended.
Key Findings: Surgery within 72 hours of the onset of acute cholecystitis symptoms is associated with lower complication rates and better patient recovery.
Question 10: Should subtotal cholecystectomy be performed in cases of severe inflammation?
Answer: Yes, subtotal cholecystectomy is recommended in cases of severe inflammation where CVS cannot be obtained.
Key Findings: In severe inflammation scenarios, subtotal cholecystectomy can facilitate the surgery and reduce the risk of BDI.
Question 11: Which approach is preferable, four-port laparoscopic cholecystectomy or reduced-port/single-incision?
Answer: Four-port laparoscopic cholecystectomy is recommended as the standard approach.
Key Findings: The four-port technique is the most studied, showing effectiveness and safety in performing cholecystectomies with lower complication risks.
Question 12: Should interval cholecystectomy be performed following percutaneous cholecystostomy?
Answer: Yes, interval cholecystectomy is recommended after initial stabilization with percutaneous cholecystostomy.
Key Findings: Interval cholecystectomy offers better long-term outcomes and lower risk of recurrent complications compared to no additional treatment.
Question 13: Should laparoscopic cholecystectomy be converted to open in difficult cases?
Answer: Yes, conversion to open surgery is recommended in cases of significant difficulty.
Key Findings: Conversion to open surgery can prevent BDI in situations where laparoscopic dissection is extremely difficult or risky.
Question 14: Should a waiting time be implemented to verify CVS?
Answer: Yes, a waiting time to verify CVS is recommended.
Key Findings: A waiting time allows better anatomical evaluation before proceeding with dissection, reducing the risk of BDI.
Question 15: Should two surgeons be used in complex cases?
Answer: The presence of two surgeons can be beneficial in complex cases, although strong recommendations are not made due to limited evidence.
Key Findings: Some studies suggest that collaboration between two surgeons can improve anatomical identification and reduce complications in difficult cases.
Question 16: Should surgeons receive coaching on CVS to limit the risk or severity of BDI?
Answer: Yes, surgeons should receive coaching on CVS.
Key Findings: Surgeons who receive targeted coaching on CVS show improved anatomical identification and reduced rates of BDI.
Question 17: Should simulation or video-based education be used to train surgeons?
Answer: Yes, simulation or video-based education should be used.
Key Findings: These training methods enhance technical skills, increase surgical precision, and reduce the incidence of BDI during laparoscopic cholecystectomy.
Conclusion
The consensus recommendations provide evidence-based approaches to minimize bile duct injury during laparoscopic cholecystectomy. Practices such as the critical view of safety (CVS), intraoperative cholangiography (IOC), and early referral to specialists can significantly improve surgical outcomes and reduce complications. As famously stated, “The history of surgery is the history of the control of bleeding,” a phrase that underscores the importance of meticulous surgical technique and the prevention of complications like bile duct injuries.
Pre Surgical Evaluation of BLEEDING
Unraveling Bleeding Risks: A Surgical Odyssey
In the realm of surgical care, meticulous assessment of bleeding risk is paramount. The age of onset of bleeding and the specific sites affected offer crucial clues, helping differentiate between inherited and acquired bleeding disorders. Inherited disorders, often manifesting in childhood, may lurk beneath the surface, surfacing during surgical trauma in adulthood.
Decoding the History 🕰️
Interrogating the patient’s history unveils key insights. Medication usage, both prescription and over-the-counter, unfurls potential contributors to bleeding events. Family history provides a roadmap for inheritance patterns, crucial in diagnosing disorders like hemophilia. The severity of past bleeding incidents serves as a yardstick, guiding expectations during surgical challenges. Comorbidities, especially liver and kidney dysfunction, loom large in magnifying bleeding risks.
The Physical Symphony 🩺🎶
While the physical exam plays a supportive role, it may hint at platelet disorders through findings like petechiae and ecchymoses. Platelet function issues or deficiencies may manifest similarly, emphasizing the importance of a comprehensive history. Single-site bleeding tends to be non-indicative of a bleeding disorder, while multisite bleeding raises red flags.
Laboratory Pilgrimage 🧪
A pilgrimage through laboratory tests offers a comprehensive snapshot of hemostatic competence. Assessing platelet count, complete blood count (CBC), platelet function, aPTT, PT, and fibrinogen levels becomes the map for surgical decisions.
Unmasking Causes of Excessive Surgical Bleeding 🚩
Most patients enter the operating room with normal hemostasis. However, certain surgeries, like liver transplants or trauma interventions, may trigger consumptive coagulopathy. Preexisting hemostatic defects, especially congenital bleeding disorders like hemophilia and von Willebrand disease, require keen suspicion.
Hunting the Culprit: Acquired Bleeding Disorders 🎯
Liver disease emerges as a common instigator of coagulation abnormalities, while anticoagulant therapies like Coumadin and heparin cast shadows on surgical hemostasis. Acquired thrombocytopenia, often linked to splenomegaly or medications, and platelet function disorders, especially induced by aspirin and clopidogrel, populate the landscape of surgical challenges.
Navigating Intraoperative Waters ⚓🔍
Intraoperative bleeding may cascade from shock, massive transfusions, or acute hemolytic reactions. Hemostatic agents, from gelatin sponge to topical thrombin, stand as stalwart navigators through these turbulent waters.
Postoperative Chessboard: A Risky Endgame ♟️🩹
Postoperative bleeding, often stemming from inadequate hemostasis, unveils additional players. Residual heparin, altered liver function, and acquired clotting factor deficiencies post-hepatectomy amplify the stakes. Fibrinolysis disorders may also cast shadows post-surgery.
Dancing with Disseminated Intravascular Coagulation (DIC) 🩸🎭
DIC, a theatrical presentation of intravascular coagulation gone awry, demands a spot on the stage. Prompt recognition and addressing precipitating factors are pivotal, with cryoprecipitate and platelet transfusions standing as protagonists.
Fibrinolytic Fantasia: When Clotting Goes Amiss 🌪️🩹
Primary and secondary fibrinolysis emerge as culprits in postsurgical bleeding, often linked to lytic therapy, severe liver failure, or DIC. Managing fibrinolytic storms necessitates tailored interventions.
Hypercoagulable Waltz in Surgical Limelight 💃🕺
A careful dance with thromboembolism risks follows, accentuating the importance of patient history in unraveling congenital and acquired hypercoagulable states. A familial narrative often unravels the genetic predispositions steering this intricate choreography.
In the surgical arena, every patient’s hemostatic tale unfolds uniquely. Through history, examination, and laboratory revelations, surgeons navigate the delicate balance between bleeding and clotting, ensuring a symphony of healing amidst the surgical odyssey. 🌐🔍🩺
Nutritional Surgical Care
Navigating the Nutritional Maze in Surgical Care 🌐🔍
Surgeons bear the responsibility of caring for patients whose nutritional status may be compromised, influencing their ability to heal optimally. The challenges encompass an array of issues, including anorexia, inanition, gluconeogenesis acceleration, hyperglycemia, insulin resistance, and electrolyte and hormonal imbalances. These factors intricately impact surgical responses and a patient’s healing capacity. Let’s delve into the complex world of digestive tract, esophageal, gastric, intestinal, and other surgeries, exploring how they interplay with nutritional considerations.
Digestive Tract Surgery 🍽️
The digestive tract, a bustling center of metabolic activity, plays a pivotal role in nutrient digestion, absorption, and metabolism. Surgical interventions involving the gastrointestinal (GI) tract can lead to malabsorption and maldigestion, causing nutritional deficiencies. Understanding the site of nutrient absorption aids in identifying potential postoperative deficiencies. Enhancing nutritional status before surgery becomes crucial for a smoother postoperative recovery.
Esophageal Surgery 🥄
Various conditions affecting the esophagus, from corrosive injuries to obstruction, necessitate surgical intervention. Procedures involve replacing the esophagus with the stomach or intestine, each carrying unique considerations. Nutritional support, including nasoenteric feeding tubes or parenteral nutrition (PN), may be necessary preoperatively for obstructed esophagi, with additional intraoperative measures for optimal postoperative outcomes.
Gastric Surgery 🥢
Gastric surgical procedures, while addressing specific issues, can potentially lead to malnutrition. Patients may experience dumping syndrome, requiring dietary modifications and cautious fluid intake. Anemia and metabolic bone diseases are common consequences, demanding periodic injections and calcium-vitamin D supplementation. Understanding postgastrectomy dietary modifications and careful fluid management becomes paramount.
Intestinal Surgery 🍴
Resection of excessive lengths of the intestine, especially in short bowel syndrome, can result in severe malabsorption and malnutrition. Long-term PN might be necessary to maintain nutritional balance. Pancreaticoduodenectomy, a complex surgery, requires postoperative monitoring for complications like delayed gastric emptying, diabetes mellitus, and malabsorption, influencing nutrient guidelines.
Ileostomy and Colostomy 🚽
Procedures like ileostomy or colostomy, creating artificial anuses, are employed for various intestinal issues. Patients with ostomies generally follow regular diets, with adjustments based on stoma output. High-output ostomies necessitate specific dietary precautions to manage fluid levels. Nutritional assessment’s crucial role in surgical outcomes emphasizes the growing interest in tailored preoperative nutritional support and the potential resurgence of parenteral nutrition.
Conclusion 🩺💡
Understanding the intricate dance between surgical interventions and nutritional considerations is paramount for surgeons and medical practitioners. As regulatory scrutiny intensifies, the role of nutrition in preventing complications and improving outcomes will likely take center stage, emphasizing the importance of personalized nutritional strategies in the surgical journey. 🌟💪
Tubes and Drains
Unlocking the World of Tubes and Drains in Medical Practice 🩹
Understanding the diverse array of tubes and drains is crucial for any medical practitioner, and it all begins with appreciating the French size system, where the outer diameter of a catheter is denoted. A quick calculation (French size multiplied by 0.33) reveals the catheter’s outer diameter in millimeters.
Gastrointestinal Tract Tubes 🍽️
Starting with nasogastric tubes designed to evacuate gastric contents, these are frequently employed in patients facing ileus or obstruction. Modern nasogastric tubes often incorporate a sump function, preventing suction locks and enhancing efficiency. Nonsump tubes, though less common, may be used for intermittent suction. Nasogastric tubes also serve in feeding, with soft, fine-bore tubes being preferred for this purpose. Nasoenteric tubes, intended for feeding, require careful attention to safety during instillation.
Nasobiliary tubes, often placed endoscopically, aid in biliary drainage in cases of obstruction or fistula. T-tubes within the common bile duct ensure closed gravity drainage. Gastrostomy tubes, placed surgically or via percutaneous endoscopic gastrostomy (PEG), find utility in drainage or feeding. Jejunostomy tubes, inserted surgically or endoscopically, are vital for long-term nutritional access.
Respiratory Tract Tubes 🫁
Chest tubes play a pivotal role in pleural cavity drainage, addressing issues like pneumothorax, hemothorax, or effusion. The three-bottle system facilitates constant suction, drainage, and prevention of air entry, crucial for maintaining a water seal.
Endotracheal tubes, cuffed for a secure tracheal seal, cater to short-term mechanical ventilation needs in adults. Tracheotomy tubes, directly inserted into the trachea through the neck, become essential for prolonged mechanical ventilation or when maintaining a patent airway is challenging.
Urinary Tract Tubes 🚰
Bladder catheters, commonly known as “Foley” catheters, serve to straight drain urine. Nephrostomy tubes, placed in the renal pelvis, drain urine above obstructions or delicate ureteral anastomoses. Percutaneously placed tubes, often pigtail catheters, assist in draining abscesses, typically guided by interventional radiologists.
Surgical Drains 🌡️
Closed suction drains, such as Jackson-Pratt and Hemovac, prove invaluable for evacuating fluid collections during surgery. Sump suction drains, like Davol drains, are larger and designed for continuous suction in scenarios with thick or particulate drainage. Passive tubes, exemplified by Penrose drains, offer a pathway for fluid without applied suction, serving as a two-way conduit for bacteria. Understanding these various tubes and drains is pivotal for medical practitioners navigating complex clinical scenarios. 💉💊
The Geriatric Patient
Navigating Surgical Challenges in an Aging Population: A Delicate Balance 🌐
The ongoing aging process within the American population brings forth a set of unique challenges that surgeons must adeptly navigate for decades to come. Elderly individuals, compared to their younger counterparts, often exhibit diminished physiological reserves. Their health is frequently influenced by medications that can alter normal physiological responses, such as β-blockers, or impact surgical outcomes, like warfarin or platelet aggregation–inhibiting agents. Additionally, baseline impairments, ranging from sensory issues to difficulties in ambulation or dementia, may complicate their ability to engage in everyday activities.
One perplexing dilemma faced by surgeons when caring for elderly patients revolves around the decision to pursue an aggressive intervention plan. Transparent communication between the patient and physician is paramount in determining the appropriate level of aggressiveness in the patient’s best interest. This conversation takes on heightened significance in the elderly population. Engaging in repeated discussions with patients and their families, starting before surgery and extending into the postoperative phase, is crucial. Generally, patients express a desire for aggressive medical care as long as there remains a reasonable chance for meaningful survival.
While these discussions may be uncomfortable, they are as integral to the patient’s care as any aspect of their medical history. It is imperative to recognize that surgical care is provided by individuals who genuinely care about the patient’s overall well-being. In certain situations, medical care may prioritize alleviating pain over prolonging life. Ideally, these conversations should occur in a serene and comfortable setting, free from distractions.
Moreover, it is essential to underscore that discussions about end-of-life matters are not legal proceedings. No forms need to be signed. These discussions are akin to any other conversation between a doctor and a patient regarding their care. The dialogue involves a careful consideration of the strengths and weaknesses of different approaches until a collaborative plan of action is determined. The only distinction lies in the profound nature of end-of-life discussions, offering patients the best opportunity to shape their destinies. Consequently, these discussions should be approached with the utmost reverence, acknowledging the gravity of the subject matter. 🤝💙
Estabelecendo Conexões Essenciais 💬
Técnicas de Entrevista na Medicina: Estabelecendo Conexões Essenciais 💬
A relação médico-paciente é uma parte vital do cuidado cirúrgico. O vínculo entre o cirurgião e o paciente deve ser construído, mantido e valorizado. Boas técnicas de entrevista são fundamentais para estabelecer essa relação. O alicerce para uma boa entrevista advém de uma preocupação genuína com as pessoas. Embora existam habilidades de entrevista que podem ser aprendidas, a qualidade da interação pode ser aprimorada. Estudantes de medicina devem reconhecer seu papel especial no cuidado do paciente, não se envergonhando de sua posição e compreendendo que são membros eficazes da equipe. Pacientes frequentemente veem os estudantes de medicina como acessíveis, compartilhando detalhes que poderiam ocultar de membros mais seniores da equipe. O papel do estudante é descobrir as queixas médicas principais do paciente, realizar uma história e exame físico focalizados e apresentar os achados à equipe. Uma entrevista eficaz requer a comunicação sobre quem você é e como se encaixa na equipe. 🏥
Desafios da Entrevista na Medicina: Adaptando-se a Diferentes Ambientes 🌐
Entrevistar bem pode ser desafiador devido à variedade de ambientes, como sala de cirurgia, unidade de terapia intensiva, consultório particular, leito hospitalar, sala de emergência e ambulatório. Cada ambiente apresenta desafios únicos à comunicação eficaz. Para construir boas relações médico-paciente, cirurgiões ajustam seus estilos a cada ambiente e à personalidade e necessidades de cada paciente. Algumas regras básicas são comuns a todas as entrevistas profissionais. A primeira regra é deixar claro ao paciente que, durante a história e o exame, nada além de uma emergência de vida ou morte terá maior importância do que a interação entre o cirurgião e o paciente naquele momento. Este é o primeiro e melhor momento para conectar-se com o paciente. É crucial que o paciente compreenda que um cirurgião cuidadoso, conhecedor e dedicado será seu parceiro na jornada pelo tratamento de doenças cirúrgicas. O cirurgião deve observar outras regras, incluindo dar atenção adequada à aparência pessoal para transmitir uma imagem profissional que inspire confiança, estabelecer contato visual, comunicar interesse, calor e compreensão, ouvir de forma não julgadora, aceitar o paciente como pessoa, ouvir a descrição do problema do paciente e ajudar o paciente a se sentir confortável na comunicação. 👩⚕️👨⚕️
Primeiros Minutos: Estabelecendo uma Base Sólida 🤝
Ao receber o paciente em um ambiente ambulatorial, os primeiros minutos são dedicados a cumprimentar o paciente pelo nome formal, apertar as mãos, se apresentar e explicar o papel do cirurgião. A atenção à privacidade do paciente, ajustando o estilo de conversação e o vocabulário às necessidades do paciente, descobrindo a atitude do paciente em relação à clínica, conhecendo a ocupação do paciente e entendendo o que o paciente sabe sobre sua condição são passos fundamentais. A seguir, ocorre a exploração do problema, movendo-se de perguntas abertas para perguntas fechadas. Técnicas importantes incluem o uso de transições, fazer perguntas específicas e claras e reformular o problema para verificação. É crucial determinar se o paciente tem alguma pergunta. No final da entrevista, o cirurgião explica quais serão os próximos passos e que realizará um exame no paciente. Por fim, verifica-se se o paciente está confortável. 🌟
Diferenças nos Ambientes de Atendimento: Adaptação e Compreensão 🏨
As técnicas utilizadas em ambientes ambulatoriais são igualmente adequadas para encontros em ambientes hospitalares e de pronto-socorro. Geralmente, mais tempo é dedicado ao paciente nas entrevistas iniciais e subsequentes do que em um ambiente ambulatorial. Na entrevista inicial, os pacientes podem estar com dor, preocupados com problemas financeiros e ansiosos com a falta de privacidade ou dietas desagradáveis. Eles também podem ter dificuldade para dormir, sentir medo do tratamento ou se sentir impotentes. É importante comunicar gentil e confiantemente o propósito da entrevista e quanto tempo levará. O paciente não apenas escuta, mas também observa o comportamento e a vestimenta do médico. O ambiente também afeta a entrevista. Por exemplo, um ambiente apertado, barulhento e lotado pode afetar a qualidade da comunicação. Pacientes podem ter sentimentos negativos devido a insensibilidades por parte do médico ou de outras pessoas. É fundamental evitar falar com o paciente na entrada do quarto, dar ou receber informações pessoais em um ambiente lotado, falar sobre um paciente em um elevador ou em outro espaço público, ou falar com um paciente sem fechar a cortina em uma enfermaria. 🌆
Conclusão: Construindo Relações de Confiança na Medicina 🌐
Em resumo, dominar as técnicas de entrevista na medicina é essencial para construir relações sólidas entre médico e paciente. Os cirurgiões habilmente ajustam suas abordagens a diferentes ambientes e personalidades dos pacientes, aplicando regras básicas universais. Os primeiros minutos são cruciais para estabelecer uma base sólida, enquanto a exploração cuidadosa do problema requer uma transição de perguntas abertas para fechadas. Adaptações ao ambiente e compreensão das preocupações do paciente são vitais para uma comunicação eficaz. Ao incorporar essas técnicas, os médicos podem garantir que a interação médico-paciente seja centrada no paciente, transmitindo confiança e dedicação à jornada conjunta pelo tratamento. 👨⚕️🤝👩⚕️
Timing of Elective Surgery after #COVID19 Infection
The options to clear a recovered COVID-19 patient for surgery could be a symptom or test-based strategy. The studies recommend a hybrid strategy until more information is available. Surgical procedures should be delayed if possible for 4–6 weeks. The scientific data recommend against routine testing in this group as patients are likely not infectious any-more and risk of airway reactivity or ARDS will be reduced. Between 2 and 4 weeks after symptom onset, scientific data recommend a test-based strategy due to insufficient data that recovered COVID patients are completely uninfectious. Data from China suggest that patients with severe symptoms have higher viral burden and prolonged viral shedding. For surgery completion<2 weeks after COVID-19 symptoms or diagnosis, scientific data recommend no testing and operating under COVID isolation precautions in the operating room. Immunocompromised patients are likely to shed longer and may be at higher risk of other infectious or pulmonary complications. The scientific data suggest individualized case-based decisions by involved providers until more information is available.
Liver Disease and Perioperative Risk
The liver is the biggest intestinal organ and plays a central role in the homeostasis of different physiological systems including nutrition and drug metabolism, the synthesis of plasma proteins and haemostatic factors, as well as the elimination of different endogenous and exogenous substances. Although the liver contributes with only 3% to total body weight, given its major role in homeostasis and high energy consumption, it receives 25% of total cardiac output (CO). Two vessels contribute to the perfusion of the liver. The majority (70%) of the hepatic perfusion is provided by the portal vein, which contributes 50% of the organ’s oxygen demand. The other 50% is provided by the hepatic artery, which makes up around 30% of total liver perfusion. Hepatic arterial blood flow is mainly dependent on the organ’s metabolic demands and controlled via autoregulatory mechanisms, whereas blood supply through the portal vein depends on the perfusion throughout the whole gastrointestinal tract and the spleen. This unique, dual perfusion system provides constant perfusion rates and oxygen supply, which is crucial for adequate liver function. These high oxygen demands are reflected in a hepatic vein saturation of almost 30%.
The liver is also unique in its ability of regeneration, which allows the performance of major surgery including, amongst others, extended resections of liver tumours, living donations and so on. Many patients have normal liver function parameters when they present for liver surgery, especially when the reason for resection is metastasis or a benign liver tumour. The most common causes of liver resections are the hepatocellular carcinoma (HCC) and the cholangiocellular carcinoma (CCC). Hepatocellular carcinoma (HCC) often develops in patients with underlying liver cirrhosis; many of these patients show signs of chronic liver dysfunction (CLD).
As explained previously, the liver plays a central role in a great deal of physiological systems. Therefore, in case of chronic liver dysfunction (CLD) or liver failure, several effects on other organ systems have to be expected. Consequently liver resections and bile duct surgery as having a high risk for perioperative cardiac events, with an estimated 30-day cardiac event rate (cardiac death and myocardial infarction) of more than 5%. Patients undergoing liver surgery pose a significant challenge to treating physicians in the perioperative period. Due to the improvement of surgical techniques, the “liver patient” is becoming more and more complex, confronting surgeons, anaesthetists and intensive care personnel with difficult intra- and postoperative courses, and considerable multiorgan disorders. The cornerstones of an optimal management are careful selection of the patients, appropriate monitoring and protection of the liver and other vital organs.
Biliary Tree Vascularization
The gallbladder lies at the equator between the right and left hemiliver, an imaginary line known as Cantlie’s line or the Rex-Cantlie line coursing between segments 4b and 5, through the bed of the gallbladder towards the vena cava posteriorly. The gallbladder is mostly peritonealized, except for its posterior surface which lies on the cystic plate, a fibrous area on the underside of the liver.
The proportion if its circumference varies, from a pedicled gallbladder with little to no contact with the cystic plate to a mostly intrahepatic gallbladder surrounded by liver parenchyma. The gallbladder carries no muscularis mucosa, no submucosa, and a discontinuous muscularis and only carries a serosa on the visceral peritonealized surface. These anatomical specificities facilitate the direct invasion of gallbladder cancer into the liver. This is why the surgical treatment of gallbladder cancer mandates a radical cholecystectomy, which includes resection of a wedge of segments 4b and 5, when the T stage is higher or equal to T1b. From the body of the gallbladder, a conical infundibulum becomes a cystic duct that extends as the lower edge of the hepatocystic triangle towards the porta hepatis and joins with the common hepatic duct (CHD) to form the CBD. As in the rest of the biliary system, variation is the rule when it comes to the cystic duct confluence with the CHD. It can variably run parallel to it for a distance prior to inserting or spiral behind it and insert on its medial aspect. It can variably insert into the RHD or the RPD, the latter in 4% of livers and particularly when the RPD inserts into the CHD (i.e., below the left-right ductal confluence). This configuration is notorious for exposing the RPD to a risk of injury at the time of cholecystectomy. Rare variations of gallbladder anatomy, including gallbladder duplication and gallbladder agenesis, are also described but are rare. The CBD courses anterolaterally within the hepatoduodenal ligament, usually to the right of the hepatic artery and anterolaterally to the portal vein. However, hepatic arterial anatomy can vary, and when an accessory or replaced hepatic artery is present arising from the superior mesenteric artery, the accessory or replaced vessel courses lateral to the CBD. In its conventional configuration, the right hepatic artery crosses posteriorly to the RHD as it heads towards the right liver, but 25% of the time it crosses anteriorly. These anatomical variants are all relevant to developing a sound surgical strategy to treat hilar CCA. Of note, while left hepatic artery anatomy can also be quite variable, rarely does it affect surgical decision-making in CCA to the same degree as right hepatic artery anatomy.
Distally, the CBD enters the head of the pancreas, joining the pancreatic duct to form the hepatopancreatic ampulla. Just distal to this is the sphincter of Oddi, which controls emptying of ampullary contents into the second portion of the duodenum. When the junction of the CBD and the pancreatic duct occurs before the sphincter complex, reflux of pancreatic enzymes into the biliary tree can lead to chronic inflammatory changes and anatomical distortion resulting in choledochal cysts, known risk factors for the development of CCA. Unlike the rest of the liver parenchyma, which receives dual supply from the arterial and portal venous circulation, the biliary tree is exclusively alimented by the arterial system. The LHD and RHD are alimented respectively by the left hepatic artery and right hepatic artery, which can frequently display replaced, accessory, and aberrant origins – the left artery arising conventionally from the hepatic artery proper but alternatively from the left gastric artery and the right hepatic artery arising from the hepatic artery proper but also variably from the superior mesenteric artery. In hilar CCA, variable combinations of hepatic arterial anatomy and tumor location can either favor resectability or make a tumor unresectable.
Within the hilum of the liver, a plexus of arteries connects the right and left hepatic arteries. Termed the “hilar epicholedochal plexus,” this vascular network provides collateral circulation that can maintain arterial supply to one side of the liver if the ipsilateral vessel is damaged. The preservation of arterial blood supply to the liver remnant is crucial, particularly when creating an enterobiliary anastomosis. Its absence leads to ischemic cholangiopathy and liver abscesses that can be difficult to treat. The CBD receives arterial supply inferiorly from paired arterioles arising from the gastroduodenal artery and the posterior superior pancreaticoduodenal artery, the most important and constant arterial supply to the distal CBD. Proximally the CBD is alimented by paired arterioles of the right hepatic artery. These vessels, known as the marginal arteries, run in parallel to the CBD, laterally and medially to it. Denuding the CBD of this arterial supply risks stricture formation after choledochoenteric anastomosis.
#OzimoGama #TheSurgeon #DigestiveSurgery
References : https://bit.ly/3fOmcv2
Preoperative Biliary Drainage
The most common presenting sign for patients with malignancy of the periampullary region is obstructive jaundice. While a significant proportion of these patients will be asymptomatic, the deleterious systemic consequences of uncontrolled hyperbilirubinemia may still occur. Furthermore, symptoms such as pruritus can be debilitating and have a significant impact on the quality of life. Thus, some have advocated preoperative drainage of the biliary system in patients with resectable periampullary malignancies, given widespread availability of endoscopic retrograde cholangiopancreatography and its perceived safety profile. On the other hand, the purported benefits of routine preoperative drainage in this patient population (namely, resolution of symptoms in symptomatic patients while awaiting surgery, restoration of the enterohepatic cycle, and a potential decrease in postoperative morbidity) have proven to be largely theoretical, and now there are high-quality phase III data that demonstrate the deleterious effects of routine stenting. A seminal study originating from the Netherlands in 2010 evaluated this issue in the only modern randomized controlled trial to date evaluating preoperative endoscopic biliary decompression for these patients. In their multicenter study, they randomized 202 patients with newly diagnosed pancreatic head cancer and bilirubin levels between 2.3 and 14.6 mg/dL to preoperative biliary drainage for 4–6 weeks vs. immediate surgery which was to be performed within a week of enrollment. The primary endpoint was the development of serious complications within 120 days after randomization. Serious complications were defined as complications related to the drainage procedure or the surgical intervention that required additional medical, endoscopic, or surgical management, and that resulted in prolongation of the hospital stay, readmission to the hospital, or death. The reported overall rate of serious complications in this study favored the immediate surgery group (39 vs. 74%; RR 0.54–95% [CI], 0.41–0.71; P < 0.001), complications related to surgery were equivalent (37 vs. 47%; P = 0.14), and there was no difference in mortality rates or length of hospital stay. The observed drainage-related complications included a 15% rate of stent occlusion, 30% need for exchange, and 26% incidence of cholangitis.
“Based on these results, the authors concluded that the morbidity associated with the drainage procedure itself had an additive effect on the postoperative morbidity of patients undergoing pancreatic head resection for cancer and recommended against its routine use in this population.“
A Cochrane systematic review of all available randomized studies (including the abovementioned study by van der Gaag et al.) evaluating preoperative biliary drainage was published in 2012. In this study, Fang et al. assessed the impact of this intervention on survival, serious morbidity (defined as Clavien-Dindo grade 3 or 4), and quality of life. Furthermore, they sought to assess differences in total length of hospital stay and cost. They identified six randomized trials of which four used percutaneous transhepatic biliary drainage and the remaining two used endoscopic sphincterotomy and stenting. The pooled analysis of 520 patients (of which 51% underwent preoperative biliary drainage) showed no difference in mortality, but importantly, it showed a significantly higher incidence of serious morbidity in the preoperative drainage group with a rate ratio (RaR) of 1.66 (95% CI 1.28–2.16;P = 0.002). There was no difference in length of hospital stay and not enough data reported for analysis of cost or quality of life.
“Based on the available level 1 data, the authors concluded that there was no evidence to support or refute routine preoperative biliary drainage in patients with obstructive jaundice.“
However, this review also underscored the fact that preoperative biliary drainage may be associated with an increased rate of adverse events and thus questioned the safety of this practice. This Cochrane review included old studies that evaluated patients undergoing percutaneous drainage, a technique used less frequently today for periampullary malignancies. Furthermore, several of these trials included patients with hilar and other types of biliary obstruction. However, the concept of preoperative decompression, as well as its purported benefits and observed results, may be reasonably extrapolated to patients with periampullary lesions.
Critical View Of Safety
“The concept of the critical view was described in 1992 but the term CVS was introduced in 1995 in an analytical review of the emerging problem of biliary injury in laparoscopic cholecystectomy. CVS was conceived not as a way to do laparoscopic cholecystectomy but as a way to avoid biliary injury. To achieve this, what was needed was a secure method of identifying the two tubular structures that are divided in a cholecystectomy, i.e., the cystic duct and the cystic artery. CVS is an adoption of a technique of secure identification in open cholecystectomy in which both cystic structures are putatively identified after which the gallbladder is taken off the cystic plate so that it is hanging free and just attached by the two cystic structures. In laparoscopic surgery complete separation of the body of the gallbladder from the cystic plate makes clipping of the cystic structures difficult so for laparoscopy the requirement was that only the lower part of the gallbladder (about one-third) had to be separated from the cystic plate. The other two requirements are that the hepatocystic triangle is cleared of fat and fibrous tissue and that there are two and only two structures attached to the gallbladder and the latter requirements were the same as in the open technique. Not until all three elements of CVS are attained may the cystic structures be clipped and divided. Intraoperatively CVS should be confirmed in a “time-out” in which the 3 elements of CVS are demonstrated. Note again that CVS is not a method of dissection but a method of target identification akin to concepts used in safe hunting procedures. Several years after the CVS was introduced there did not seem to be a lessening of biliary injuries.
Operative notes of biliary injuries were collected and studied in an attempt to determine if CVS was failing to prevent injury. We found that the method of target identification that was failing was not CVS but the infundibular technique in which the cystic duct is identified by exposing the funnel shape where the infundibulum of the gallbladder joins the cystic duct. This seemed to occur most frequently under conditions of severe acute or chronic inflammation. Inflammatory fusion and contraction may cause juxtaposition or adherence of the common hepatic duct to the side of the gallbladder. When the infundibular technique of identification is used under these conditions a compelling visual deception that the common bile duct is the cystic duct may occur. CVS is much less susceptible to this deception because more exposure is needed to achieve CVS, and either the CVS is attained, by which time the anatomic situation is clarified, or operative conditions prevent attainment of CVS and one of several important “bail-out” strategies is used thus avoiding bile duct injury.
CVS must be considered as part of an overall schema of a culture of safety in cholecystectomy. When CVS cannot be attained there are several bailout strategies such a cholecystostomy or in the case of very severe inflammation discontinuation of the procedure and referral to a tertiary center for care. The most satisfactory bailout procedure is subtotal cholecystectomy of which there are two kinds. Subtotal fenestrating cholecystectomy removes the free wall of the gallbladder and ablates the mucosa but does not close the gallbladder remnant. Subtotal reconstituting cholecystectomy closes the gallbladder making a new smaller gallbladder. Such a gallbladder remnant is undesirable since it may become the site of new gallstone formation and recurrent symptoms . Both types may be done laparoscopically.”
Strasberg SM, Hertl M, Soper NJ. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. J Am Coll Surg 1995;180:101-25.
Surgical Management of GERD After Sleeve Gastrectomy
Evaluation of a patient referring GERD after sleeve gastrectomy should start with a detailed history and physical examination; the presence or absence of GERD-related symptoms should be thoroughly documented as well as any prior treatments or therapy used to treat it. Obtaining preoperative and operative records is of paramount importance particularly in those patients who had their index procedure performed elsewhere. Any endoscopic findings and prior imaging available are important to determine what the best course of action would be. If the patient had preoperative and postoperative imaging such as UGI, it is useful to compare those with a recent study to look for anatomical problems that may have been not addressed at the time of the index operation or developed over time. After this information is obtained, we can classify the GERD after sleeve as:
1. De novo GERD
2. Preexisting GERD without improvement
3. Preexisting GERD with worsening/complication
Regardless of how we classify the GERD, an initial evaluation with imaging
studies such as UGI and EGD is recommended. Comparison with any prior films if available is of significant value. Based on the UGI, we can determine if the shape of the sleeve falls into one of the following categories: tubular, dilated bottom, dilated upper, or dumbbell-shaped sleeve; we will also be able to evaluate esophageal peristalsis in real time and if there is associated hiatal hernias. We believe UGI under fluoroscopy provides important physiologic and anatomic information that can help guide our management approach, and therefore we offer it to all patients. We follow the radiologic evaluation with endoscopy, and during endoscopy, we look for objective signs of reflux such as esophagitis, presence of bile in the stomach or esophagus, as well as missed or recurrent hiatal hernias. In patients with evidence of esophagitis or metaplasia, multiple biopsies are taken. During the endoscopy, subtle findings that suggest a kink or a stricture may be present. In the absence of objective signs of gastroesophageal reflux disease on both endoscopy and upper GI series, we pursue physiologic testing followed by highresolution manometry and pH monitoring. In those patients where clear reflux esophagitis is seen, this additional testing may not be necessary or may be performed in selected cases depending on what the surgical or endoscopic therapy would be.

While it is true that most sleeve-related GERD will be effectively treated with a conversion to Roux-en-Y gastric bypass, not every patient with GERD after reflux will require a bypass or would agree to have one. First key step in addressing the patient is to evaluate whether the patient was selected appropriately to have a sleeve and second is to determine the exact sleeve anatomy; are there anatomical factors that will make it more likely for this patient to experience reflux; is there dilated fundus? Is there a kink or stricture in the sleeve or is it an anatomically appropriate operation? We should pay important attention to the weight loss the patient has experienced with the sleeve. Patients who do not have adequate weight loss and have GERD symptoms should not undergo other therapies and should probably undergo a bypass; however it is our unpublished experience that patients with the association of poor weight loss after sleeve and difficult to treat GERD will correct their GERD after conversion, but their weight loss results are still marginal even with a well-constructed bypass.
Medically-Necessary, Time Sensitive: (MeNTS) Score
Operating During The COVID-19 Coronavirus Pandemic
“At the University of Chicago, members of the Department of Surgery decided to investigate this issue more precisely. As stay-at-home restrictions in some states are easing, and as non-emergency medical care is being reconsidered, how does one possibly triage the thousands upon thousands of patients whose surgeries were postponed? Instead of the term “elective,” the University of Chicago’s Department of Surgery chose the phrase “Medically-Necessary, Time Sensitive” (MeNTS). This concept can be utilized to better assess the acuity and safety when determining which patients can get to the operating room in as high benefit/low risk manner as possible. And unlike in any recent time in history, risks to healthcare staff as well as risks to the patient from healthcare staff, are now thrown into the equation. The work was published in the April issue of the Journal of the American College of Surgeons.
On March 17, 2020, the American College of Surgeons recommended that all “elective” surgeries be canceled indefinitely. These guidelines were published, stating that only patients with “high acuity” surgical issues, which would include aggressive cancers and severely symptomatic disease, should proceed. Based on the Elective Surgery Acuity Scale (ESAS), most hospitals were strongly encouraged to cancel any surgery that was not high acuity, including slow-growing cancers, orthopedic and spine surgeries, airway surgeries, and any other surgeries for non-cancerous tumors. Heart surgeries for stable cardiac issues were also put on hold. Patients and surgeons waited. Some patients did, indeed undergo non-Covid-19-related surgeries. But most did not. Redeployment is gradually turning to re-entry.
The re-entry process for non-urgent (yet necessary) surgeries is a complicated one. Decisions and timing, based on a given hospital’s number and severity of Covid-19 patients, combined with a given city or state’s current and projected number of Covid-19 cases, how sick those patients will be, and whether or not a second surge may come, involves a fair amount of guesswork. As we have all seen, data manipulation has become a daily sparring match in many arenas. The authors of the study created an objective surgical risk scoring system, in order to help hospitals across this country, as well as others across the world, better identify appropriate timing regarding which surgeries can go ahead sooner rather than later, and why. They factored several variables into their equation, to account for the multiple potential barriers to care, including health and safety of hospital personnel. They created scoring systems based on three factors: Procedure, Disease and Patient Issues.
CALCULATE MeNTS SCORE HERE
The authors of the study created an objective surgical risk scoring system, in order to help hospitals across this country, as well as others across the world, better identify appropriate timing regarding which surgeries can go ahead sooner rather than later, and why. They factored several variables into their equation, to account for the multiple potential barriers to care, including health and safety of hospital personnel. Each patient would receive an overall conglomerate score, based on all of these factors, with the lower risks giving them more favorable scores to proceed with surgery soon, and the higher risks giving patients a higher score, or higher risk regarding proceeding with surgery, meaning it may be safest, for now, to wait.
Dr. Jeffrey Matthews, senior author of the paper, and Department Chair at the University of Chicago, stated that this model is reproducible across hospital systems, in urban, rural, and academic settings. And in the event of potential unpredictable surges of Covid-19 cases, the scoring system “helps prioritize cases not only from the procedure/disease standpoint but also from the pandemic standpoint with respect to available hospital resources such as PPE, blood, ICU beds, and [regular hospital] beds.”
The scoring system is extremely new, and the coming weeks will reveal how patients, surgeons and hospitals are faring as patients without life-and-death emergencies and/or Covid-19 complications gradually begin filling the operating rooms and hospital beds. In addition, and perhaps just as important, the study authors note that creating systems whereby healthcare resources, safety, and impact on outcomes need to be considered more carefully for each patient intervention, the larger impact of each intervention on public health will be better understood: not only for today’s pandemic, but also in future, as yet unknown, global events.”
Source: Nina Shapiro, 2020
Discover our surgical video channel and lectures associated with the surgeon blog.
Share and Join: https://linktr.ee/TheSurgeon
Covid-19 and Digestive Surgery
The current world Covid-19 pandemic has been the most discussed topic in the media and scientific journals. Fear, uncertainty, and lack of knowledge about the disease may be the significant factors that justify such reality. It has been known that the disease presents with a rapidly spreading, it is significantly more severe among the elderly, and it has a substantial global socioeconomic impact. Besides the challenges associated with the unknown, there are other factors, such as the deluge of information. In this regard, the high number of scientific publications, encompassing in vitro, case studies, observational and randomized clinical studies, and even systematic reviews add up to the uncertainty. Such a situation is even worse when considering that most healthcare professionals lack adequate knowledge to critically appraise the scientific method, something that has been previously addressed by some authors. Therefore, it is of utmost importance that expert societies supported by data provided by the World Health Organization and the National Health Department take the lead in spreading trustworthy and reliable information.
Discover our surgical video channel and lectures associated with the surgeon blog.
Share and Join: https://linktr.ee/TheSurgeon
#Medicine #Surgery #GeneralSurgery #DigestiveSurgery
#TheSurgeon #OzimoGama
Bariatric Surgery During the COVID-19 Pandemic
Coronavirus disease 2019 (COVID-19) emerged in Wuhan City and rapidly spread throughout China and around the world since December 2019. The World Health Organization (WHO) declared the COVID-19 outbreak a global pandemic on 11 March 2020. Patients with metabolic disorders like cardiovascular diseases, diabetes and obesity may face a greater risk of infection of COVID-19 and it can also greatly affect the development and prognosis of pneumonia.

“A higher cumulative MeNTS score, which can range from 21 to 105, is associated with poorer perioperative patient outcome, increased risk of COVID-19 transmission to the health care team, and/or increased hospital resource utilization. Given the need to maintain OR capacity for trauma, emergency, and highly urgent cases, an upper threshold MeNTS score can be designated by surgical and perioperative leadership based on the immediately anticipated conditions and resources at each institution.”
GENERAL RECOMMENDATIONS
All elective surgical and endoscopic cases for metabolic and bariatric surgery should be postponed during the pandemic. This minimises risks to both patient and healthcare team, as well as reducing the utilisation of unnecessary resources, such as beds, ventilators and personal protective equipment (PPE). In addition, postponing these services will minimise potential exposure of the COVID-19 virus to unsuspecting healthcare providers and patients. As the long-term effects or complications of COVID-19 are still unknown, metabolic and bariatric surgeries for patients who were diagnosed and recovered from COVID-19 should be evaluated by a multidisciplinary team. Diet and lifestyle modifications should be advised before surgical treatment.
More information on link below
IFSO RECOMMENDATIONS
Discover our surgical video channel and lectures associated with the surgeon blog.
Share and Join: https://linktr.ee/TheSurgeon
#Medicine #Surgery #GeneralSurgery #DigestiveSurgery
#TheSurgeon #OzimoGama
Laparoscopic JEJUNOSTOMY
Many oncological patients with upper gastrointestinal (GI) tract tumours, apart from other symptoms, are malnourished or cachectic at the time of presentation. In these patients feeding plays a crucial role, including as part of palliative treatment. Many studies have proved the benefits of enteral feeding over parenteral if feasible. Depending on the tumour’s location and clinical stage there are several options of enteral feeding aids available. Since the introduction of percutaneous endoscopic gastrostomy (PEG) and its relatively easy application in most patients, older techniques such as open gastrostomy or jejunostomy have rather few indications.
The majority of non-PEG techniques are used in patients with upper digestive tract, head and neck tumours or trauma that renders the PEG technique unfeasible or unsafe for the patient. In these patients, especially with advanced disease requiring neoadjuvant chemotherapy or palliative treatment, open gastrostomy and jejunostomy were the only options of enteral access. Since the first report of laparoscopic jejunostomy by O’Regan et al. in 1990 there have been several publications presenting techniques and outcomes of laparoscopic feeding jejunostomy. Laparoscopic jejunostomy can accompany staging or diagnostic laparoscopy for upper GI malignancy when the disease appears advanced, hence avoiding additional anaesthesia and an operation in the near future.
In this video the author describe the technique of laparoscopic feeding jejunostomy applied during the staging laparoscopy in patient with advanced upper gastrointestinal tract cancer with co-morbid cachexy, requiring enteral feeding and neoadjuvant chemotherapy.
Welcome and get to know our Social Networks through the following link
Ozimo Gama’s Social Medias
#AnatomiaHumana #CirurgiaGeral #CirurgiaDigestiva #TheSurgeon
Traqueostomia
Basicamente, existem quatro situações que indicam a realização de traqueostomia: prevenção de lesões laringotraqueais pela intubação translaríngea prolongada; desobstrução da via aérea superior, em casos de tumores, corpo estranho ou infecção; acesso à via aérea inferior para aspiração e remoção de secreções; e aquisição de via aérea estável em paciente que necessita de suporte ventilatório prolongado.
A substituição do tubo endotraqueal pela cânula de traqueostomia ainda acrescenta benefícios, proporcionando conforto e segurança do paciente. Algumas sociedades americanas sugerem que a traqueostomia deva ser sempre considerada para pacientes que necessitarão de ventilação mecânica prolongada, ou seja, por mais de 14 dias.
Muitas vezes, a decisão de se realizar uma traqueostomia é tomada pelo julgamento clínico de médicos, principalmente aqueles que trabalham em unidades de terapia intensiva. Isso envolve a análise de múltiplos fatores, tais como as características de cada paciente, o motivo pelo qual ocorreu a intubação, doenças associadas, resposta ao trata-mento e prognóstico individualizado. Embora haja uma tendência de indicação de traqueostomia precoce em pacientes neurocríticos e com trauma grave.
Benefícios Clínicos:
- Diminuição do trabalho respiratório
- Melhora da aspiração das vias aéreas
- Permitir a fonação
- Permitir a alimentação por via oral
- Menor necessidade de sedação
- Redução do risco de pneumonia associada à ventilação
mecânica - Diminuição do tempo de ventilação mecânica
- Diminuição do tempo de internação em unidades de terapia
intensiva - Redução da mortalidade
Enhanced Recovery After Liver Surgery
The first postoperative fast-track protocols, also called “enhanced recovery after surgery” (ERAS), were instituted by colorectal surgeons almost three decades ago in order to modulate surgical stress and hasten recovery. Since then, the implementation of enhanced recovery programs has had an exponential expansion across most surgical specialties, including gynecology, urology, breast, vascular, and orthopedic surgery.
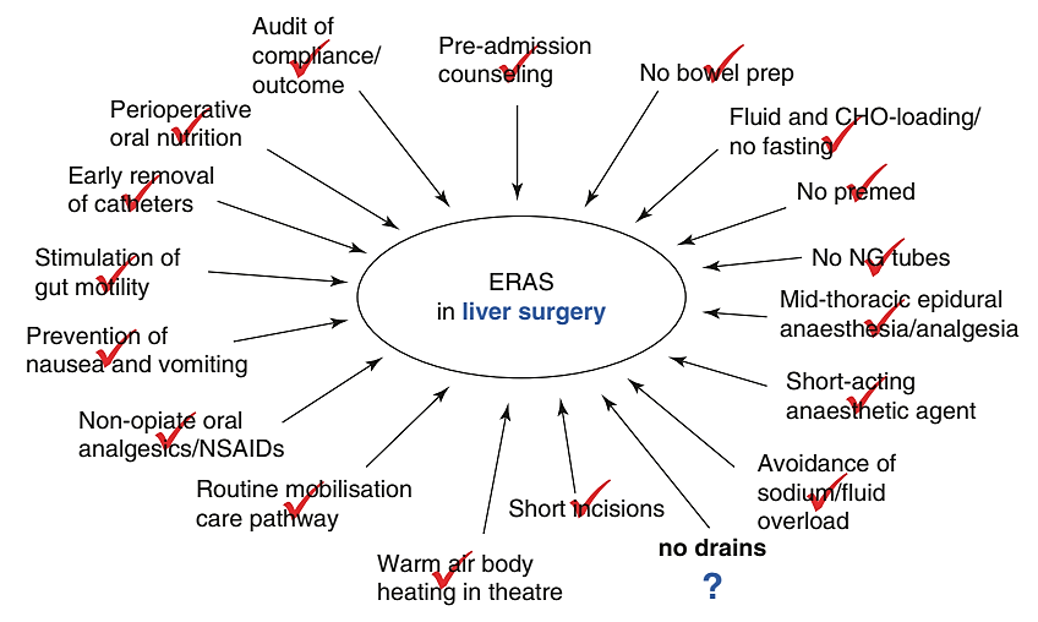
“Enhanced recovery after liver surgery” (ERLS) was first introduced in 2008 and has incrementally gained acceptance as being an integral part of perioperative care for hepatectomy patients. Several outcome metrics have shown to be improved with the adoption of a multimodal evidencebased strategy in liver surgery, many of which are also shared by other surgical specialties practicing in an enhanced recovery framework.
Improved clinical outcomes such as length of stay, morbidity rates, and hospital costs tend to support implementation of fast-track programs in general, but other metrics specific to liver surgery and to patients with colorectal liver metastases (CLM) further endorse this strategy when managing CLM. The implementation of an ERLS program represents a collaborative approach in which the different team players, including anesthesia, surgery, nutrition, pharmacy, nursing, and most importantly the patient and his/her family, engage actively in the perioperative pathway, in an evidence-based, patient-centered approach. The development of such programs also requires dedicated continuing education for the team members, flexibility in terms of perioperative management and decisionmaking by the health-care providers, support from the hospital administration, and systematic quality control measures to ensure implementation and accurate reporting. This review study the different core elements of ERLS and discuss different outcomes associated with this system-based approach, with an emphasis on oncological patients.
Interference with oncological treatment plans can negatively affect patients’ longterm outcomes but can also be detrimental to quality of life and overall functional status. Patient-reported outcomes (PROs) attempt to capture the patients’ perspective for a given intervention or treatment strategy, which are particularly important in oncological patients. Day et al. reported that the implementation of ERLS was beneficial for patients in terms of functional recovery, and although no significant differences were detected in terms of symptom burden, the impact of ERLS was shown to accelerate functional recovery by returning to baseline interference earlier. This positive effect from ERLS seems more pronounced in patients undergoing open hepatectomy over those already benefiting from minimally invasive surgery.
Ischaemic Preconditioning applied to LIVER SURGERY
- INTRODUCTION
The absence of oxygen and nutrients during ischaemia affects all tissues with aerobic metabolism. Ischaemia of these tissues creates a condition which upon the restoration of circulation results in further inflammation and oxidative damage (reperfusion injury). Restoration of blood flow to an ischaemic organ is essential to prevent irreversible tissue injury, however reperfusion of the organ or tissues may result in a local and systemic inflammatory response augmenting tissue injury in excess of that produced by ischaemia alone. This process of organ damage with ischaemia being exacerbated by reperfusion is called ischaemia-reperfusion (IR). Regardless of the disease process, severity of IR injury depends on the length of ischaemic time as well as size and pre-ischaemic condition of the affected tissue. The liver is the largest solid organ in the body, hence liver IR injury can have profound local and systemic consequences, particularly in those with pre-existing liver disease. Liver IR injury is common following liver surgery and transplantation and remains the main cause of morbidity and mortality.
2. AETIOLOGY
The liver has a dual blood supply from the hepatic artery (20%) and the portal vein (80%). A temporary reduction in blood supply to the liver causes IR injury. This can be due to a systemic reduction or local cessation and restoration of blood flow. Liver resections are performed for primary or secondary tumours of the liver and carry a substantial risk of bleeding especially in patients with chronic liver disease. Significant blood loss is associated with increased transfusion requirements, tumour recurrence, complications and increased morbidity and mortality. Several methods of hepatic vascular control have been described in order to minimise blood loss during elective liver resection. The simplest and most common method is inflow occlusion by applying a tape or vascular clamp across the hepatoduodenal ligament (Pringle Manoeuvre). This occludes both the arterial and portal vein inflow to the liver and leads to a period of warm ischaemia (37 °C) to the liver parenchyma resulting in ‘warm’ IR injury when the temporary inflow occlusion is relieved. In major liver surgery, extensive mobilisation of the liver itself without inflow occlusion results in a significant reduction in hepatic oxygenation.

3. PATOPHYSIOLOGY and RISK FACTORS
A complex cellular and molecular network of hepatocytes, Kupffer cells, liver sinusoidal endothelial cells (LSEC), leukocytes and cytokines play a role in the pathogenesis of IR injury. In general, both warm and cold ischaemia share similar mechanisms of injury. Hepatocyte injury is a predominant feature of warm ischaemia, whilst endothelial cells are more susceptible to cold ischaemic injury. There are currently no proven treatments for liver IR injury. Understanding this complex network is essential in developing therapeutic strategies in prevention and treatment of IR injury. Identifying risk factors for IR injury are extremely important in patient selection for liver surgery and transplantation. The main factors are the donor or patient age, the duration of organ ischaemia, presence or absence of liver steatosis and in transplantation whether the donor organ has been retrieved from a brain dead or cardiac death donor.
4. PREVENTION and TREATMENT
There is currently no accepted treatment for liver IR injury. Several pharmacological agents and surgical techniques have been beneficial in reducing markers of hepatocyte injury in experimental liver IR, however, they are yet to show clinical benefit in human trials. The following is an outline of current and future strategies which may be effective in reducing the detrimental effects of liver IR injury in liver surgery and transplantation.
4.1 SURGICAL STRATEGIES
Inflow occlusion or portal triad clamping (PTC) can be continuous or intermittent; alternating between short periods of inflow occlusion and reperfusion. Intermittent clamping (IC) increases parenchymal tolerance to ischaemia. Hence, prolonged continuous inflow occlusion rather than short intermittent periods results in greater degree of post-operative liver dysfunction. IC permits longer total ischaemia times for more complex resections. Alternating between 15 min of inflow occlusion and 5 min reperfusion cycles can be performed safely for up to 120 min total ischaemia time. There is a potential risk of increased blood loss during the periods of no inflow occlusion. However, these intervals provide an opportunity for the surgeon to check for haemostasis and control small bleeding areas from the cut surface of the liver. The optimal IC cycle times are not clear, although intermittent cycles of up to 30 min inflow occlusion have also been reported with no increase in morbidity, blood loss or liver dysfunction compared to 15 min cycles. IC is particularly beneficial in reducing post-operative liver dysfunction in patients with liver cirrhosis or steatosis.
In liver surgery, IPC ( Ischaemic Preconditioning) involves a short period of ischaemia (10 min) and reperfusion (10 min) intraoperatively by portal triad clamping prior to parenchymal transection during which a longer continuous inflow occlusion is applied to minimise blood loss. It allows continuous ischaemia times of up to 40 min without significant liver dysfunction. However, the protective effect of IPC decreases with increasing age above 60 years old and compared to IC it is less effective in steatotic livers. Moreover, IPC may impair liver regeneration capacity and may not be tolerated by the small remnant liver in those with more complex and extensive liver resections increasing the risk of post-operative hepatic insufficiency.
In order to avoid direct ischaemic insult to the liver by inflow occlusion, remote ischaemic preconditioning (RIPC) has been used. RIPC involves preconditioning a remote organ prior to ischaemia of the target organ. It has been shown to be reduce warm IR injury to the liver in experimental studies. A recent pilot randomised trial of RIPC in patients undergoing major liver resection for colorectal liver metastasis used a tourniquet applied to the right thigh with 10 min cycles of inflation-deflation to induce IR injury to the leg for 60 min. This was performed after general anaesthesia prior to skin incision. A reduction in post-operative transaminases and improved liver function was shown without the use of liver inflow occlusion. These results are promising but require validation in a larger trial addressing clinical outcomes.
5. FUTURE PERSPECTIVES
Hepatic IR injury remains the main cause of morbidity and mortality in liver surgery and transplantation. Despite over two decades of research in this area, therapeutic options to treat or prevent liver IR are limited. This is primarily due to the difficulties in translation of promising agents into human clinical studies. Recent advances in our understanding of the immunological responses and endothelial dysfunction in the pathogenesis of liver IR injury may pave the way for the development of new and more effective and targeted pharmacological agents.