Engenharia de Prompt na Educação Médica
Dissecando a Nova Fronteira Tecnológica na Cirurgia Digestiva
1. A Evolução do Estetoscópio ao Algoritmo
A prática médica contemporânea atravessa uma metamorfose digital que exige mais do que a simples adaptação: exige o domínio da técnica. A ascensão dos Modelos de Linguagem Gerativa (GLMs), como o ChatGPT e o Google Bard, não representa apenas a disponibilidade de novos bancos de dados, mas sim uma mudança sísmica na síntese do conhecimento clínico. Neste contexto, a Engenharia de Prompt emerge como a competência estratégica definitiva para o médico do século XXI. Conforme definido por Heston e Khun (2023), trata-se de uma abordagem sistemática de comunicação com IAs para obter resultados de alta precisão. Não se trata de uma conversa informal, mas de uma instrumentação precisa da inteligência artificial.
Para compreendermos o “salto qualitativo” desta ferramenta, basta observar a evolução técnica: o GPT-1 (2018) operava com 117 milhões de parâmetros; o GPT-4 (2023) é estimado em 1 trilhão. Essa expansão colossal mudou o paradigma da simples busca por informação (o modelo “indexador”) para a síntese complexa de conhecimento. Para o cirurgião, isso significa que a IA deixou de ser um dicionário para se tornar um consultor de lógica, exigindo que a instrução dada pelo médico seja tão precisa quanto o plano de clivagem em uma dissecção oncológica.
Esta transição da intuição para a estrutura técnica é o que separa o uso recreativo da IA da sua aplicação acadêmica e clínica de alto nível.
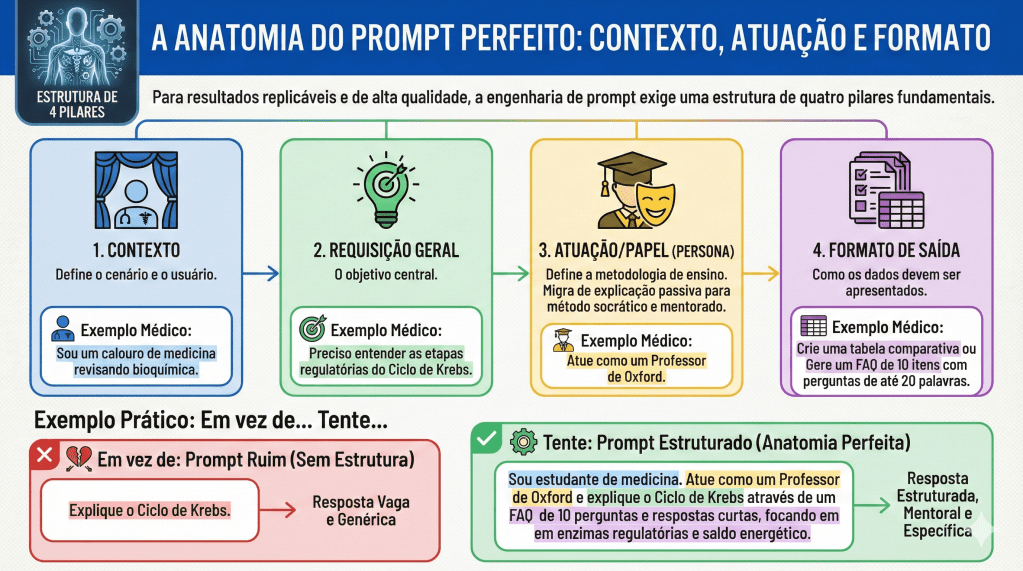
2. A Anatomia de um Prompt de Alta Precisão: Estrutura e Componentes
Na sala de operação, a improvisação é o terreno do erro; na Engenharia de Prompt, a vagueza é a raiz da alucinação. Estruturar uma entrada para a IA não é meramente fazer uma pergunta, mas sim redigir um protocolo de intenção. Podemos comparar a precisão de um prompt bem construído ao rigor técnico necessário em uma colecistectomia: cada componente tem seu “tempo cirúrgico” e função específica.
Para garantir resultados consistentes, um prompt estruturado deve conter quatro pilares fundamentais:
- Contexto: A descrição de quem está perguntando (ex: “Sou um preceptor de residência em cirurgia digestiva”).
- Solicitação Geral: O objetivo macro da interação (ex: “Necessito de uma revisão de condutas”).
- Persona/Papel: Como a IA deve se comportar (ex: “Atue como um Professor Titular de Gastroenterologia Cirúrgica”).
- Formato de Saída: A estrutura final do dado (ex: “Gere uma lista de verificação,” “tabela comparativa,” ou “resumo em tópicos”).
Comparativo de Eficiência: Prompts Vagos vs. Alta Precisão
| Tipo de Prompt | Exemplo Vago | Exemplo de Alta Precisão (Padrão Ouro) |
| Objetivo | Informação Geral | FAQ de Estadiamento Acadêmico |
| Entrada | “Fale sobre câncer gástrico.” | “Como Professor Doutor de Cirurgia, forneça um FAQ de 10 itens sobre o estadiamento do adenocarcinoma gástrico para residentes do R3. Foque no TNM 8ª edição, critérios de ressecabilidade e manejo perioperatório do paciente bariátrico. Entregue em formato de tabela.” |
| Resultado | Texto genérico e superficial. | Guia técnico, hierarquizado e pronto para discussão em round clínico. |
Essa estrutura permite que a IA realize uma triagem interna em seu vasto banco de parâmetros, ajustando o nível de complexidade para a realidade do interlocutor, seja ele um estudante de graduação ou um cirurgião experiente.
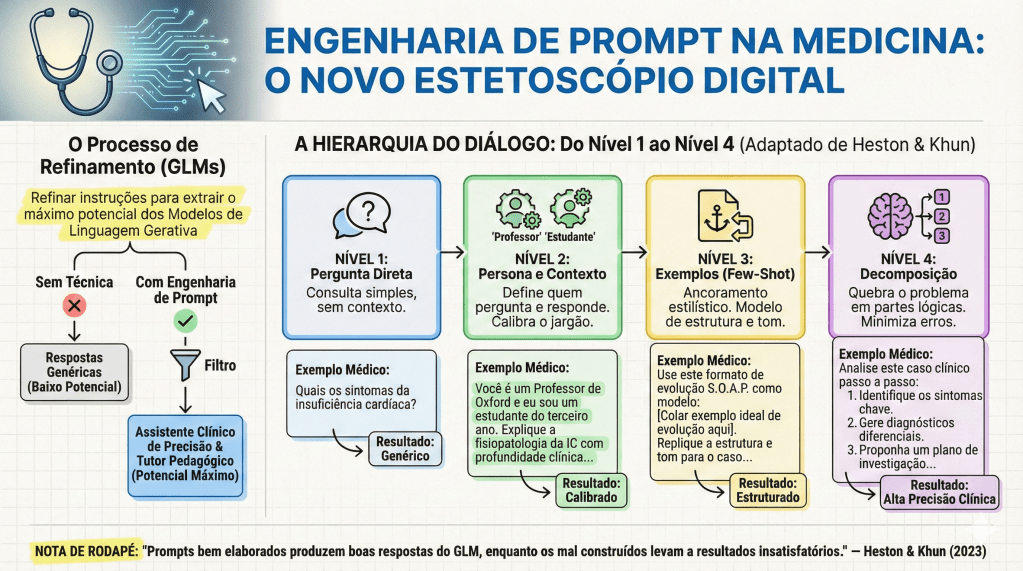
3. Níveis de Complexidade: Do Zero-Shot à Decomposição Lógica
No cotidiano acadêmico, a sofisticação da resposta da IA é diretamente proporcional à técnica de prompting utilizada. Podemos escalonar a interação em níveis que desafiam a capacidade de processamento do modelo:
- Zero-Shot vs. Few-Shot: O Zero-Shot é uma solicitação sem exemplos prévios. O Few-Shot é o fornecimento de modelos de comportamento dentro do prompt (ex: “Crie um caso clínico de isquemia mesentérica seguindo rigorosamente este modelo: [Exemplo]”).
- Hierarquia de Lawton (Níveis 1 a 4): Evoluímos de perguntas simples (Nível 1) até o Nível 4, definido como a desconstrução de solicitações complexas em componentes lógicos (Chain of Thought).
O impacto clínico mais relevante desta última técnica, ativada pelo comando “Pense passo a passo” (Think step by step), é a mitigação de erros catastróficos. Um exemplo clássico do texto de Heston e Khun (2023) ilustra isso: ao perguntar sobre um malabarista que tem 16 bolas, sendo que metade são bolas de golfe e metade das bolas de golfe são azuis, o GPT-3.0 pode falhar se responder instantaneamente. Ao ser instruído a pensar passo a passo, a IA decompõe o problema: total (16) -> metade são golfe (8) -> metade das de golfe são azuis (4). No ambiente cirúrgico, essa lógica é o que previne a iatrogenia em cálculos farmacológicos complexos ou em lógicas de estadiamento multinível.
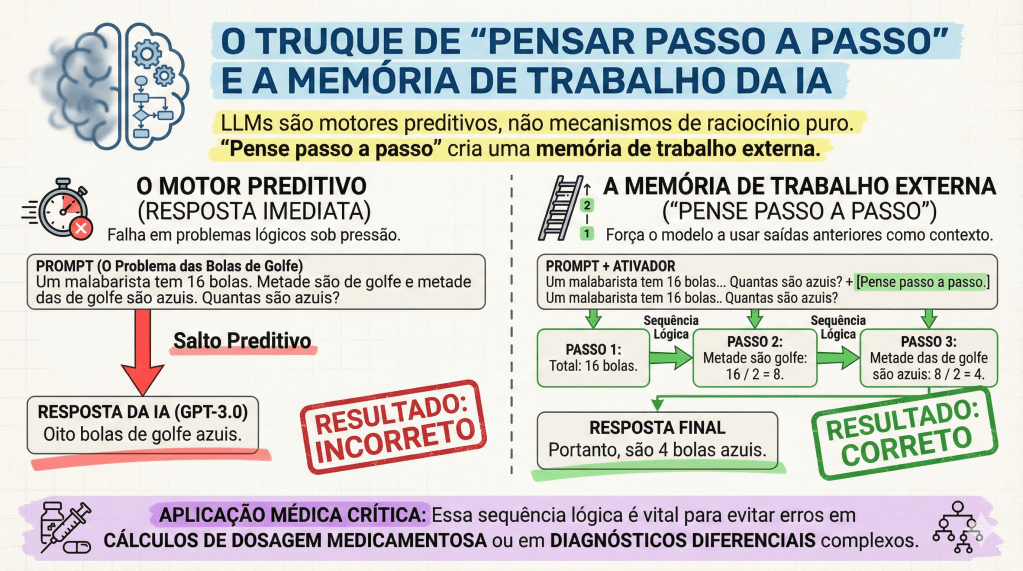
A eficácia do aprendizado, portanto, não reside em receber a resposta pronta, mas em observar o “raciocínio” da máquina, permitindo ao estudante identificar falhas lógicas e consolidar o conhecimento.
4. Aplicação no Ensino-Aprendizado e a Realidade Brasileira (Enare/Enamed)
No cenário brasileiro, marcado pela altíssima competitividade do Enare (Exame Nacional de Residência) e do Enamed, a IA deve ser encarada como um “cérebro periférico”. A densidade do conteúdo cirúrgico exige ferramentas que otimizem a densidade temporal do estudo.
Aplicações Práticas para o Estudante de Alto Desempenho:
- Mnemônicos Cirúrgicos: Criação de fórmulas personalizadas para critérios de gravidade em pancreatite aguda ou escalas de Alvarado.
- Simulação de Pacientes Realistas: Uso de GLMs para simular “Virtual Patients”, permitindo que o estudante treine a anamnese antes do contato real (conforme princípios da AAMC).
- Bancos de Questões De Novo: Geração de simulados inéditos baseados nos exames anteriores do MEC.
A realidade curricular está mudando drasticamente. Segundo dados do Curriculum SCOPE Survey (AAMC), houve um crescimento acentuado na inserção de IA nos currículos das escolas médicas entre 2023 e 2024. No Brasil, essa tendência impacta diretamente a competitividade: o candidato que domina a Engenharia de Prompt processa evidências científicas com uma agilidade que os métodos tradicionais de leitura passiva não conseguem acompanhar. Contudo, este potencial exige uma advertência: a tecnologia deve fortalecer a mente, não atrofiar o raciocínio clínico original.
5. Riscos, Alucinações e a Ética na Medicina Digital
A precisão cirúrgica exige o reconhecimento dos riscos. O maior perigo dos GLMs são as “alucinações”, onde a IA gera informações falsas com um tom de autoridade inquestionável, incluindo referências bibliográficas totalmente inventadas no formato Vancouver.
Checklist de Segurança de Dados e Integridade:
- Verificação de Citações: Jamais utilize uma referência gerada sem conferir o DOI ou a base primária.
- Privacidade: É imperativo nunca inserir dados identificáveis de pacientes reais em prompts de IA.
- Senso Crítico: O cirurgião nunca deve abdicar de sua responsabilidade ética em favor do algoritmo.
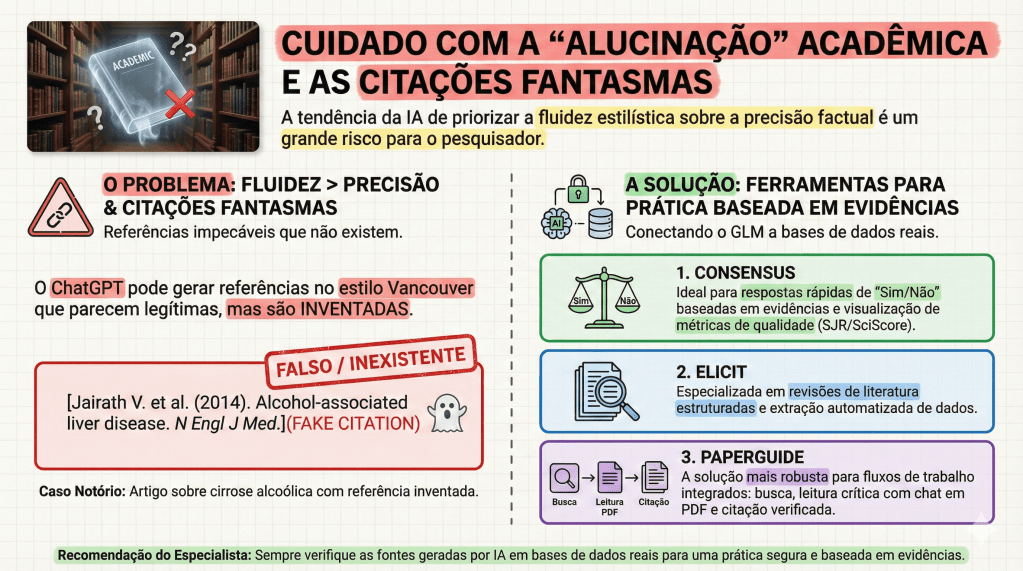
Para o fluxo de trabalho do pesquisador, é vital diferenciar as ferramentas. Modelos de chat puro (como o ChatGPT) são excelentes para síntese, mas para revisões sistemáticas, deve-se integrar ferramentas de evidência real como Elicit e Consensus. Especial destaque deve ser dado ao Paperguide: uma ferramenta “all-in-one” que, além de busca semântica, oferece suporte a múltiplos idiomas — uma vantagem estratégica para o estudante brasileiro que precisa transitar entre a literatura internacional e a prática local. O uso institucional da IA deve, portanto, ser pautado por uma cultura de ética inegociável.
6. Conclusões e Perspectivas Futuras
A Engenharia de Prompt deixará de ser um diferencial para se tornar um requisito básico, tão essencial ao cirurgião digestivo quanto o domínio da estatística básica ou do inglês técnico. Ela é a ponte entre a explosão de dados médicos e a aplicação prática à beira do leito. A mensagem central é clara: a IA deve ser utilizada para fortalecer a compreensão humana, mitigando a falha e ampliando o cuidado, sem jamais criar dependência ou o que chamamos de “pensamento fraco”. O futuro da nossa especialidade pertence àqueles que souberem interrogar a realidade — e a inteligência artificial — com a maior clareza e precisão.
#EngenhariaDePrompt #EducacaoMedica #CirurgiaDigestiva #IAnaMedicina #ResidenciaMedica
——————————————————————————–
“O sucesso da educação médica não reside apenas na transferência de fatos, mas na formação de uma mente capaz de interrogar a realidade com precisão.” — Adaptado dos princípios de William Osler
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
A Cirurgia Digestiva Atual
Autoridade Cirúrgica
A Prerrogativa da Autoridade Cirúrgica sob a Égide da Incerteza Fiscal: Uma Reflexão sobre a Evolução do Prestígio e a Prática Contemporânea
Por: Prof. Dr. Ozimo Gama
O Conceito de Autoridade e a Evolução do Prestígio Médico
O prestígio da profissão médica, historicamente alicerçado em um modelo de prática liberal e em um paternalismo inquestionável, atravessa uma metamorfose estrutural profunda. Sob a égide da contemporaneidade, o cenário de autonomia plena foi substituído por um ambiente de pressões administrativas e incerteza fiscal. Como salientou o Dr. Jesse M. Ehrenfeld, ex-presidente da American Medical Association (AMA), a transição das práticas independentes para os sistemas corporativos é emblemática do estresse econômico enfrentado pela classe. Urge salientar que essa evolução é indissociável da realidade financeira da formação médica. Enquanto na década de 1980 — como recorda o Dr. Weigel — o custo total de quatro anos de medicina girava em torno de US32.000, o cirurgião hodierno egressa com um endividamento médio de US 246.659, podendo ultrapassar os US$ 300.000 em instituições privadas. Concomitantemente, a “Autoridade Cirúrgica” deve ser ressignificada: ela não representa mero poder hierárquico, mas uma responsabilidade derivada da expertise técnica e de um contrato de confiança renovado, essencial para a subsistência ética da especialidade.
Desafios Econômicos e a Realidade da Prática Médica
A análise da medicina atual revela uma insatisfação latente quanto à valorização profissional. Segundo o Medscape Physician Compensation Report 2025, a remuneração média subiu apenas 2,9%, acompanhando parcamente a inflação, enquanto 52% dos médicos manifestam não se sentirem compensados de forma justa. A disparidade entre gerações é notória: em 1985, a vasta maioria dos médicos era proprietária de seu próprio negócio, gerindo equipes e processos. Hoje, o cirurgião é, majoritariamente, um elo em grandes sistemas de saúde, onde a autonomia administrativa é mitigada por métricas corporativas. Os principais vetores de estresse e erosão do prestígio incluem:
• Incerteza Fiscal e Econômica: Oscilações que dificultam o planejamento de carreira a longo prazo.
• Cortes Estatutários de Pagamento: Reduções em sistemas de reembolso (como o Medicare) que não acompanham a complexidade dos atos.
• Burocracia Administrativa e Custos Operacionais: Uma carga intrusiva que desvia o cirurgião de sua atividade fim, exacerbada pelo aumento constante dos custos de manutenção das práticas.
A Autoridade na Cirurgia do Aparelho Digestivo: Expertise e Autonomia
Dentro da hierarquia nosocomial, a Cirurgia do Aparelho Digestivo preserva um “clout” (influência política e social) diferenciado. No entanto, é necessário compreender que esse poder político, como observa Barnett, está profundamente enraizado em um sistema de reembolso não baseado estritamente na saúde da população, mas na valorização de procedimentos de alta complexidade que geram receita crítica para os sistemas hospitalares. A fundamentação da autoridade do cirurgião repousa sobre sua “expertise esotérica”. Jenkins, em suas pesquisas, demonstrou que cirurgiões que operam neonatos de 500g ou realizam duodenopancreatectomias complexas desfrutam de um nível de confiança pública superior. Diferente do pediatra geral, que muitas vezes enfrenta questionamentos constantes sobre condutas rotineiras — como a segurança de vacinas —, o cirurgião digestivo lida com situações de risco vital onde as decisões são técnicas e imediatas. Essa especificidade confere maior autonomia organizacional e confiança do paciente, resultando em um paradoxo interessante: embora o cirurgião trabalhe mais horas e em maior intensidade, os índices de burnout tendem a ser menores do que em especialidades menos procedimentais. A valorização social e a percepção de utilidade crítica atuam como um escudo psicossocial para o especialista.
A Nova Configuração do Contrato Médico-Paciente
O declínio do modelo “Marcus Welby” de paternalismo médico deu lugar a uma era de consumismo em saúde e ceticismo científico, exacerbada pela democratização desenfreada da informação via internet. O contrato médico, outrora um pacto sagrado entre indivíduos, foi reescrito pela burocracia e pelo big business. A autoridade contemporânea deve, portanto, acolher a diversidade e a inclusão como pilares de sua legitimidade. O prestígio moderno não se mede mais pela deferência cega, mas pela busca de equilíbrio, sustentabilidade e autopreservação do profissional.
Aplicação na Prática e Pontos-Chave
No cenário brasileiro, o desafio é análogo. O endividamento do recém-formado em instituições privadas pode variar entre R500.000 e R 800.000, criando uma pressão financeira imediata. Com aproximadamente 5.000 especialistas titulados em Cirurgia do Aparelho Digestivo, enfrentamos uma severa saturação nos grandes centros, o que demanda uma gestão de carreira mais estratégica e técnica.
Pontos-Chave para o Residente e Pós-Graduando:
• Expertise Técnica: O domínio de procedimentos complexos e de alto risco é o fundamento de sua soberania clínica e influência hospitalar.
• Gestão da Autonomia: É imperativo aprender a navegar em sistemas corporativos preservando a integridade da decisão médica frente às pressões administrativas.
• Relação de Confiança: Substitua o paternalismo obsoleto por uma transparência baseada na erudição técnica, gerenciando as expectativas do paciente-consumidor.
• Sustentabilidade da Carreira: A longevidade profissional depende de uma prática que valorize a autopreservação e o equilíbrio ético-financeiro.
Em última análise, a missão do cirurgião permanece como um chamado de serviço. Devemos retomar a visão de Weigel, sentindo-nos como “pastores de nosso rebanho”, responsáveis diretos por vidas que nos são confiadas em momentos de extrema vulnerabilidade. A medicina evoluiu, e o prestígio agora exige mais do que títulos; exige resiliência e adaptação. Como preconizou Theodor Billroth, mestre da cirurgia digestiva:
“O cirurgião deve ter o coração de um leão e as mãos de uma dama.”
A autoridade reside, precisamente, na virtude de equilibrar a força da decisão técnica com a delicadeza do compromisso ético.
The Surgeon – A Cirurgia Digestiva Atual – Et Fortior
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #ResidenciaMedica #AutoridadeCirurgica #EducaçãoMédica #TheSurgeon
Estilo e Brio Cirúrgico
A Ciência da Comunicação Não Verbal na Liderança Cirúrgica
1. A Ontologia do Brio no Bloco Operatório
No teatro de alta complexidade que caracteriza a cirurgia do aparelho digestivo, a excelência técnica, embora imperativa, é apenas o estrato basal da competência. O que verdadeiramente distingue o mestre do técnico é o “Surgical Panache” — ou brio cirúrgico. Longe de ser um adereço estético, o brio é uma competência transformadora fundamentada na ciência da comunicação não verbal. A literatura contemporânea em liderança cirúrgica e comportamento organizacional sublinha que os seres humanos possuem um imperativo biológico para processar mensagens não verbais com extrema celeridade, realizando julgamentos sociais eficientes antes mesmo da primeira incisão. A eficácia de um líder depende da congruência: o alinhamento absoluto entre o rigor do discurso técnico e a presença executiva. É fundamental desmistificar a interpretação vulgar do modelo de Mehrabian: embora as palavras sejam o veículo das instruções técnicas, o canal não verbal domina 93% do clima emocional e da percepção de confiança da equipe. Sem essa harmonia, a confiança organizacional se dissolve, e a comunicação ineficaz manifesta-se não como um erro acessório, mas como uma complicação clínica gravíssima.
2. A Dualidade da Liderança: Receptividade e Formidabilidade
A mobilização do contingente humano em procedimentos complexos exige o domínio da teoria dos sinais de status, conforme a estrutura de Keating. O cirurgião deve projetar uma imagem binária que ative simultaneamente dois sistemas motivacionais na equipe:
• Receptividade (Calor e Atratividade): Sinaliza abertura e convite à colaboração (sistema de approach). É a vertente que garante a segurança psicológica, permitindo que um instrumentador ou anestesista comunique intercorrências sem temor de retaliação.
• Formidabilidade (Competência e Poder): Transmite agência, autoridade e domínio técnico (sistema de avoidance). É a projeção de distância profissional necessária para manter a hierarquia e o rigor em momentos críticos.
O carisma cirúrgico reside na capacidade de transitar entre esses sinais duplos. Um líder puramente formidável silencia a equipe; um líder exclusivamente receptivo compromete o tempo operatório. A maestria está em ser, simultaneamente, um porto seguro e uma autoridade inquestionável.
3. Kinésica e Oculésica: A Arquitetura da Autoridade e Espaço
A taxonomia dos sinais não verbais oferece diretrizes práticas para o refinamento da postura operatória:
• Kinésica (Postura e Gestual): A adoção de posturas expansivas comunica controle. De acordo com o estudo de Holler e Beatie, o uso de gestos intencionais e fluidos aumenta o valor da mensagem falada em 60%. Deve-se eliminar comportamentos nervosos (fidgeting), que corroem a credibilidade.
• Oculésica (O Olhar): O olhar é o regulador supremo da interação. Aplico rigorosamente a regra de manter contato visual durante 50% do tempo ao falar e 70% ao ouvir. Isso estabelece persuasão e engajamento, permitindo “ler o ar” da sala.
• Vocalização (Vocalics): A gestão paralinguística é vital. Em uma intercorrência hemorrágica durante uma duodenopancreatectomia, o cirurgião deve contra-atacar a sobrecarga do sistema nervoso simpático da equipe através de uma voz de tom grave, volume controlado e ritmo pausado. A calma do líder deve ser auditível para ser contagiante.
4. Aplicação na Cirurgia Digestiva e a Realidade Brasileira
A segurança do paciente é o objetivo teleológico de toda comunicação. Estatísticas globais revelam que 86% das falhas no ambiente de trabalho são atribuídas à comunicação ineficaz. Na cirurgia do aparelho digestivo, onde procedimentos como esofagectomias demandam sincronia absoluta, esse dado é alarmante. No contexto brasileiro, classificado como uma cultura de alto contexto (High-Context), a habilidade de interpretar pistas sutis e nuanças não verbais é ainda mais vital do que em ambientes anglo-saxões ou germânicos. No Brasil, a liderança é exercida através do relacionamento e da percepção de brio; o silêncio de um assistente pode significar uma dúvida técnica que o cirurgião deve ser capaz de decifrar visualmente. Ademais, a educação médica continuada em 2026 exige o domínio da “presença digital”. Em boards clínicos virtuais, a Chronemics (gestão do tempo) e a pontualidade tornaram-se indicadores de prioridade organizacional. O enquadramento da câmera deve ser preciso, mantendo o olhar na lente e as mãos visíveis para preservar a transparência e a autoridade virtual.
5. Pontos-Chave para a Prática do Cirurgião Digestivo
Para os alunos, residentes e pós-graduandos sob minha orientação, estabeleço as seguintes prerrogativas:
1. Domínio do Quadro: “Seja dono da sala”. Use posturas expansivas e movimentos deliberados para sinalizar que o ambiente está sob controle técnico e emocional.
2. Estratégia Dual: Não busque ser apenas amado ou apenas temido. Seja formidável na competência e receptivo na colaboração.
3. Monitoramento Ativo: Realize a “análise muda” de suas performances. Assista a vídeos de suas cirurgias sem áudio para identificar vícios gestuais e falhas de congruência.
4. Inteligência Cultural: Adapte sua comunicação ao estrato da equipe. Em culturas de alto contexto, o brio cirúrgico é o que preenche as lacunas do que não foi dito, mas precisa ser compreendido.
6. O Cirurgião como Líder Corporificado
O brio não é um dom estático, mas uma disciplina dinâmica refinada pela autoconsciência e pelo rigor. Projetar uma presença física autêntica, confiante e empática é o diferencial definitivo para a liderança de alto impacto. O cirurgião que negligencia sua comunicação não verbal é apenas um executor de técnicas; o cirurgião que domina seu brio é um comandante de destinos, capaz de tratar a falha de comunicação com o mesmo rigor científico com que trata uma fístula anastomótica.
——————————————————————————–
“O cirurgião deve ter mãos de dama, olhos de águia e coração de leão; contudo, é a sua presença que confere à equipe a têmpera necessária para a vitória sobre a patologia.” — Baseado no legado de William Stewart Halsted

Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
The Surgeon A Cirurgia Digestiva Atual Et Fortior
#CirurgiaDigestiva #BrioCirurgico #LiderançaMedica #EducacaoMedica #TheSurgeon
Segurança em Foco
A Evolução da Cultura de Segurança e o Desafio da Burocratização na Cirurgia do Aparelho Digestivo
1. A Gênese do Risco na Medicina e Cirurgia
A gênese da prática cirúrgica moderna está intrinsecamente vinculada a uma audácia que, aos olhos contemporâneos, beira a temeridade. Em seus primórdios, a medicina não dispunha de comitês de ética, protocolos de conduta ou salvaguardas administrativas; o progresso era esculpido em tempo real, frequentemente à beira do leito e sob um custo humano excruciante. A introdução de tecnologias disruptivas como o éter e o clorofórmio exemplifica essa tensão dialética: embora tenham viabilizado a revolução do ato operatório, enfrentaram resistências ferrenhas sob o pretexto de serem substâncias perigosas e incontroláveis. Esse padrão de rejeição institucional repetiu-se com Ignaz Semmelweis, cuja demonstração empírica da eficácia da higiene das mãos foi ignorada por desafiar identidades profissionais e normas vigentes. Aquela era, magistralmente retratada na série The Knick, exibe uma medicina criativa e heróica, porém caótica e, por vezes, deletéria. Aprendemos, por meio de um processo histórico doloroso, que a inovação desmedida gera danos, mas reconhecemos que, naquele período de obscuridade técnica, a assunção do risco era o único vetor possível para o avanço da ciência.
2. O Surgimento da Segurança como Bússola Moral
Como resposta necessária ao caos da era heróica, a segurança emergiu como a bússola moral da medicina do século XX. A transição para a era da padronização e dos protocolos buscou transformar a arte cirúrgica em uma ciência de alta confiabilidade. O advento do Checklist Cirúrgico consolidou-se como o marco definitivo desta evolução, mitigando erros catastróficos, como intervenções em locais incorretos, e reduzindo drasticamente as complicações evitáveis. A segurança estabeleceu-se como nossa âncora ética sob o aforismo Primum non nocere. Contudo, observamos hoje que este preceito tem sido distorcido: em vez de guiar a prudência clínica, é frequentemente invocado para justificar a inação diante de riscos calculados e necessários. A medicina não deve ser a busca utópica pela anulação do risco a qualquer custo, mas sim o sopesamento rigoroso entre danos e benefícios, sempre pautado pela soberania dos valores do paciente.
3. Quando a Segurança se Torna Burocracia
Assistimos, na atualidade, a uma patologia sistêmica de ordem administrativa: a “fossilização” da segurança em estruturas burocráticas estáticas. O que deveria proteger o paciente transmutou-se em mecanismos de proteção institucional e conformidade legal. Um sintoma alarmante dessa realidade foi o caso de um residente sênior norte-americano que, a seis meses de sua graduação, jamais havia realizado uma drenagem de tórax de forma autônoma — um reflexo direto de sistemas que priorizam a ausência de intercorrências administrativas em detrimento da formação de competência técnica real. No cenário brasileiro, essa estagnação é agravada por infraestruturas hospitalares rígidas e prontuários eletrônicos (EHRs) deficientes, que impõem as seguintes consequências:
• Dreno de Intelecto: Residentes de Cirurgia do Aparelho Digestivo e de Terapia Intensiva gastam, em média, 50% de sua jornada diária em tarefas clericais e documentação redundante, sacrificando o raciocínio clínico e o treinamento em técnica cirúrgica.
• Engessamento da Pesquisa: Processos de governança para estudos de baixo risco podem levar meses ou anos para aprovação, priorizando a prevenção de riscos hipotéticos sobre o aprendizado derivado de pacientes reais.
• Desvio de Finalidade: A documentação clínica passou a servir mais ao faturamento e à auditoria do que à comunicação entre a equipe e ao cuidado direto.
4. O “Stress Test” da Inteligência Artificial (IA) na Prática Cirúrgica
A Inteligência Artificial atua hoje como um teste de estresse que revela as falhas de governança do nosso sistema de saúde. A barreira para a adoção da IA não é de ordem técnica, mas sim uma incapacidade de adaptação das instâncias decisórias. O paradoxo é flagrante: algoritmos de IA são prontamente implementados quando o objetivo é otimizar códigos de faturamento e captura de receita. No entanto, ferramentas de IA como escribas clínicos, que reduzem a carga documental, ou sistemas de suporte ao raciocínio clínico e triagem de imagens, enfrentam barreiras instransponíveis sob o pretexto da privacidade — ainda que sejam mais seguros do que os “atalhos” improvisados por cirurgiões em seus dispositivos pessoais para contornar sistemas hospitalares obsoletos. A resistência atual é uma falha de governança disfarçada de segurança do paciente.
5. Aplicação Prática na Cirurgia Digestiva
Para o cirurgião do aparelho digestivo em formação, o conceito de “Custo do Atraso” deve ser central. Estatísticas demonstram que, em média, transcorrem 14 anos para que uma evidência científica consolidada chegue efetivamente ao leito do paciente. Para um residente que inicia sua trajetória hoje, esse hiato significa que ele poderá estar na metade de sua carreira antes de dominar as inovações que já estão disponíveis agora. É imperativo compreender que a inação não é um porto seguro; ela possui consequências invisíveis, mas mensuráveis. A espera por uma segurança absoluta e estática é, em si, uma forma de dano. Na residência médica e na pós-graduação, a inovação tecnológica deve ser integrada não como um acessório, mas como um pilar da segurança do paciente e da eficiência clínica.
6. Pontos-Chave para o Residente e Pós-Graduando
1. A segurança deve ser adaptativa, não estática: Protocolos que não evoluem com a tecnologia tornam-se obstáculos ao exercício da excelência cirúrgica.
2. Inação também gera dano: O perigo invisível da espera e o atraso na adoção de novas técnicas são formas reais de prejuízo ao paciente.
3. O cirurgião como avaliador e tradutor: O cirurgião não é um usuário passivo, mas um filtro crítico que absorve incertezas para que o sistema de saúde possa aprender e evoluir com segurança.
7. Perspectivas Futuras
A segurança que não evolui torna-se, inexoravelmente, insegura. O desafio da Cirurgia Digestiva contemporânea é resgatar a coragem intelectual de nossos predecessores, temperada pelo rigor científico atual. Devemos atuar como early adopters responsáveis, integrando novas ferramentas de forma monitorada e contínua. A tradição, que outrora serviu para proteger o enfermo, não pode ser reduzida a um mecanismo que protege as instituições contra a mudança. Somente através de uma cultura de aprendizado contínuo e da superação da burocracia fóssil poderemos assegurar que a próxima geração de cirurgiões esteja plenamente capacitada para os desafios de sua era.
Como bem asseverou Lord Lister, o mestre da antissepsia: “O sucesso de uma operação depende da atenção cuidadosa a cada detalhe.” Que essa atenção aos detalhes transcenda o campo operatório e alcance a gestão crítica da tecnologia e dos sistemas que regem nossa profissão. O zelo pelo paciente exige, agora mais do que nunca, zelo pela evolução do sistema.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
The Surgeon A Cirurgia Digestiva Atual Et Fortior
#CirurgiaDigestiva #SegurancaDoPaciente #EducacaoMedica #IAnaMedicina #ResidenciaMedica
A Revolução da Inteligência Artificial no Aprendizado e na Pesquisa em Cirurgia do Aparelho Digestivo
1. O Novo Paradigma da Educação Médica
A evolução da Inteligência Artificial (IA) no seio da medicina contemporânea transcendeu a mera aplicação subsidiária em diagnósticos por imagem para consolidar-se como um pilar epistemológico na pesquisa e no aprendizado. O cirurgião moderno defronta-se com um desafio multifacetado, por vezes sísifo: a imperiosa necessidade de conciliar uma extenuante carga operatória com a produção científica de alto impacto e a gestão de um volume oceânico de literatura especializada. Neste cenário, a Inteligência Artificial Generativa (GenAI) e os Modelos de Linguagem de Grande Escala (LLMs) emergem não como substitutos do intelecto, mas como catalisadores de um fluxo de trabalho otimizado. É fundamental compreendermos que a maestria cirúrgica hoje exige, além da destreza manual, a competência digital para navegar nesta nova fronteira tecnológica com idoneidade e rigor acadêmico.
2. Ferramentas de IA e Categorização Funcional
A fundamentação científica para a adoção dessas tecnologias repousa em evidências recentes e robustas. O estudo seminal de Valencia-Coronel et al. (2026) realizou uma avaliação qualitativa rigorosa de 43 plataformas de IA, fornecendo um arcabouço para a seleção criteriosa de ferramentas no pipeline da pesquisa cirúrgica.
Dentre as categorias funcionais identificadas, destacam-se:
• Mecanismos de Busca Acadêmica: Superando os buscadores genéricos, plataformas como Consensus AI, Elicit e EvidenceHunt focam na síntese de evidências baseadas em revisão por pares. Ressalto a relevância do Manus AI, projetado especificamente para lidar com tópicos cirúrgicos complexos e desfechos heterogêneos, auxiliando inclusive na estruturação de protocolos e tabelas prontas para publicação.
• Interação com Documentos: Ferramentas como AskYourPDF e ChatPDF permitem um diálogo heurístico com manuscritos complexos, facilitando a extração de dados técnicos e a análise metodológica profunda.
• Análise de Literatura: A visualização de redes de citações através de algoritmos (ex: Connected Papers e Litmaps) permite mapear a trajetória de um tema e identificar conexões semânticas fundamentais.
• Assistentes de Escrita e Síntese: Modelos como ChatGPT (em sua versão GPT-4) e ClaudeAI auxiliam na estruturação de rascunhos. Para sínteses profundas, o modo “Deep Research” do Perplexity AI destaca-se por realizar varreduras exaustivas em múltiplos repositórios. No design, o Napkin AI converte conceitos complexos em diagramas técnicos precisos.
O ganho de eficiência é estatisticamente substancial. Conforme demonstrado no estudo de Trad et al. (2024), a aplicação de fluxos baseados em LLM reduziu o tempo de triagem em revisões sistemáticas de 564,4 para 25,5 horas. Mais relevante que a celeridade é a precisão: o estudo reportou um índice de falso-negativo de 0% e uma especificidade de 99,6%, superando o crivo humano em termos de consistência.
3. Aplicação Prática na Cirurgia do Aparelho Digestivo
Para o residente ou o pós-graduando em Cirurgia do Aparelho Digestivo, a integração destas ferramentas deve ser metódica. Imaginemos o preparo para um Journal Club: o acadêmico pode utilizar o Consensus AI para identificar o estado da arte sobre uma técnica de anastomose, empregar o Litmaps para visualizar a rede de citações do ensaio clínico seminal e, finalmente, interpelar a metodologia do artigo através do ChatPDF para identificar possíveis vieses.
O fluxo de trabalho idealizado integra ciclicamente: (1) Busca em mecanismos especializados; (2) Interação conversacional com documentos para extração de dados; (3) Análise de redes de citações para contextualização histórica; (4) Escrita assistida por modelos generativos e (5) Design gráfico para comunicação visual dos resultados.
4. O Papel da Supervisão Humana
Embora a tecnologia seja fascinante, o rigor acadêmico nos impõe cautela. Devemos atentar para o conceito de “débito cognitivo”. Pesquisas conduzidas por Kosmyna et al. (2024) revelam que a dependência excessiva e exclusiva de IAs reduz o engajamento neural e a retenção de conteúdo. Em contrapartida, a sequência “cérebro primeiro, IA depois” — em que a conceituação inicial e o esboço partem do cirurgião — resulta em um aumento de 50% a 200% na conectividade neural através de bandas de EEG, preservando a capacidade de recordação e o pensamento crítico.
No âmbito ético, as diretrizes de entidades como ICMJE, COPE e WAME são peremptórias:
1. Veto à Autoria: Sistemas de IA não possuem personalidade jurídica ou intelectual para figurar como autores.
2. Transparência Radical: Todo uso de GenAI deve ser declarado explicitamente na seção de Métodos ou Agradecimentos.
3. Auditoria e Registros: Seguindo as orientações da JAMA Network, o pesquisador deve manter um registro de todos os prompts (comandos) relevantes utilizados, para fins de auditoria ética e científica.
A IA jamais substituirá o julgamento clínico soberano ou a responsabilidade ética do cirurgião sobre o dado publicado.
BOX DE DESTAQUE: ESSENCIAL PARA A PRÁTICA ACADÊMICA
• Eficiência Paradigmática: Redução drástica no tempo de triagem bibliográfica com precisão cirúrgica (0% de falso-negativos).
• Rigor Científico: Obrigatoriedade de verificação manual das referências para mitigar “alucinações” do modelo.
• Metodologia “Brain-First”: Priorizar a reflexão intelectual antes da assistência tecnológica para evitar o débito cognitivo.
• Ética e Transparência: Registro de prompts e declaração formal do uso de ferramentas conforme diretrizes internacionais.
6. Conclusões Aplicadas à Prática
A Inteligência Artificial é um catalisador de produtividade sem precedentes na história da medicina. Contudo, o cirurgião deve permanecer como o árbitro final da precisão científica. O futuro da educação médica continuada no Brasil exige o desenvolvimento de habilidades digitais que permitam ao médico não apenas consumir tecnologia, mas governá-la sob a égide do rigor científico. Dominar estas ferramentas é, hoje, um requisito para a excelência acadêmica e clínica.
“O cirurgião que conhece apenas a técnica é um artesão; o que domina a ciência por trás dela é um mestre. A IA é nossa nova ferramenta de maestria.”
Gostou? ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
——————————————————————————–
Palavras-chave: Inteligência Artificial na Cirurgia, Educação Médica, Cirurgia do Aparelho Digestivo, Pesquisa Cirúrgica, LLMs na Medicina, Residência Médica.
Hashtags: #CirurgiaDigestiva #InteligenciaArtificial #MedicinaAcademica #TheSurgeon #EducacaoMedica
PROF. DR. OZIMO GAMA
The Surgeon
A Cirurgia Digestiva Atual
Et Fortior
A Origem da Cirurgia Abdominal
A História da Primeira Laparotomia de Sucesso

1.0 Um Olhar Sobre o Abismo do Passado Cirúrgico
Hoje, um cirurgião pode remover um grande tumor ovariano em um procedimento seguro, utilizando um eletrocautério para uma cirurgia sem sangue e clipes de plástico para ligar os vasos. É um feito notável, mas que se torna assombroso quando contrastado com a brutal realidade cirúrgica de 1809. Naquele mundo, o interior do abdômen era um santuário inviolável. O que aconteceu na cidade fronteiriça de Danville, Kentucky, não foi uma evolução, mas uma metamorfose. Foi, nas palavras de Shakespeare, “a sea change into something rich and strange” — uma transformação profunda e maravilhosa.
Voltemos a esse tempo. Não existia anestesia — o éter só seria usado 33 anos depois. Os princípios da antissepsia de Joseph Lister só surgiriam em 1865. Transfusões de sangue eram algo para mais de um século no futuro, e a penicilina de Alexander Fleming só seria descoberta em 1928. Qualquer tentativa de abrir a cavidade abdominal era considerada uma sentença de morte.
Foi neste cenário desolador que um cirurgião visionário, Dr. Ephraim McDowell, e uma paciente de coragem extraordinária, Jane Todd Crawford, se uniram para realizar o impossível. Juntos, eles conduziram um “experimento” que não apenas salvou uma vida, mas fundou a cirurgia abdominal. Esta é a crônica desse evento marcante — uma lição fundamental de inovação, diagnóstico e coragem para todos os estudantes e cirurgiões contemporâneos.
2.0 A Crônica de um Milagre Cirúrgico
2.1 O Cenário Cirúrgico do Século XIX: O Dogma da Peritonite Fatal
No início do século XIX, a comunidade médica, especialmente a europeia, operava sob um dogma inabalável: qualquer violação da cavidade peritoneal resultaria invariavelmente em peritonite e morte. Cirurgiões renomados, como o anatomista escocês William Hunter, consideravam a remoção de ovários uma prática incurável e perigosa. Desafiar essa crença não exigia uma evolução do pensamento, mas uma completa revolução. Apesar do medo paralisante, a ideia já havia sido aventada. John Bell, professor de McDowell e um dos cirurgiões mais famosos da Europa, havia falado sobre a possibilidade teórica de tal operação em suas aulas, embora nunca tenha ousado tentar realizá-la. O abismo entre a teoria e a prática era, até então, intransponível.
2.2 Os Protagonistas: Um Cirurgião Visionário e uma Paciente de Coragem Extraordinária
Dr. Ephraim McDowell: Nascido em 1771, McDowell era um cirurgião competente e respeitado na fronteira americana. Sua formação incluiu um aprendizado com o Dr. Alexander Humphreys e estudos na Universidade de Edimburgo, onde foi influenciado por John Bell. Ao retornar para Danville, estabeleceu uma reputação por realizar cirurgias complexas para a época, como a remoção de cálculos vesicais de 23 pacientes sem uma única fatalidade. Um desses pacientes foi um jovem chamado James K. Polk, que mais tarde se tornaria o 11º presidente dos Estados Unidos.

Jane Todd Crawford: Nascida em 1763, Jane era uma mulher de 45 anos, mãe de quatro filhos, que vivia em uma cabana de toras a 60 milhas (quase 100 km) de Danville. Por meses, ela sofreu com um inchaço abdominal persistente e enorme. Seus médicos locais, perplexos, diagnosticaram-na erroneamente como estando em uma gravidez gemelar que já havia passado do tempo. Sua coragem e fortitude seriam postas à prova de uma forma que ninguém poderia imaginar.
2.3 O Diagnóstico e a Decisão Audaciosa
Em 13 de dezembro de 1809, McDowell cavalgou até a casa de Crawford. Seu relato do encontro demonstra uma impressionante acuidade clínica. Ele escreveu:
“Ao exame, per vaginam, não encontrei nada no útero, o que me induziu à conclusão de que deveria ser um ovarium aumentado.”
Sem nenhuma tecnologia, apenas com seu conhecimento de anatomia e o exame físico, McDowell descartou a gravidez e diagnosticou corretamente um tumor ovariano gigante. O passo seguinte foi ainda mais notável. Em um dos primeiros exemplos de consentimento informado, ele explicou a Crawford sua perigosa situação e que a única chance, uma operação, seria um “experimento” nunca antes realizado com sucesso. Ele prometeu tentar se ela estivesse disposta a ir até sua casa em Danville.
A resposta de Jane Todd Crawford foi um ato de coragem monumental. Durante o rigoroso inverno do Kentucky, ela viajou as 60 milhas a cavalo, uma jornada de vários dias, equilibrando o enorme tumor sobre a sela de seu cavalo para se submeter a um procedimento que muito provavelmente a mataria.
2.4 A Operação: Um Marco na História em 25 de Dezembro de 1809
No dia de Natal de 1809, em um quarto no andar de cima da casa de McDowell, a cirurgia foi realizada. Não havia anestesia; a mesa de operação era uma mesa comum de madeira. Para se acalmar durante o procedimento de 25 minutos, Jane Todd Crawford recitava salmos e cantava hinos. A cena, conforme descrita por McDowell, desafia a imaginação moderna. Ele realizou uma incisão de 9 polegadas no lado esquerdo do abdômen, realizando a primeira laparotomia eletiva da história. Com a súbita liberação da pressão, os intestinos “correram para fora sobre a mesa”. Preenchido pelo tumor, o abdômen não podia contê-los. As alças intestinais, segundo o próprio McDowell, “permaneceram de fora por cerca de vinte minutos e, sendo dia de Natal, ficaram tão frias” que ele precisou lavá-las com água morna antes de recolocá-las. Em meio a esse caos controlado, ele passou uma ligadura forte na trompa de Falópio, incisou o tumor, removeu 15 libras de “substância gelatinosa suja” e, em seguida, o saco tumoral de 7,5 libras. Finalmente, fechou a incisão com sutura interrompida, deixando a ponta da ligadura para fora. A recuperação de Crawford foi tão milagrosa quanto a cirurgia. Cinco dias depois, McDowell a encontrou “fazendo sua cama”. Em 25 dias, ela estava saudável o suficiente para fazer a viagem de 60 milhas de volta para casa, novamente a cavalo. Jane Todd Crawford viveu por mais 33 anos, superando seu cirurgião em 12 anos.

2.5 Publicação e Reconhecimento Tardio
Com modéstia, McDowell só publicou seu feito em 1817, no Eclectic Repertory and Analytical Review, após realizar com sucesso mais duas operações semelhantes. A reação da comunidade médica europeia foi de ceticismo e desprezo. James Johnson, editor do influente London Medico-Chirurgical Review, expressou sua incredulidade com um desdém mordaz: “Credat Judoeus, non ego” (Conte isso a outra pessoa, não a mim). Anos depois, ao relutantemente aceitar o feito, sua retratação revelou o preconceito geográfico e racial que McDowell enfrentava: “…todas as mulheres operadas no Kentucky, exceto uma, eram negras, e como essas pessoas suportam cortes com quase, se não total, impunidade como cães e coelhos, nossa admiração diminui…”. O reconhecimento de McDowell como o “Pai da Cirurgia Abdominal” veio postumamente, em grande parte devido aos esforços do Dr. Samuel D. Gross.
3.0 Aplicação e Legado para a Cirurgia Digestiva
Qual a importância deste evento para nós, cirurgiões do aparelho digestivo? A resposta é simples e profunda: tudo. O feito de McDowell foi a refutação prática e definitiva do dogma de que a cavidade peritoneal era intocável. Sua coragem não criou apenas um novo procedimento; ela criou a possibilidade de toda a nossa especialidade. A cirurgia de estômago, fígado, pâncreas e intestino simplesmente não existiria sem aquele primeiro passo revolucionário. É crucial também clarificar a terminologia. O procedimento não foi uma “ovariotomia” — termo que tecnicamente significa apenas incisar o ovário. O que McDowell realizou foi uma laparotomia (a abertura da cavidade abdominal) com uma salpingo-ooforectomia (a extração do ovário e da trompa de Falópio). Usar o termo impreciso diminui a magnitude de seu feito, que não foi apenas remover um órgão, mas sim invadir e manejar com sucesso o santuário proibido do abdômen. A ousadia de McDowell ressoa em sua própria voz, vinte anos depois do evento, em uma carta de 1829:
“Portanto, parece-me uma mera bobagem sobre o perigo da inflamação peritoneal tão falada pela maioria dos cirurgiões.”
4.0 Pontos-Chave para a Prática do Cirurgião Digestivo
A história de McDowell e Crawford oferece lições atemporais para a prática médica moderna:
- Inovação Contra o Dogma: A medicina avança quando profissionais questionam verdades estabelecidas. McDowell transcendeu o “padrão de cuidado” de sua época, confiando em seu julgamento clínico e conhecimento anatômico para fazer o que era considerado impossível.
- A Primazia do Diagnóstico Clínico: A habilidade de McDowell em realizar um diagnóstico preciso baseado unicamente no exame físico e no raciocínio clínico é uma lição poderosa. É um lembrete contundente de que, na ausência de tecnologia, a verdadeira excelência reside no raciocínio anatômico e na sensibilidade do exame clínico — habilidades que jamais devem ser atrofiadas.
- A Aliança Cirurgião-Paciente: O sucesso da empreitada dependeu de uma confiança mútua extraordinária. O consentimento informado de Crawford, mesmo em sua forma mais rudimentar, foi o pilar que sustentou a realização de um procedimento de altíssimo risco.
- Coragem e Responsabilidade: McDowell demonstrou a coragem necessária para ser o primeiro, assumindo total responsabilidade pelo resultado. Ele sabia que, em caso de falha, o peso do fracasso recairia inteiramente sobre ele.
5.0 O Legado Imortal de McDowell e Crawford
A cirurgia realizada em um quarto de uma cidade fronteiriça não foi um avanço evolutivo; foi um salto revolucionário. Nasceu da visão de um homem e da coragem de uma mulher, que juntos mudaram o curso da história da medicina. Não foi o produto de uma “escola” cirúrgica ou de anos de pesquisa, mas um ato de genialidade e audácia que surgiu de novo. Com sua genialidade, Ephraim McDowell devolveu a vida a Jane Todd Crawford; ela, em troca, garantiu-lhe a imortalidade. O que eles realizaram juntos foi, de fato, o início de uma nova era para a medicina.
#HistóriaDaMedicina #CirurgiaAbdominal #Laparotomia #EphraimMcDowell #CirurgiaDigestiva
Anatomia Cirúrgica da Região Inguinal
1.0 Introdução
A anatomia da região inguinal é notoriamente complexa, representando um desafio constante até mesmo para os cirurgiões mais experientes. Como afirmado de forma sucinta por Skandalakis et al. no início de seu trabalho seminal, a anatomia da região inguinal é “enigmática e confusa” (enigmatic and confusing). Este artigo tem como objetivo desmistificar essa complexidade, focando nas estruturas anatômicas cruciais e em suas relações, a fim de fornecer um guia claro e prático para estudantes de medicina, residentes e cirurgiões que atuam no reparo de hérnias inguinais. Uma compreensão precisa desta topografia não é apenas um exercício acadêmico, mas a fundação para a excelência cirúrgica.
2.0 Desvendando as Estruturas Anatômicas
2.1 As Paredes do Canal Inguinal
O canal inguinal é uma passagem oblíqua através das camadas inferiores da parede abdominal. Suas paredes são formadas por diversas estruturas musculoaponeuróticas, como visto na ilustração anatômica. Os limites são:
• Parede Anterior: Formada pela aponeurose do músculo oblíquo externo e, em sua porção lateral, reforçada pelo músculo oblíquo interno.
• Parede Posterior: Considerada a mais importante do ponto de vista anatômico e cirúrgico, é composta primariamente pela fusão da aponeurose do músculo transverso do abdome com a fáscia transversal. Em 23-25% dos indivíduos, é formada apenas pela fáscia transversal.
• Parede Superior (Teto): Composta pelas fibras arqueadas dos músculos oblíquo interno e transverso do abdome e suas aponeuroses.
• Parede Inferior (Assoalho): Constituída pelo ligamento inguinal e, mais medialmente, pelo ligamento lacunar.
A reconstrução desta parede posterior, especialmente quando deficiente, é o objetivo central de qualquer herniorrafia inguinal bem-sucedida.
2.2 As Camadas Musculoaponeuróticas Fundamentais
A parede abdominal é composta por três camadas de músculos planos. De superficial para profundo, temos o oblíquo externo, o oblíquo interno e o transverso do abdome. Embora todos sejam importantes, o músculo transverso do abdome assume um papel de destaque. De acordo com McVay, ele é a camada mais importante da parede abdominal. A integridade deste músculo e sua aponeurose é o que, em última análise, previne a formação de hérnias. Consequentemente, a mobilização e o uso da aponeurose deste músculo são manobras essenciais para um reparo anatômico e duradouro.
2.3 A Crucial Fáscia Transversal
A fáscia transversal é a lâmina de tecido conjuntivo que reveste a superfície interna da musculatura da cavidade abdominal. Ela é uma estrutura fundamental, contribuindo para a formação da fáscia espermática interna no funículo espermático e, como já mencionado, compondo a parede posterior do canal inguinal. Sua integridade é vital para a contenção visceral. Portanto, a dissecção e o reparo desta fáscia não são opcionais, mas sim o alicerce fundamental de uma herniorrafia sem tensão.
2.4 O “Mito” do Tendão Conjunto
O termo “tendão conjunto” é amplamente utilizado, mas sua existência anatômica como uma fusão distinta das fibras inferiores do oblíquo interno e do transverso do abdome é extremamente rara. A evidência anatômica mostra que essa configuração é mais uma exceção do que uma regra.
• Hollinshead considerou sua existência em apenas 5% dos corpos.
• Condon relatou uma incidência de apenas 3%.
• McVay acreditava que o “tendão conjunto” era um artefato de dissecação.
Por essa razão, o conceito de “área conjunta” (conjoined area) é um termo mais preciso e clinicamente relevante. Esta área refere-se à região medial da parede posterior, que inclui estruturas como o ligamento de Henle, a aponeurose do transverso do abdome e a borda lateral da bainha do reto, que são de fato utilizadas no reparo de hérnias.
2.5 Pontos de Referência Cirúrgicos Essenciais
A navegação segura na região inguinal exige o reconhecimento de marcos anatômicos chave:
• Triângulo de Hesselbach: É o local onde ocorre a maioria das hérnias inguinais diretas. Suas bordas, na definição moderna, são: os vasos epigástricos inferiores (borda superior), a bainha do músculo reto abdominal (borda medial) e o ligamento inguinal (borda lateroinferior).
• Ligamento de Cooper: Estrutura robusta formada pelo periósteo do ramo superior do púbis. É reforçado por múltiplas camadas, incluindo contribuições da fáscia transversal, do trato iliopúbico e da aponeurose do transverso do abdome. É um ponto de ancoragem fundamental em diversas técnicas de herniorrafia, como a de McVay.
• Trato Iliopúbico: Uma banda aponeurótica densa que se estende do arco iliopectíneo até o ramo superior do púbis, formando a margem inferior da camada musculoaponeurótica profunda. Condon o encontrou presente em 98% das dissecações. É uma estrutura profunda, paralela ao ligamento inguinal (que é mais superficial), e um marco essencial em reparos laparoscópicos e abertos.
3.0 Aplicação na Cirurgia Digestiva
3.1 Fisiologia e Mecanismos de Contenção da Hérnia
A integridade do canal inguinal normal é mantida por dois mecanismos fisiológicos dinâmicos:
1. Ação Esfincteriana: A fáscia transversal forma um “sling” (alça) ao redor do anel inguinal interno. A contração do músculo transverso do abdome tensiona essa alça, fechando o anel sob a borda muscular do oblíquo interno.
2. Ação de Obturador (“Shutter Action”): Durante a contração da musculatura abdominal (por exemplo, ao tossir), o arco aponeurótico do músculo transverso do abdome se move em direção ao trato iliopúbico e ao ligamento inguinal, reforçando e obliterando qualquer fraqueza na parede posterior.
3.2 Implicações Diretas na Herniorrafia
O conhecimento anatômico se traduz diretamente na estratégia cirúrgica. Como mencionado, a parede posterior é anatomicamente deficiente em 23-25% dos indivíduos, carecendo do suporte da aponeurose do músculo transverso. Nesses casos, a fáscia transversal torna-se a única barreira contra a herniação direta. O objetivo de uma herniorrafia eficaz não é apenas fechar um defeito, mas reconstruir a dinâmica da parede posterior. A compreensão precisa de quais estruturas estão presentes, quais são deficientes e quais podem ser utilizadas para um reparo sólido e sem tensão é o que diferencia um procedimento bem-sucedido de uma recidiva.
4.0 Pontos-Chave
1. A Complexidade é Real: A anatomia inguinal é intrincada e repleta de controvérsias terminológicas. Um estudo contínuo é necessário.
2. O Transverso do Abdome é Rei: A integridade do músculo transverso do abdome e sua aponeurose é o fator mais crítico na fisiopatologia e prevenção das hérnias inguinais.
3. O Tendão Conjunto é Raro: O “tendão conjunto” clássico é um achado raro (3-5%). O termo “área conjunta” é mais apropriado para descrever as estruturas utilizadas cirurgicamente.
4. A Parede Posterior é a Chave: O sucesso do reparo de uma hérnia inguinal depende fundamentalmente da reconstrução de uma parede posterior forte e sem tensão, utilizando as estruturas anatômicas corretas.
5. Conheça Seus Marcos: O Ligamento de Cooper, o Trato Iliopúbico e o Triângulo de Hesselbach são referências anatômicas indispensáveis para o cirurgião realizar um procedimento seguro e eficaz.
5.0 Conclusões Aplicadas à Prática Clínica
Apesar de séculos de estudo e de incontáveis procedimentos cirúrgicos, a região inguinal permanece um desafio anatômico. As variações individuais e as controvérsias na nomenclatura exigem do cirurgião mais do que a memorização de diagramas; exigem um conhecimento profundo e funcional. Esta compreensão detalhada da anatomia é a ferramenta mais poderosa que possuímos para avaliar defeitos herniários, escolher a técnica de reparo mais adequada e, por fim, garantir resultados cirúrgicos superiores e duradouros para nossos pacientes.
#AnatomiaCirurgica #HerniaInguinal #CirurgiaGeral #ResidenciaCirurgia #AparelhoDigestivo
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Conteúdo Extra
Lista Completa de Epônimos Anatômicos da Região Inguinal
Esta lista abrange as estruturas clássicas nomeadas em homenagem a anatomistas e cirurgiões, fundamentais para a compreensão cirúrgica da região inguiocrural.
1. Ligamentos e Estruturas Fibrosas
Os elementos estruturais que formam as paredes e o assoalho da região.
- Ligamento de Poupart
- Nome Moderno: Ligamento Inguinal.
- Quem foi: François Poupart (cirurgião francês, séc. XVII).
- Descrição: A borda inferior enrolada da aponeurose do músculo oblíquo externo. Estende-se da EIAS ao tubérculo púbico, formando o “assoalho” do canal inguinal.
- Ligamento de Gimbernat
- Nome Moderno: Ligamento Lacunar.
- Quem foi: Antonio de Gimbernat y Arbós (cirurgião espanhol, séc. XVIII).
- Descrição: Extensão posterior e triangular do ligamento de Poupart que se fixa no osso púbico. Forma a borda medial cortante do anel femoral.
- Ligamento de Cooper
- Nome Moderno: Ligamento Pectíneo.
- Quem foi: Astley Cooper (cirurgião inglês, séc. XIX).
- Descrição: Espessamento forte do periósteo (membrana do osso) ao longo do ramo superior do púbis. É o principal ponto de ancoragem óssea para telas em cirurgias complexas.
- Trato de Thomson
- Nome Moderno: Trato Iliopúbico.
- Quem foi: James Thomson (anatomista escocês, séc. XIX).
- Descrição: Espessamento da fáscia transversal profundo e paralelo ao ligamento inguinal. É o divisor profundo entre o canal inguinal (acima) e o canal femoral (abaixo).
- Ligamento de Henle
- Nome Moderno: Expansão lateral da bainha do músculo reto abdominal (frequentemente associado à foice inguinal/tendão conjunto).
- Quem foi: Friedrich Gustav Jakob Henle (anatomista e patologista alemão, séc. XIX).
- Descrição: Uma estrutura aponeurótica na parede posterior do canal inguinal, logo na borda do músculo reto abdominal. Ele forma o limite medial do Trígono de Hesselbach. Sua presença é variável; quando forte, protege contra hérnias diretas; quando ausente ou fraco, predispõe a elas.
- Ligamento de Colles (ou Ligamento Reflexo)
- Nome Moderno: Ligamento Inguinal Reflexo.
- Quem foi: Abraham Colles (cirurgião e anatomista irlandês, séc. XIX).
- Descrição: É uma camada de fibras derivadas da aponeurose do oblíquo externo do lado oposto, que cruzam a linha média e se inserem na crista púbica e na linha pectínea do lado afetado. Ele passa atrás do anel inguinal superficial e na frente do tendão conjunto, reforçando a porção medial do canal inguinal.
2. Fáscias e Camadas
As camadas de cobertura da parede abdominal anterior.
- Fáscia de Scarpa
- Nome Moderno: Lâmina membranácea da tela subcutânea.
- Quem foi: Antonio Scarpa (anatomista italiano, séc. XVIII/XIX).
- Descrição: A camada membranosa mais profunda da gordura abaixo da pele.
- Fáscia de Camper
- Nome Moderno: Lâmina adiposa da tela subcutânea.
- Quem foi: Petrus Camper (anatomista holandês, séc. XVIII).
- Descrição: A camada de gordura superficial e fofa logo abaixo da pele.
- Fáscia de Colles
- Nome Moderno: Fáscia membranácea do períneo.
- Quem foi: Abraham Colles (cirurgião irlandês, séc. XIX).
- Descrição: A continuação da Fáscia de Scarpa na região do períneo e escroto/lábios.
3. Espaços e Áreas Definidas
Marcos geográficos críticos para cirurgia e diagnóstico.
- Trígono de Hesselbach
- Nome Moderno: Trígono Inguinal.
- Quem foi: Franz Kaspar Hesselbach (anatomista alemão, séc. XIX).
- Descrição: A área triangular na parede posterior da virilha onde ocorrem as hérnias diretas. Delimitado pelos vasos epigástricos inferiores, a borda do músculo reto (Ligamento de Henle) e o ligamento inguinal.
- Orifício de Fruchaud
- Nome Moderno: Orifício Miopectíneo.
- Quem foi: Henri Fruchaud (cirurgião francês, séc. XX).
- Descrição: O “grande buraco” conceitual na parede abdominal que engloba todas as potenciais hérnias da virilha (direta, indireta e femoral), que deve ser coberto pela tela.
- Espaço de Bogros
- Nome Moderno: Espaço Retroinguinal (pré-peritoneal lateral).
- Quem foi: Jean-Annet de Bogros (anatomista francês, séc. XIX).
- Descrição: O espaço virtual atrás da fáscia transversal e à frente do peritônio, onde as telas são colocadas nas cirurgias laparoscópicas (TEP/TAPP).
- Espaço de Retzius
- Nome Moderno: Espaço Retropúbico (pré-vesical).
- Quem foi: Anders Retzius (anatomista sueco, séc. XIX).
- Descrição: O espaço atrás do osso púbico e à frente da bexiga, medial ao espaço de Bogros.
4. Linfonodos e Vasos
- Gânglio de Cloquet (ou Rosenmüller)
- Nome Moderno: Linfonodo inguinal profundo proximal.
- Quem foram: Jules Germain Cloquet (francês) e Johann Christian Rosenmüller (alemão).
- Descrição: O linfonodo localizado dentro do canal femoral, que pode simular uma hérnia se estiver inflamado.
- Corona Mortis (Termo clássico, não epônimo de pessoa)
- Tradução: Coroa da Morte.
- Descrição: Uma variação vascular perigosa (conexão entre vasos ilíacos externos e internos) que passa sobre o osso púbico, com risco de hemorragia grave se lesada durante a cirurgia.
Hemorragia Digestiva
Hemorragia Gastrointestinal: Visão do Cirurgião
1.0 Introdução
A hemorragia gastrointestinal (HGI) representa uma das principais emergências médicas e cirúrgicas, demandando diagnóstico rápido e manejo assertivo. Classificamos a HGI com base em sua origem anatômica em relação ao ligamento de Treitz. A Hemorragia Digestiva Alta (HDA), proximal a este ligamento, é a mais comum, com uma incidência, no contexto dos Estados Unidos, de 67 casos por 100.000 habitantes. A Hemorragia Digestiva Baixa (HDB), originada distalmente ao ligamento, apresenta uma incidência de 36 casos por 100.000 habitantes, conforme dados do mesmo país. O manejo eficaz desses quadros exige uma abordagem sistemática e multidisciplinar, na qual o cirurgião ocupa uma posição de destaque, sendo peça-chave na condução dos casos refratários ao tratamento clínico e endoscópico.
2.0 Avaliação e Diagnóstico
2.1 Apresentação Clínica e Avaliação Inicial
A apresentação clínica da HGI varia conforme a localização e a intensidade do sangramento.
- HDA: Os sinais clássicos são a hematêmese (vômito com sangue vivo ou com aspecto de “borra de café”) e a melena (fezes enegrecidas, de odor fétido), que pode manifestar-se com perdas sanguíneas de apenas 50 mL.
- HDB: O principal sinal é a hematoquezia (eliminação de sangue vivo ou marrom nas fezes). É crucial ressaltar que a hematoquezia pode ocorrer em 10-15% dos casos de hemorragia digestiva alta maciça, um sinal de sangramento de grande volume e trânsito acelerado, geralmente associado à instabilidade hemodinâmica.
- Avaliação de Severidade: A anamnese e o exame físico são primordiais para determinar a estabilidade hemodinâmica do paciente. A perda de volemia correlaciona-se diretamente com as alterações nos sinais vitais:
- Perda < 15% (<750 mL): Sinais vitais podem estar normais.
- Perda de 15-30% (750-1500 mL): Taquicardia (FC > 100 bpm) e débito urinário reduzido (≤ 30 mL/h).
- Perda de 30-40% (1500-2000 mL): Hipotensão, taquicardia acentuada (FC > 120 bpm) e confusão mental.
- Perda > 40% (>2000 mL): Hipotensão grave, taquicardia (FC > 140 bpm), taquipneia e letargia, com débito urinário insignificante.
- Exames Laboratoriais: A avaliação laboratorial inicial deve incluir hemograma completo, tipagem sanguínea e provas de coagulação, além de avaliação das funções hepática e renal. Uma relação entre a Ureia e a Creatinina sérica (em inglês, Blood Urea Nitrogen ou BUN, resultando na razão BUN/Creatinina) ≥ 30 é um forte preditor de hemorragia digestiva alta.
2.2 Abordagem Diagnóstica por Localização
- Hemorragia Digestiva Alta (HDA):
- Causas Principais: Doença ulcerosa péptica, varizes esofágicas, esofagite, gastrite, lesão de Dieulafoy, lacerações de Mallory-Weiss e neoplasias.
- Diagnóstico: A endoscopia digestiva alta é a modalidade diagnóstica e terapêutica de eleição, devendo ser realizada preferencialmente nas primeiras 24 horas. É imperativo notar que, na suspeita de sangramento por varizes esofágicas, este intervalo deve ser encurtado para 12 horas. Os achados são estratificados pela Classificação de Forrest, que correlaciona o aspecto da lesão (sangramento arterial ativo [Ia], sangramento babante [Ib], vaso visível não sangrante [IIa], coágulo aderido [IIb]) com o risco de ressangramento, orientando a terapêutica.
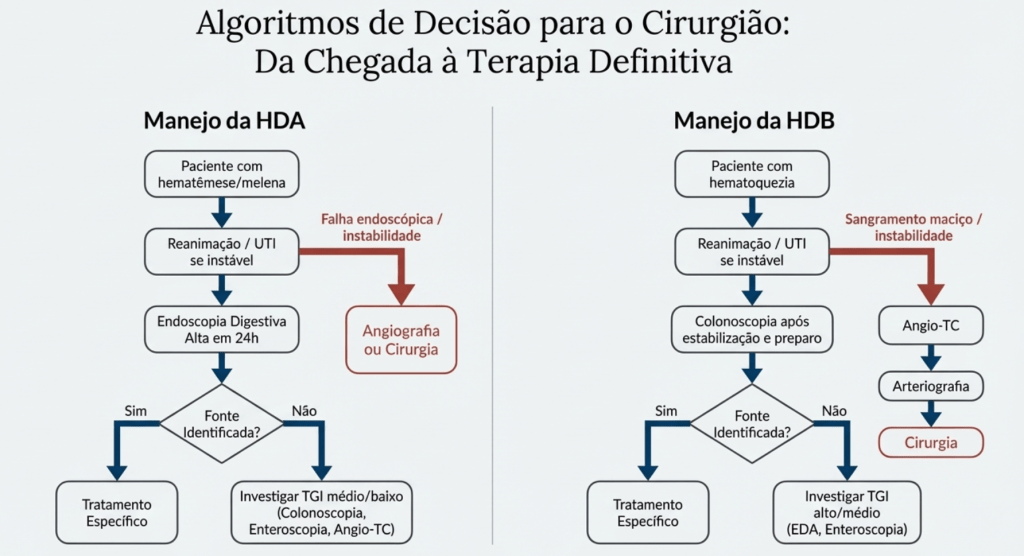
- Hemorragia Digestiva Baixa (HDB):
- Causas Principais: Doença diverticular, angiodisplasia, colites (infecciosa, isquêmica), doença inflamatória intestinal e neoplasias.
- Diagnóstico: Em pacientes estáveis, a colonoscopia é o exame de escolha. Para pacientes instáveis com sangramento ativo e maciço, a angiotomografia computadorizada (Angio-TC) e a arteriografia são fundamentais. A Angio-TC pode detectar sangramentos a uma taxa de 0.3-0.5 mL/min, enquanto a arteriografia requer uma taxa de 0.5-1.0 mL/min, permitindo, contudo, a embolização terapêutica. Em casos de melena com endoscopia alta negativa, a colonoscopia é frequentemente indicada para investigar lesões no cólon direito, que podem apresentar-se de forma atípica.
3.0 Aplicação na Cirurgia Digestiva: O Papel do Cirurgião
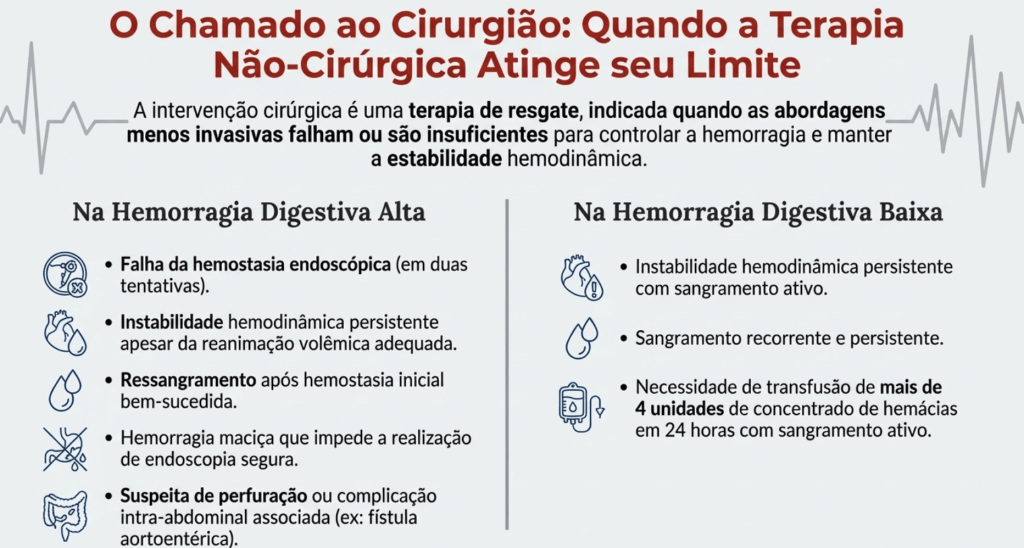
A intervenção cirúrgica é, na maioria das vezes, uma terapia de resgate na HGI, reservada para cenários específicos e bem definidos.
3.1 Indicações para Intervenção Cirúrgica
As indicações para uma cirurgia de urgência incluem:
- Falha do tratamento endoscópico ou angiográfico em controlar a hemorragia.
- Instabilidade hemodinâmica persistente, a despeito de ressuscitação volêmica adequada.
- Ressangramento recorrente ou persistente.
- Necessidade de transfusão maciça (para HDB, definida como > 4 unidades de concentrado de hemácias em 24 horas).
- Condições associadas que requerem abordagem cirúrgica, como perfuração ou malignidade.
3.2 Estratégias Cirúrgicas na Hemorragia Digestiva Alta
- Úlcera Duodenal: A abordagem cirúrgica clássica para a úlcera péptica duodenal sangrante consiste em duodenotomia anterior, ligadura direta do vaso sangrante (geralmente a artéria gastroduodenal) com pontos em “U, seguida de uma piloroplastia tipo Heineke-Mikulicz. Em pacientes estáveis, a vagotomia troncular pode ser associada para tratar a doença ulcerosa de base.
- Úlcera Gástrica: O tratamento de eleição é a ressecção da úlcera, seja por gastrectomia em cunha ou por uma gastrectomia distal (ex: Billroth I/II). A excisão é imperativa para análise histopatológica, dado que 4-5% das úlceras com aparência benigna podem, na verdade, ser malignas.
- Varizes Esofágicas: A cirurgia é uma terapia de resgate. As opções incluem shunts portossistêmicos (seletivos ou não seletivos) para descompressão portal ou procedimentos de desvascularização (ex: procedimento de Sugiura) em casos selecionados.
- Lesão de Mallory-Weiss: A necessidade de tratamento cirúrgico é rara, consistindo na sutura da laceração esofágica por via laparoscópica ou aberta.
3.3 Estratégias Cirúrgicas na Hemorragia Digestiva Baixa
A localização pré-operatória precisa do sítio de sangramento é o fator mais crítico para o sucesso cirúrgico na HDB.
- Quando o ponto de sangramento é identificado, a ressecção segmentar do cólon é o procedimento de escolha.
- Em pacientes instáveis com sangramento maciço de fonte não localizada, a colectomia subtotal com ileostomia terminal é o procedimento indicado. Esta abordagem está associada a taxas de morbidade de aproximadamente 37% e de mortalidade entre 11% e 33%.
4.0 Pontos-Chave para a Prática Cirúrgica
- A avaliação inicial focada na estabilidade hemodinâmica dita o ritmo da investigação e do tratamento.
- A endoscopia digestiva alta é o pilar diagnóstico e terapêutico na HDA, e a Classificação de Forrest é essencial para guiar a conduta pós-endoscópica.
- A cirurgia na HGI é predominantemente uma terapia de resgate, indicada após falha das modalidades menos invasivas ou em casos de instabilidade hemodinâmica refratária.
- A localização pré-operatória do sítio de sangramento na HDB é fundamental para minimizar a morbimortalidade, sendo a colectomia subtotal reservada para emergências com fonte desconhecida.

5.0 Conclusões
O manejo da hemorragia gastrointestinal é um desafio complexo que exige uma abordagem multidisciplinar e bem coordenada. Embora a cirurgia seja frequentemente uma terapia de resgate, o cirurgião deve ser envolvido precocemente na avaliação de pacientes graves. Um profundo conhecimento das opções diagnósticas e terapêuticas, tanto cirúrgicas quanto não cirúrgicas, é indispensável para garantir a tomada de decisão correta e o melhor desfecho para o paciente.
“A ligadura direta das varizes esofágicas representa a abordagem mais fundamental para controlar uma hemorragia que ameaça a vida.” – Inspirado nos trabalhos de George Crile Jr., 1950.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#HemorragiaGastrointestinal #CirurgiaDigestiva #CirurgiaGeral #HemorragiaDigestiva #Medicina
Além do Bisturi: A Filosofia Cirúrgica de René Leriche e a Revolução Fisiológica
Na história da medicina, existem cirurgiões famosos por suas mãos ágeis e outros lembrados por suas mentes inquietas. René Leriche (1879-1955) pertence, indubitavelmente, à segunda categoria. Embora fosse um operador exímio, seu verdadeiro bisturi era o intelecto. Autor da obra seminal “La chirurgie, discipline de la connaissance” (A cirurgia, disciplina do conhecimento), Leriche não via a sala de operações apenas como um local de reparo mecânico, mas como um laboratório vivo de fisiologia. Para ele, operar era interrogar a vida. Neste artigo, revisitamos a filosofia deste gigante francês e como ele transformou a cirurgia de um ofício anatômico para uma ciência biológica.
Da Anatomia Estática à Fisiologia Dinâmica
Até o início do século XX, a cirurgia era predominantemente “anatômica”. O cirurgião era visto como um encanador de luxo: removia-se o que estava podre, costurava-se o que estava rasgado, drenava-se o que estava infectado. O foco era a lesão estrutural visível. Leriche desafiou esse paradigma. Ele argumentava que a lesão anatômica era frequentemente o fim da doença, não o começo. A verdadeira patologia residia no distúrbio funcional invisível que precedia a lesão.
“A doença é, antes de tudo, um drama funcional que se desenrola no silêncio dos tecidos.”
Essa visão deu origem ao conceito de Cirurgia Fisiológica. O objetivo não deveria ser apenas a extirpação do órgão doente (uma “confissão de fracasso”, segundo ele), mas a restauração da função normal, muitas vezes através da manipulação do sistema nervoso autônomo e da vascularização.
A Cirurgia como “Vivissecção Terapêutica”
Leriche elevou o status epistemológico da cirurgia. Ele afirmava que o cirurgião possuía um privilégio que o anatomista e o patologista não tinham: o acesso à patologia viva. Enquanto a anatomia patológica estuda as “cinzas do incêndio” (o tecido morto), a cirurgia observa o “fogo” (a doença em evolução). Portanto, a cirurgia deveria ser uma “disciplina do conhecimento”, onde cada intervenção serve para entender a fisiopatologia humana. Para Leriche, um cirurgião que não raciocina fisiologicamente é apenas um técnico manual, fadado à obsolescência.
A Dor como Doença (La Douleur-Maladie)
Talvez a contribuição mais humanística de Leriche tenha sido sua guerra contra a dor. Rompendo com a tradição estoica que via a dor como um mecanismo de defesa útil ou um aviso benéfico, Leriche a classificou como um erro biológico. Ele cunhou o termo “A Dor-Doença”. Na visão dele, a dor crônica não protege; ela destrói. Ela altera a personalidade, esgota as reservas vitais e cria um ciclo vicioso simpático que perpetua o sofrimento. Suas pesquisas sobre a causalgia e o papel do sistema simpático na dor abriram as portas para a moderna medicina da dor e a neuromodulação. Foi neste contexto que ele nos legou sua definição poética e precisa de saúde:
“A saúde é a vida no silêncio dos órgãos.”
O Legado de Leriche na Cirurgia Moderna
Por que ler René Leriche em pleno século XXI? Porque a cirurgia moderna é, em essência, a realização do sonho de Leriche. Quando realizamos uma cirurgia metabólica para tratar diabetes (e não apenas para reduzir o estômago), estamos praticando a cirurgia fisiológica de Leriche. Quando utilizamos bloqueios nervosos ou estimulação medular, estamos seguindo seus passos no controle da dor. Quando buscamos a preservação de órgãos em vez da amputação, honramos sua filosofia. René Leriche nos ensinou que a técnica é indispensável, mas é a fisiologia que deve guiar a mão do cirurgião. O virtuosismo técnico sem base científica é perigoso; a ciência sem técnica é impotente. O cirurgião completo, portanto, é aquele que opera com as mãos, mas corta com a mente.

Gostou desta reflexão histórica? Acompanhe o The Surgeon para mais conteúdos sobre a arte, a ciência e a filosofia da cirurgia.
A Dualidade da Humanização Cirúrgica
Era da Inteligência Artificial e da Robótica: Desafios e Perspectivas
Por Prof. Dr. Ozimo Gama
Coordenador do Curso de Medicina da Universidade Federal do Maranhão
O Cenário Atual e a Necessidade do “Toque Humano”
A prática da cirurgia do aparelho digestivo vive um momento de paradoxo fascinante. Por um lado, testemunhamos avanços tecnológicos sem precedentes, com a cirurgia robótica e a inteligência artificial (IA) redefinindo os limites do possível. Por outro, enfrentamos uma crise silenciosa na relação médico-paciente. No Brasil, segundo dados do DATASUS e do Conselho Federal de Medicina, realizamos milhões de procedimentos cirúrgicos anuais pelo Sistema Único de Saúde (SUS), onde a alta demanda muitas vezes colide com a necessidade de um atendimento individualizado.
A “humanização” não é apenas um conceito abstrato ou uma “soft skill” desejável; é um imperativo clínico. Estudos epidemiológicos demonstram que pacientes que estabelecem uma relação de confiança sólida com seus cirurgiões apresentam melhor adesão ao tratamento pós-operatório, menores índices de litígios médicos e, subjetivamente, uma percepção de dor reduzida.
O desafio contemporâneo, como bem alertava o Prof. Alcino Lázaro da Silva, é evitar que o “fascínio das máquinas e dos botões” transforme o jovem cirurgião em um “sectário ou robô”. Precisamos integrar a tecnologia sem permitir que ela congele nossos sentimentos ou desqualifique a essência da nossa profissão: o cuidado com o ser humano.
Tecnologia, Ontoética e Controvérsias
A Inteligência Artificial e a Despersonalização
A IA chegou para auxiliar na tomada de decisão, predizendo complicações e otimizando fluxos em centros cirúrgicos. No entanto, existe o risco real da “atrofia da empatia”. Quando confiamos excessivamente em algoritmos para o prognóstico, corremos o risco de tratar o paciente como um conjunto de dados biométricos, e não como uma biografia. A tecnologia deve ser uma ferramenta de meio, nunca de fim. O cirurgião que se esconde atrás da tela do computador perde a oportunidade de exercer a “Ontoética” — a ética do ser, o respeito intrínseco à vida humana que transcende a técnica.
Aspectos Médico-Legais e o Consentimento
A humanização tem implicações jurídicas diretas. O Prof. Milton Glezer destaca que o paciente tem o direito de recusar tratamento (salvo risco iminente de morte) e de ter acesso irrestrito ao seu prontuário. No Brasil, a judicialização da medicina tem crescido exponencialmente. Uma parte significativa desses processos não decorre de erro técnico (imperícia), mas de falha na comunicação. O Consentimento Livre e Esclarecido não deve ser apenas um formulário burocrático assinado na admissão. Ele deve ser um processo contínuo de diálogo, onde o cirurgião traduz o “tecniquês” para a realidade do doente, respeitando sua autonomia e dignidade.
Controvérsias Filosóficas
A controvérsia reside na formação médica atual. Os currículos de graduação e residência muitas vezes privilegiam a técnica em detrimento da humanística. Criamos excelentes técnicos capazes de realizar gastrectomias complexas, mas que, por vezes, falham em comunicar um diagnóstico de câncer gástrico com a compaixão necessária. A escola médica deve ensinar que o doente prefere, acima do tecnocrata, o amigo; acima do executor de procedimentos, o médico que orienta e acolhe.
Aplicação Prática na Cirurgia do Aparelho Digestivo
Na nossa especialidade, a humanização possui facetas muito específicas e impactantes:
- Ostomias e Imagem Corporal: Ao indicar uma colostomia definitiva, por exemplo, o cirurgião digestivo não está apenas alterando a anatomia, mas a autoimagem e a vida social do paciente. A abordagem humanizada exige preparar este paciente psicologicamente, envolvendo a equipe multidisciplinar e a família antes mesmo do ato cirúrgico.
- Oncologia Cirúrgica: O diagnóstico de neoplasias do trato gastrointestinal carrega um estigma de mortalidade. A forma como a notícia é dada (protocolo SPIKES, por exemplo) é tão crucial quanto a linfadenectomia realizada.
- Cirurgia Bariátrica: O paciente obeso muitas vezes carrega anos de preconceito, inclusive dentro do sistema de saúde. A humanização aqui significa enxergar a obesidade como doença crônica, despindo-se de julgamentos morais e oferecendo um suporte que vai além da perda de peso.
Pontos-Chave para a Prática Diária
Para o residente e o jovem cirurgião, a humanização se traduz em atos concretos:
- Olho no Olho: A tecnologia (computadores, tablets) não deve ser uma barreira física durante a consulta. Sente-se, olhe para o paciente e escute ativamente antes de examinar.
- Identificação Clara: Como preconizado nas diretrizes hospitalares, apresente-se, diga sua função e certifique-se de que o paciente sabe quem é o responsável pelo seu tratamento (titularidade médica).
- Gestão da Expectativa: Explique riscos e benefícios reais. A frustração do paciente muitas vezes nasce de uma expectativa irrealista não corrigida pelo cirurgião no pré-operatório.
- O “Não” Terapêutico: Saber a hora de não operar (obstinação terapêutica) em casos de carcinomatose ou doenças terminais é, talvez, a maior prova de humanidade e ética cirúrgica.
Perspectivas Futuras
O futuro da Cirurgia do Aparelho Digestivo não será definido apenas pela precisão dos robôs ou pela acurácia dos algoritmos de IA, mas pela nossa capacidade de manter a essência humana em um ambiente cada vez mais digital. A “Ontoética” deve guiar nossas mãos tanto quanto a anatomia.
Precisamos formar cirurgiões “híbridos”: exímios operadores da tecnologia, mas profundos conhecedores da alma humana. Como discutido nos textos bases, o hospital deve buscar trazer esperança, e o médico deve lembrar que, ao tratar um doente, está lidando com uma unidade indivisível de medos, histórias e sentimentos. A tecnologia passa, a máquina obsoleta é trocada, mas o impacto de um atendimento humano perdura na memória do paciente e de seus familiares.
#CirurgiaDigestiva #HumanizaçãoMédica #Bioética #EducaçãoMédica #OncologiaCirurgica
“O único meio de combater a praga da impessoalidade e da frieza na medicina moderna é cultivar as humanidades no médico, pois o segredo do cuidado com o paciente é importar-se com o paciente.” — Adaptado de Francis Peabody (embora clínico, sua máxima é a pedra angular para a humanização cirúrgica moderna).
Gostou? ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat Online em nossa DM do Instagram.
Princípios Fundamentais da Oncologia Cirúrgica Digestiva
Uma Abordagem Contemporânea e Baseada em Evidências
O Cenário Atual do Câncer Digestivo no Brasil
A Cirurgia do Aparelho Digestivo vive um momento de transformação sem precedentes. Não somos mais apenas “técnicos de ressecção”, mas parte integrante de uma complexa engrenagem multidisciplinar. A relevância deste tema é sublinhada pelos dados epidemiológicos alarmantes. Se no passado nos baseávamos em estimativas modestas, hoje a realidade é desafiadora: segundo a Estimativa 2023-2025 do Instituto Nacional de Câncer (INCA), esperam-se 704 mil casos novos de câncer por ano no Brasil.
Destaque-se que as neoplasias do trato gastrointestinal ocupam posições cimeiras. O câncer colorretal figura como o segundo mais incidente em mulheres e homens na maioria das regiões, com cerca de 45 mil novos casos anuais, seguido de perto pelo câncer de estômago (21 mil casos) e esôfago. Estes números não são apenas estatísticas; representam uma demanda crescente por cirurgiões oncológicos altamente qualificados, capazes de compreender não apenas a anatomia, mas a biologia tumoral.
A Biologia como Norte da Técnica Cirúrgica
Fisiopatologia e Disseminação
O entendimento clássico da cirurgia oncológica, herdado dos princípios de William Halsted no final do século XIX, baseava-se na premissa de que o câncer era uma doença puramente local que se disseminava centrifugamente. Embora a radicalidade (ressecção em bloco) permaneça um pilar, hoje compreendemos a doença como sistêmica desde fases precoces em muitos casos.
A disseminação ocorre por três vias principais que o cirurgião deve dominar:
- Linfática: Predominante em carcinomas (ex: adenocarcinoma gástrico e cólon).
- Hematogênica: Preferencial em sarcomas e carcinomas avançados (fígado e pulmões como sítios-alvo).
- Transcelômica (Peritoneal): Comum em neoplasias gástricas T3/T4, ovário e apêndice, exigindo estratégias específicas como a peritoniectomia.
O Princípio da Radicalidade e Margens (R0)
O objetivo primário da cirurgia oncológica curativa é a ressecção R0 (ausência de doença residual macroscópica e microscópica). A cirurgia R1 (doença microscópica residual) ou R2 (macroscópica) impacta drasticamente o prognóstico.
- Ressecção em Bloco: O tumor nunca deve ser violado. A peça deve ser removida envolta por tecido saudável, respeitando as fáscias anatômicas e os pedículos vasculares na sua origem.
- Linfadenectomia: Não serve apenas para estadiamento, mas tem papel terapêutico. No câncer gástrico, por exemplo, a linfadenectomia D2 é o padrão-ouro em centros especializados, associada a menor recidiva locorregional.
Neoadjuvância vs. Adjuvância
A decisão entre operar primeiro (upfront surgery) ou indicar terapia neoadjuvante é um dos grandes debates atuais.
- Vantagens da Neoadjuvância: Tratamento precoce de micrometástases, redução do tumor (downstaging) facilitando a ressecção R0 e teste in vivo da quimiossensibilidade. É o padrão atual para câncer de esôfago localmente avançado e câncer de reto médio/baixo.
- Vantagens da Adjuvância: Baseada no estadiamento patológico preciso (pTNM), evitando tratamento excessivo em estádios precoces.
Aplicação Prática na Cirurgia Digestiva
A prática moderna exige que o cirurgião diferencie dois conceitos cruciais frequentemente confundidos: Ressecabilidade e Operabilidade.
- Ressecabilidade: É uma característica do tumor (relação com estruturas vitais).
- Operabilidade: É uma característica do paciente (reserva funcional, comorbidades, status performance). Um tumor pode ser ressecável, mas o paciente inoperável.
O Papel da Citorredução e HIPEC
Para a carcinomatose peritoneal, historicamente considerada uma condição terminal, houve uma mudança de paradigma. Em neoplasias selecionadas (como pseudomixoma peritoneal, mesotelioma e alguns casos de câncer colorretal), a combinação de Cirurgia de Citorredução (Peritoniectomia) com Quimioterapia Intraperitoneal Hipertérmica (HIPEC) tem oferecido sobrevida em longo prazo, transformando uma doença fatal em uma condição crônica tratável.
Planejamento Multidisciplinar
O cirurgião oncológico não atua isolado. A discussão em Tumor Boards é mandatória. A indicação cirúrgica deve considerar a biologia molecular (ex: status do gene APC em colorretal, superexpressão de HER2 em gástrico) e a resposta a terapias sistêmicas.
Pontos-Chave para a Prática Cirúrgica
- Estadiamento Preciso: Nunca leve um paciente à sala sem um estadiamento completo. A laparoscopia diagnóstica é fundamental em tumores gástricos e pancreáticos para evitar laparotomias desnecessárias em casos de carcinomatose oculta.
- Margens Cirúrgicas: A margem circunferencial (radial) no câncer de reto e a margem proximal no câncer gástrico e esofágico são preditores independentes de sobrevida.
- Manuseio da Peça (“No-touch technique”): Evite a manipulação direta do tumor. A ligadura vascular prévia e a mobilização cuidadosa previnem a embolização tumoral intraoperatória.
- Documentação: O relatório cirúrgico deve detalhar as cadeias linfáticas dissecadas e as estruturas preservadas ou ressecadas, orientando o patologista e o oncologista clínico.
Perspectivas Futuras
A cirurgia digestiva na sua área de atuação oncológica evoluiu de amputações extensas para procedimentos de precisão, muitas vezes minimamente invasivos (laparoscópicos ou robóticos), sem perder a radicalidade oncológica. O futuro aponta para uma integração ainda maior com a biologia molecular e a imunoterapia. O cirurgião do futuro deverá ser, antes de tudo, um oncologista que opera: alguém que entende que o bisturi é apenas uma das armas, e que saber quando não operar é tão vital quanto a técnica operatória refinada.
Como nos ensinou o pai da cirurgia oncológica moderna:
“O cirurgião deve ser o médico do paciente oncológico, e não apenas o técnico que remove o tumor.” — William Stewart Halsted
Hashtags
#CirurgiaDigestiva #OncologiaCirurgica #EducaçãoMédica #ResidenciaCirurgia #CancerDigestivo
Gostou? ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat Online em nossa DM do Instagram.
ASPECTOS MÉDICO-LEGAIS DA LESÃO INADVERTIDA DA VIA BILIAR
- Membro Titular do Colégio Brasileiro de Cirurgiões
- Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
1. Introdução
A lesão inadvertida da via biliar (LVB) é a complicação com maior impacto clínico, emocional e jurídico da colecistectomia. Em muitos países, é uma das principais causas de processos por erro médico em cirurgia geral. Do ponto de vista médico-legal, o ponto central não é a existência da lesão em si, mas a forma como o cirurgião:
- Indicou a cirurgia;
- Conduziu o procedimento (técnica, CVS, bailouts);
- Reconheceu e tratou a lesão;
- Documentou e comunicou o evento ao paciente e à família.
Este texto aborda, em linguagem direta, os principais aspectos médico-legais que o cirurgião geral | cirurgião do aparelho digestivo precisa dominar frente a uma suspeita de lesão iatrogênica da via biliar principal.

2. Lesão de via biliar ≠ erro médico automático
Juridicamente, lesão de via biliar é, em princípio, um evento de risco inerente ao procedimento, sobretudo na colecistectomia laparoscópica, reconhecido em diretrizes nacionais e internacionais.
Em termos de responsabilidade profissional, o que será avaliado é se houve:
- Indicação adequada da cirurgia;
- Técnica compatível com o padrão atual (CVS, uso de bailouts, conversão quando necessário);
- Diligência no reconhecimento precoce da lesão;
- Conduta correta após o dano (referência, reconstrução, suporte);
- Transparência na comunicação.
Ou seja: não é a complicação que gera responsabilidade, e sim a condução inadequada antes, durante ou depois do evento.
3. Consentimento informado
Do ponto de vista pericial, o consentimento é peça-chave:
- A colecistectomia deve ser apresentada como procedimento com:
- Risco de sangramento, infecção, fístula biliar, lesão de via biliar e necessidade de reoperação.
- O termo deve ser:
- Claro, objetivo, datado, assinado pelo paciente (ou responsável) e pela equipe.
- Ideal:
- Anotação no prontuário reforçando que os riscos foram explicados verbalmente.
Em muitos litígios, a ausência de menção à possibilidade de lesão de via biliar no consentimento é usada como argumento de falha na informação, mesmo quando a técnica foi correta.
4. Padrão técnico esperado (CVS, bailouts e conversão)
Peritos costumam avaliar:
- Se houve tentativa documentada de obter o Critical View of Safety;
- Se o cirurgião reconheceu a “vesícula difícil” e utilizou manobras de bailout (subtotal, fundo–primeiro, conversão, abandono);
- Se a insistência em dissecar um triângulo de Calot obliterado foi temerária.
Alguns pontos práticos com peso médico-legal:
- Não obter CVS e mesmo assim clipar e seccionar estruturas é quase sempre visto como conduta imprudente.
- Não converter ou não chamar ajuda em cirurgias claramente difíceis pode ser interpretado como negligência.
- O uso de colangiografia intraoperatória em caso de dúvida anatômica é bem visto pericialmente, mesmo que não obrigatório.
5. Reconhecimento e manejo da lesão intraoperatória
Do ponto de vista jurídico, lesão reconhecida e tratada intraoperatória gera cenário muito mais favorável ao cirurgião do que lesão ignorada e diagnosticada tardiamente com peritonite biliar ou sepse.
Boas práticas com impacto médico-legal:
- Se houver suspeita de lesão maior:
- Registrar no ato operatório que houve dificuldade anatômica e suspeita de dano.
- Se a equipe não tiver expertise em reconstrução, não improvisar; encaminhar para centro de referência.
- Drenos adequados e exames de imagem precoces (TC, colangioRM, CPRE) em pós-operatório duvidoso demonstram diligência.
A omissão em investigar icterícia, febre ou saída de bile por dreno no pós-operatório é frequentemente qualificada como negligência em perícias.
6. Documentação operatória
O relatório cirúrgico é uma das peças centrais em processos médico-legais. Deve conter:
- Indicação da cirurgia (cólica biliar, colecistite aguda, etc.);
- Achados intraoperatórios (inflamação, fibrose, “vesícula difícil”);
- Descrição da técnica:
- Tentativa de obter CVS;
- Uso de colangiografia intraoperatória, quando feita;
- Manobras de bailout, conversão, subtotal, etc.;
- Quaisquer intercorrências (sangramento, suspeita de lesão, necessidade de sutura em via biliar, etc.).
A ausência de descrição detalhada geralmente é interpretada contra o cirurgião, pois abre espaço para a presunção de que padrões técnicos não foram seguidos.
7. Comunicação com o paciente e a família
A forma como o cirurgião comunica a complicação é relevante:
- Negar ou minimizar o evento, ou culpar exclusivamente “o organismo do paciente”, costuma agravar o conflito.
- O recomendado é:
- Explicar com clareza o que ocorreu;
- Deixar claro que a complicação está sendo manejada com todos os recursos disponíveis;
- Documentar o conteúdo da conversa no prontuário.
Transparência e empatia costumam reduzir a judicialização. O oposto também é verdadeiro.
8. Encaminhamento a centros de referência
Outra questão avaliada em perícia é quando e para onde o paciente foi encaminhado:
- Lesões complexas (Strasberg E, perda de segmento biliar, comprometimento vascular) não devem ser reparadas por equipes sem experiência em reconstrução biliodigestiva.
- Reconstruções malsucedidas em série, feitas em hospitais sem expertise, frequentemente são interpretadas como imprudência e imperícia.
O encaminhamento precoce para centro com cirurgião HPB experiente demonstra boa prática e costuma ter peso favorável em eventual demanda judicial.
9. Papel das diretrizes e literatura
Em perícia, é comum a comparação da conduta com:
- Diretrizes societárias (CBCD, WSES, SAGES, EAES etc.);
- Protocolos hospitalares;
- “Estado da arte” à época do procedimento (por exemplo, reconhecimento do CVS como padrão-ouro).
Se o cirurgião seguiu recomendações amplamente aceitas, é difícil sustentar que houve erro grosseiro, mesmo diante de complicação grave.
10. Dano, nexo causal e responsabilidade
Em termos médico-legais, três elementos precisam estar presentes para configurar responsabilidade civil:
- Ato ou omissão culposa (técnica inadequada, falta de diligência, ausência de informação).
- Dano (lesão de via biliar, perda de parte do fígado, invalidez, óbito).
- Nexo causal entre a conduta e o dano.
Exemplo:
– Lesão biliar reconhecida, adequadamente reparada em centro de referência, com boa evolução → pode ser entendida como complicação aceitável.
– Lesão ignorada, sem investigação, evoluindo para sepse e transplante → há forte argumento de falha na assistência.
11. Estratégias de prevenção médico-legal
Em linhas simples:
- Indique bem (indicação precisa e registrada).
- Faça CVS sempre que possível e saiba abandonar a dissecção perigosa.
- Use bailouts (subtotal, fundo–primeiro, conversão) quando necessário; não insista em anatomia impossível.
- Documente tudo (relatório detalhado, fotos/vídeos, evolução diária).
- Investigue sinais de complicação sem demora.
- Encaminhe cedo lesões complexas a centros de referência.
- Comunique com clareza e registre a conversa.
Essas medidas não apenas reduzem o risco de processo, mas principalmente melhoram o cuidado ao paciente, que é o objetivo central.
“O objetivo técnico principal na Colecistectomia, não é a retirada da vesícula biliar, mas proteger a via biliar principal.” Prof. Dr. Ozimo Gama
Hashtags (SEO)
#LesãoDeViaBiliar #ResponsabilidadeMédica #CirurgiaDigestiva #MedicinaLegal #CriticalViewOfSafety
Colecistectomia Segura: Plano R4U
O Imperativo do Sulco de Rouvière e a Visão Crítica de Segurança
Autor: Prof. Dr. Ozimo Gama
Afiliação: Membro Titular do Colégio Brasileiro de Cirurgiões
Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
Introdução
A colecistectomia laparoscópica (CL) permanece como um dos procedimentos cirúrgicos mais executados globalmente. No entanto, sua ubiquidade não mitiga riscos inerentes; a variação anatômica dos ductos biliares, combinada à identificação visual incorreta, continua a precipitar complicações graves, notadamente as lesões iatrogênicas das vias biliares[1]. Neste cenário, a segurança do paciente transcende a destreza manual, residindo na identificação rigorosa de marcos anatômicos imutáveis. Entre estes, o sulco de Rouvière (SR) emerge não apenas como detalhe morfológico, mas como farol essencial para a orientação cirúrgica segura[2].
A Nomenclatura e a Realidade Anatômica
A precisão cirúrgica exige precisão anatômica. Na literatura, o SR é referenciado sob diversas nomenclaturas, incluindo “incisura dextra de Gans”[7] e, originalmente por Henri Rouvière, como “le sillon du processus caudé”[5]. Embora textos clássicos apresentem dados inconsistentes, estudos contemporâneos demonstram a presença do SR em até 80% dos fígados[3,6]. Tal prevalência torna o reconhecimento deste marco uma competência obrigatória. A relevância topográfica do SR é crítica, estabelecendo um divisor de águas anatômico: o ducto e a artéria cística localizam-se anterossuperiormente ao sulco, enquanto o ducto biliar comum (CBD) reside abaixo do seu nível. Evidências sugerem que dissecções iniciadas ventralmente ao SR reduzem significativamente a incidência de lesões ao CBD[2]. Ademais, o marco é instrumental para a execução segura de ressecções hepáticas segmentares[4].
A Integração com a Visão Crítica de Segurança (CVS)
A técnica da Critical View of Safety (CVS), preconizada por Strasberg, é o padrão ouro para minimizar riscos de lesão biliar[1]. Contudo, a aplicação da CVS deve ser ancorada em marcos confiáveis. Variações da árvore biliar extra-hepática afetam até um terço dos pacientes[3], mas o SR tende a manter-se no mesmo plano do ducto hepático comum e do CBD, facilitando a orientação tridimensional. A identificação do SR deve ser o passo preliminar que habilita a construção segura da CVS, mormente em casos de anatomia distorcida por inflamação.
Estratégias de Contingência: A Linha R4U
Em casos onde o SR está obscurecido por fibrose ou aderências, a segurança não pode ser comprometida. A linha R4U — estendendo-se da fissura umbilical para a direita do hilo — apresenta-se como alternativa viável para delimitar um plano seguro de dissecção[2]. Todavia, a utilização eficaz da linha R4U exige profundo conhecimento da anatomia hepática e treinamento contínuo em técnicas de segurança.
Conclusão
A prevenção de lesões na CL exige uma sistematização que transcende a técnica básica. A identificação rotineira do Sulco de Rouvière e a adesão estrita à CVS são imperativos éticos e técnicos. Ao integrar o conhecimento anatômico clássico com estratégias modernas, elevamos o padrão de cuidado. Como nos lembra a sabedoria cirúrgica secular:
“O cirurgião que ignora a anatomia esculpe o corpo humano como um cego esculpe a madeira.” — Guy de Chauliac (1300–1368), Chirurgia Magna.
Referências Bibliográficas
Referências
- Strasberg, S. M., et al. “The Critical View of Safety in Laparoscopic Cholecystectomy.”
- Hugh, T. B. “Anatomical Landmarks for Safe Laparoscopic Cholecystectomy.”
- Zubair, M., et al. “Anatomical Variations in the Extrahepatic Biliary Tree.”
- Couinaud, C. “Segmental Anatomy of the Liver.”
- Rouvière, H. “Le sillon du processus caudé.”
- Reynaud, C., Coucoravas, G., Giuly, J., et al. “Incisura Dextra de Gans.”
- Hugh, T. B. “Minimal Common Bile Duct Injury During Laparoscopic Cholecystectomy.”
- Gans, H. “Incisura Dextra in Classic Anatomical Literature.”
Aula de Anatomia do Dr Nicolaes Tulp (1632)
O valor da obra “A Aula de Anatomia do Dr. Nicolaes Tulp” é incalculável, pois ela pertence ao acervo do Mauritshuis, em Haia, na Holanda, e é considerada uma das mais importantes e valiosas obras do museu. Além disso, a pintura é uma das mais famosas obras de Rembrandt e uma das mais importantes do período Barroco holandês. Por isso, é considerada uma obra-prima da arte ocidental e tem um valor histórico, artístico e cultural inestimável. Embora não haja um valor monetário exato para a pintura, pode-se dizer que é uma das obras mais valiosas e procuradas do mundo da arte, tanto pelo seu significado histórico quanto pela sua qualidade artística.
“A Aula de Anatomia do Dr. Nicolaes Tulp” é uma pintura a óleo sobre tela, criada por Rembrandt van Rijn em 1632. A obra mede 169,5 cm x 216,5 cm e está atualmente exposta no Mauritshuis, em Haia, na Holanda. A composição da pintura apresenta um grupo de homens em torno de uma mesa de dissecação, liderados pelo médico Nicolaes Tulp, que está realizando uma demonstração de anatomia. O corpo sendo dissecado é o de um criminoso enforcado chamado Aris Kindt. A composição apresenta uma disposição simétrica e organizada das figuras em torno da mesa, com Tulp no centro da imagem.
A luz na pintura é focada no corpo sendo dissecado, destacando-o em relação ao fundo escuro da sala. A técnica de chiaroscuro usada por Rembrandt acentua o realismo e o drama da cena. As figuras são pintadas em tons de marrom, cinza e preto, com destaques de branco. A obra apresenta detalhes precisos e realistas da anatomia do corpo, bem como das ferramentas médicas utilizadas na dissecação. O corpo do criminoso apresenta uma ferida na cabeça e uma perna amputada, o que sugere que ele pode ter sido executado por um crime violento.
No canto inferior direito da pintura, há um livro aberto com o título “Spiegel der Konst” (“Espelho da Arte”), um tratado de anatomia escrito por Adriaan van de Spiegel e utilizada pelos médicos da época. Em geral, a “Aula de Anatomia do Dr. Nicolaes Tulp” é uma obra-prima devido à sua técnica precisa e detalhada, bem como à sua habilidade em transmitir um senso de realismo e drama. A pintura é considerada uma das obras mais importantes do período Barroco holandês e é frequentemente citada como um exemplo do estilo de pintura de Rembrandt.
A seguir estão algumas das características artísticas e estéticas da obra:
- Composição: A pintura apresenta uma composição equilibrada e organizada, com as figuras dos membros da guilda cirúrgica em torno da mesa de dissecação centralizada.
- Luz e Sombra: Rembrandt usa uma técnica conhecida como chiaroscuro, ou contraste entre luz e sombra, para dar profundidade e dimensão à cena. A luz focaliza no cadáver e no médico principal, destacando-os do fundo escuro.
- Realismo: A pintura é altamente realista, mostrando detalhes precisos das ferramentas cirúrgicas, do cadáver e das expressões dos personagens.
- Cores: O uso limitado de cores em tons de marrom e cinza dá à pintura uma atmosfera austera e solene.
- Simbolismo: A pintura inclui vários elementos simbólicos, como a presença de uma coruja, que representa sabedoria, e a posição da mão do cadáver, que simboliza a morte.
- Técnica: A pintura foi executada com uma técnica de pincelada solta e fluida, que enfatiza a textura e a superfície da pintura.
Em geral, a “Aula de Anatomia do Dr. Nicolaes Tulp” é considerada uma obra-prima devido à sua habilidade técnica e sua capacidade de transmitir um senso de realismo e drama. A pintura é considerada uma das obras mais importantes do período Barroco holandês e é frequentemente citada como um exemplo do estilo de pintura de Rembrandt.
Anatomia Cirúrgica Hepática
O Mapa Fundamental para Ressecções e Transplantes
Autor: Prof. Dr. Ozimo Gama
Categoria: Cirurgia Hepatobiliar / Anatomia Aplicada / Transplante Hepático Tempo de Leitura: 12 minutos
“Um bom conhecimento da anatomia do fígado é um pré-requisito para a cirurgia moderna do fígado.” — H. Bismuth
Introdução
O fígado, o maior órgão sólido do corpo humano (representando 2-3% do peso corporal), é uma estrutura de complexidade arquitetônica fascinante. Para o cirurgião geral, e imperativamente para o cirurgião hepatobiliar, o domínio da anatomia hepática transcende a memorização de nomes; trata-se de compreender as relações tridimensionais que ditam a segurança de uma hepatectomia e o sucesso de um transplante. Neste artigo, dissecaremos a anatomia hepática sob uma ótica cirúrgica, indo além da morfologia externa para explorar a segmentação funcional e as nuances vasculares vitais para a prática operatória de excelência.
1. Meios de Fixação e Mobilização Cirúrgica
O fígado é envolto pela cápsula de Glisson e peritônio, exceto na “área nua” diafragmática e no hilo. Seus ligamentos não são apenas estruturas de sustentação, mas marcos anatômicos cruciais para a mobilização segura do órgão:
-
Ligamentos Coronários e Triangulares: A mobilização destes permite a exposição da veia cava inferior (VCI) e das veias hepáticas.
-
Ligamento Venoso (Arantius): Remanescente do ducto venoso fetal. Sua dissecção é uma manobra chave. Ao isolá-lo, o cirurgião ganha acesso ao tronco das veias hepáticas esquerda e média, facilitando o controle vascular em hepatectomias esquerdas ou transplantes.
-
Ligamento Hepatocaval (Makuuchi): Uma estrutura fibrosa (por vezes contendo parênquima) que fixa o lobo caudado à veia cava. Sua divisão cuidadosa é obrigatória para expor a veia hepática direita e para a mobilização completa do lobo direito em transplantes intervivos.
2. A Revolução de Couinaud
A anatomia clássica, que dividia o fígado em lobos direito, esquerdo, quadrado e caudado baseada apenas em marcos externos (como o ligamento falciforme), é insuficiente para a cirurgia moderna. A verdadeira divisão funcional segue a Linha de Cantlie, um plano imaginário que vai do leito da vesícula biliar à veia cava inferior. Esta linha divide o fígado em metades funcionalmente independentes (Direita e Esquerda), cada uma com sua própria irrigação arterial, portal e drenagem biliar.
Adotamos a Segmentação de Couinaud (1954), que organiza o fígado em 8 segmentos baseados na distribuição das veias hepáticas e pedículos portais:
-
Fígado Direito (Setores Anterior e Posterior): Segmentos V, VIII (Anterior) e VI, VII (Posterior).
-
Fígado Esquerdo: Segmentos II, III (Lateral) e IV (Medial).
-
Lobo Caudado (Segmento I): Uma entidade autônoma. Localizado dorsalmente, recebe sangue de ambos os ramos portais (direito e esquerdo) e drena diretamente na VCI através de veias curtas. Esta drenagem direta confere ao caudado uma “proteção” relativa em casos de Síndrome de Budd-Chiari, onde ele frequentemente se hipertrofia.
3. O Hilo Hepático e a Tríade Portal
A dissecção do hilo exige precisão milimétrica, especialmente em transplantes com doador vivo (LDLT). As estruturas da tríade portal seguem uma organização anteroposterior constante que guia o cirurgião:
-
Ducto Biliar: Mais ventral (anterior) e lateral.
-
Artéria Hepática: Medial e na camada intermédia.
-
Veia Porta: A estrutura mais dorsal (posterior).
Variações Vasculares Importantes
-
Artéria Hepática: A anatomia “clássica” (artéria hepática comum saindo do tronco celíaco) está presente em apenas 60% dos casos. Variações críticas incluem a Artéria Hepática Direita Substituída (da Mesentérica Superior), que passa posterior à veia porta, e a Artéria Hepática Esquerda Substituída (da Gástrica Esquerda). O não reconhecimento pode levar à necrose do enxerto ou isquemia biliar.
-
Veia Porta: Variações na bifurcação, como a ausência do tronco principal da veia porta direita (trifurcação), exigem reconstruções complexas em transplantes.
4. Drenagem Venosa: O Escoamento
As três veias hepáticas principais (Direita, Média e Esquerda) correm nas fissuras intersegmentares:
-
Veia Hepática Direita (RHV): Drena o setor posterior. É a maior veia.
-
Veia Hepática Média (MHV): Corre na fissura principal (Linha de Cantlie). Fundamental para a drenagem dos segmentos V e VIII. Em transplantes de lobo direito, a gestão dos tributários da MHV é crítica para evitar congestão do enxerto.
-
Veias Acessórias: Cerca de metade da população possui veias hepáticas acessórias inferiores (drenando os segmentos VI e VII diretamente na cava). Se calibrosas (>5mm), devem ser reimplantadas para garantir a função do enxerto.
5. A Via Biliar e sua Vascularização: O “Tendão de Aquiles”
A anatomia biliar é a mais variável e propensa a complicações.
-
Irrigação Biliar: Diferente do parênquima, os ductos biliares extra-hepáticos são irrigados exclusivamente por um plexo arterial peribiliar (artérias das 3h e 9h), derivado principalmente da artéria hepática direita e retroduodenal.
-
Pérola Cirúrgica: Durante a captação do fígado, a dissecção excessiva do ducto biliar pode desvascularizá-lo, levando a estenoses isquêmicas tardias. Preservar a bainha peribiliar e o tecido hilar é mandatório.
6. A Vesícula Biliar e o Triângulo de Calot
Embora a colecistectomia seja um procedimento comum, ela exige respeito absoluto à anatomia. O Triângulo de Calot (delimitado pelo ducto cístico, ducto hepático comum e borda hepática) é a zona de segurança. A artéria cística deve ser identificada aqui. Variações, como um ducto cístico curto ou inserção no ducto direito, ou uma artéria hepática direita tortuosa (“Hump”) invadindo o triângulo, são armadilhas para o cirurgião desatento.
Conclusão
A cirurgia hepática evoluiu de ressecções em cunha não anatômicas para segmentectomias precisas e transplantes de doadores vivos. Essa evolução foi sustentada por um aprofundamento do conhecimento anatômico. Para o cirurgião em formação, o estudo exaustivo destas estruturas, suas variações e suas relações vasculares não é apenas acadêmico — é a base ética para oferecer segurança e cura aos pacientes portadores de doenças hepatobiliares.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #AnatomiaHepatica #CirurgiaDoFigado #TransplanteHepatico #Couinaud #CirurgiaHPB
Como funciona o GRAMPEADOR INTESTINAL ?
A Busca pela Segurança e Eficiência na Cirurgia Moderna
Introdução O objetivo primordial de qualquer cirurgião, ao iniciar uma intervenção, é garantir que o procedimento seja seguro e eficiente. A “regra de ouro” da cirurgia moderna permanece clara: o ato operatório deve ser o mais breve possível, gerando o menor trauma tecidual e restaurando a função do órgão. O resultado esperado é sempre a minimização das intercorrências no pós-operatório. Embora a cirurgia atual atinja esses objetivos de forma bastante satisfatória, as complicações relacionadas às suturas e à cicatrização ainda são desafios presentes na rotina hospitalar.
A Evolução Histórica e os Desafios da Cicatrização A confiabilidade das suturas gastrointestinais, por exemplo, é uma conquista relativamente recente. Foi apenas no final do século XIX que a compreensão dos princípios básicos da cicatrização tecidual permitiu avanços significativos nesta área. Sabemos hoje que o sucesso do reparo tecidual não depende apenas da técnica empregada, mas é uma equação complexa que envolve o paciente e a área operada. Diversos fatores podem retardar ou prejudicar drasticamente a cicatrização, entre eles:
-
Isquemia (falta de suprimento sanguíneo);
-
Edema (inchaço excessivo);
-
Infecção local ou sistêmica;
-
Desnutrição do paciente.
O Fator Humano e o Surgimento da Tecnologia Existe uma variável crítica na cirurgia: a habilidade manual. Naturalmente, há uma variação na destreza e na técnica entre diferentes cirurgiões. Foi justamente essa disparidade que motivou o desenvolvimento de novos dispositivos cirúrgicos. O objetivo da inovação tecnológica na cirurgia é superar as diferenças individuais, funcionando como um equalizador. Ao utilizar dispositivos que padronizam etapas críticas (como as suturas mecânicas), permite-se que técnicas complexas sejam executadas adequadamente, independente de quem opera.
Conclusão Para que a medicina avance, uma técnica não pode depender apenas do talento de poucos. Ela deve ser reproduzível de forma confiável pelo maior número possível de cirurgiões. Somente através dessa padronização e do auxílio tecnológico é que os resultados cirúrgicos podem ser amplamente adotados, reconhecidos como eficazes e, acima de tudo, seguros para o paciente.









