Colecistectomia Segura: Preditores de Dificuldade Técnica
Introdução
A colecistectomia laparoscópica é amplamente reconhecida por suas vantagens sobre a colecistectomia aberta, incluindo redução da dor pós-operatória, estadias hospitalares mais curtas e tempos de recuperação mais rápidos. No entanto, a transição para técnicas laparoscópicas introduziu um maior risco de lesões do ducto biliar, com incidências relatadas sendo duas a três vezes maiores do que em procedimentos abertos. Dadas as graves consequências associadas à LDB, identificar preditores de colecistectomia difícil e implementar estratégias de manejo apropriadas são cruciais para melhorar os resultados dos pacientes.
Preditores Pré-operatórios de Colecistectomia Difícil
Gênero: O gênero masculino é um preditor significativo de colecistectomia difícil. Análises retrospectivas indicam taxas mais altas de aderências, desafios anatômicos, taxas de conversão e inflamação aguda ou crônica em pacientes do sexo masculino. Fatores contribuintes possíveis incluem a consulta médica tardia e a colecistite recorrente, levando a um aumento da fibrose. Além disso, diferenças fisiológicas, como maior massa muscular e menor circunferência torácica, podem complicar o procedimento.
Idade: A idade avançada (acima de 65-70 anos) está associada a taxas de conversão mais altas devido a históricos mais longos de doença calculosa biliar e frequentes ataques de colecistite. Apesar desses desafios, a colecistectomia laparoscópica em pacientes idosos geralmente resulta em menos complicações em comparação com procedimentos abertos.
Obesidade: O IMC mais alto introduz várias dificuldades técnicas, como obter acesso para a criação do pneumoperitônio, retração do fundo da vesícula biliar e dissecação do triângulo de Calot em um ambiente com excesso de gordura. Pacientes obesos também necessitam de cuidados anestésicos e de enfermagem especializados. Embora se notem tempos operatórios aumentados e taxas de conversão mais altas, a colecistectomia laparoscópica ainda oferece menor morbidade pós-operatória em comparação com a colecistectomia aberta.
Histórico de Colecistite Aguda, Colangite, Pancreatite e Icterícia: Essas condições levam a cicatrizes e fibrose, complicando a delineação anatômica e a dissecação. A colecistite recorrente pode encurtar o ducto cístico, fazendo com que a vesícula biliar pareça drenar diretamente no ducto biliar comum (DBC). A pancreatite aguda, embora não afete diretamente a vesícula biliar, pode causar aderências que dificultam a exposição operatória. A colangiopancreatografia retrógrada endoscópica (CPRE) prévia com stent também pode contribuir para dificuldades intraoperatórias.
Cirrose: A cirrose hepática apresenta um risco significativo de hemorragia devido a colaterais dilatados no triângulo de Calot, coagulopatia e trombocitopenia. A menor complacência do fígado fibroso complica ainda mais a retração da vesícula biliar e a exposição do triângulo de Calot. O uso de tesouras ultrassônicas e a manutenção de uma hemostasia meticulosa são essenciais nesses casos.
Laparotomia Anterior: Cirurgias abdominais anteriores, especialmente múltiplos procedimentos abdominais superiores, frequentemente resultam em aderências, complicando o acesso ao local operatório. O planejamento pré-operatório para o acesso peritoneal e o aconselhamento do paciente sobre a possibilidade de conversão são imperativos.
Fatores Intraoperatórios que Predizem Dificuldade
Aderências densas, vesícula biliar tensa (mucocele/empiema), colecistite aguda, anatomia pouco clara, triângulo de Calot congelado, síndrome de Mirizzi, fístula colecistoentérica, vesícula biliar intra-hepática e cálculos biliares grandes complicam significativamente a colecistectomia laparoscópica. O nível de dificuldade varia com a experiência do cirurgião. Aderências no triângulo de Calot, em particular, apresentam o maior risco de conversão para cirurgia aberta.
Estratégias de Manejo
Acesso Difícil: Locais alternativos para a criação do pneumoperitônio, como o ponto de Palmer, podem ser utilizados em pacientes com cirurgias abdominais superiores anteriores ou obesidade. As aderências devem ser abordadas com dissecação afiada ou métodos rombos, dependendo de sua densidade.
Estratégias de Resgate: Em casos em que a dissecção segura não é viável, estratégias como colecistectomia subtotal, colecistectomia do fundo para a tríade, colecistostomia tubular ou conversão para cirurgia aberta são recomendadas. A colangiografia intraoperatória ou ultrassonografia laparoscópica podem auxiliar na compreensão da anatomia biliar.
Síndrome de Mirizzi e Fístula Colecisto-colédoco: O manejo depende do tipo de síndrome de Mirizzi. A colecistectomia total ou subtotal é tipicamente suficiente para o Tipo I, enquanto casos mais complexos (Tipos II-IV) podem necessitar de coledocoplastia ou anastomose bilioentérica.
Conclusão
A transição para a colecistectomia laparoscópica, embora benéfica, introduz maiores riscos de complicações, como a lesão do ducto biliar. Identificar preditores pré-operatórios e intraoperatórios de colecistectomia difícil é essencial para planejar e executar intervenções cirúrgicas seguras. Os cirurgiões devem estar preparados para implementar várias estratégias de manejo para minimizar os riscos e garantir a segurança do paciente. Como Lahey afirmou apropriadamente, “O cirurgião que vê diante de si apenas a anatomia normal enfrentará mais dificuldades.”

Colecistectomia Segura: Plano R4U
O Imperativo do Sulco de Rouvière e a Visão Crítica de Segurança
Autor: Prof. Dr. Ozimo Gama
Afiliação: Membro Titular do Colégio Brasileiro de Cirurgiões
Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
Introdução
A colecistectomia laparoscópica (CL) permanece como um dos procedimentos cirúrgicos mais executados globalmente. No entanto, sua ubiquidade não mitiga riscos inerentes; a variação anatômica dos ductos biliares, combinada à identificação visual incorreta, continua a precipitar complicações graves, notadamente as lesões iatrogênicas das vias biliares[1]. Neste cenário, a segurança do paciente transcende a destreza manual, residindo na identificação rigorosa de marcos anatômicos imutáveis. Entre estes, o sulco de Rouvière (SR) emerge não apenas como detalhe morfológico, mas como farol essencial para a orientação cirúrgica segura[2].
A Nomenclatura e a Realidade Anatômica
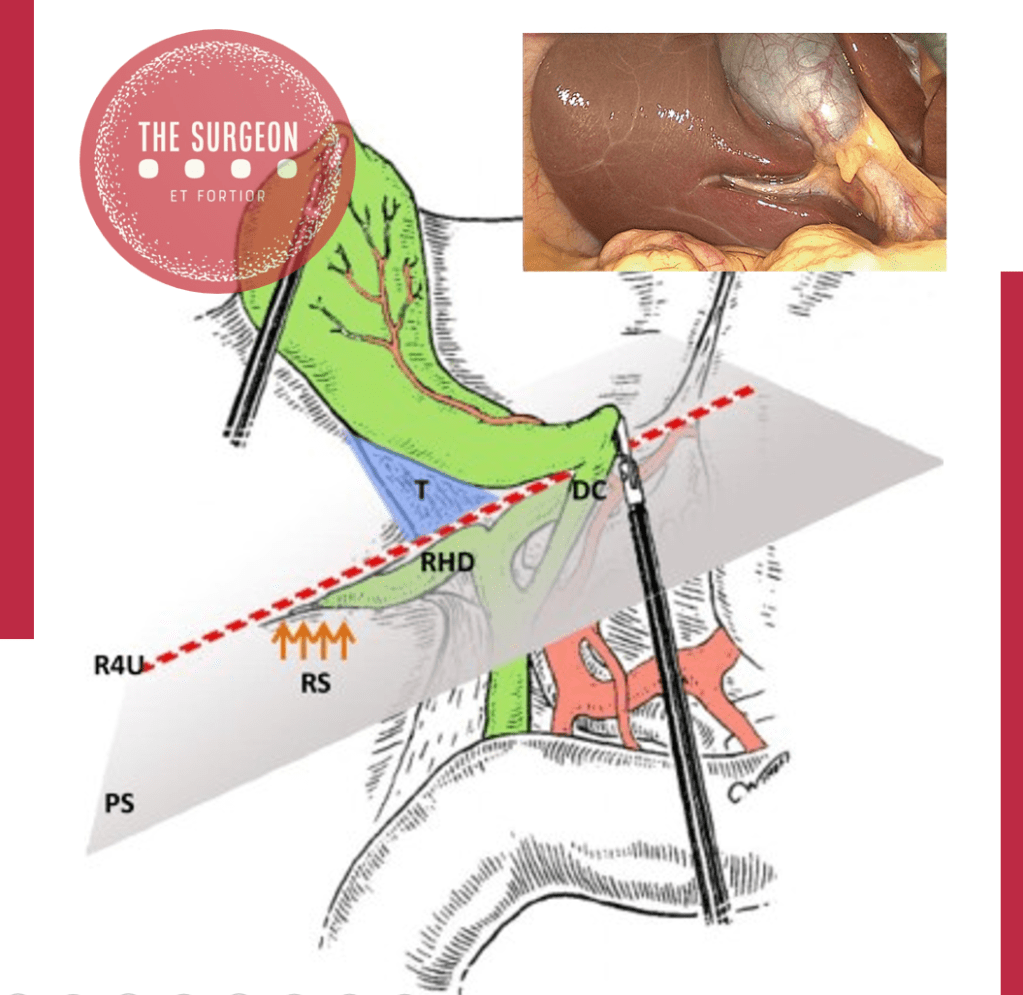
A precisão cirúrgica exige precisão anatômica. Na literatura, o SR é referenciado sob diversas nomenclaturas, incluindo “incisura dextra de Gans”[7] e, originalmente por Henri Rouvière, como “le sillon du processus caudé”[5]. Embora textos clássicos apresentem dados inconsistentes, estudos contemporâneos demonstram a presença do SR em até 80% dos fígados[3,6]. Tal prevalência torna o reconhecimento deste marco uma competência obrigatória. A relevância topográfica do SR é crítica, estabelecendo um divisor de águas anatômico: o ducto e a artéria cística localizam-se anterossuperiormente ao sulco, enquanto o ducto biliar comum (CBD) reside abaixo do seu nível. Evidências sugerem que dissecções iniciadas ventralmente ao SR reduzem significativamente a incidência de lesões ao CBD[2]. Ademais, o marco é instrumental para a execução segura de ressecções hepáticas segmentares[4].
A Integração com a Visão Crítica de Segurança (CVS)
A técnica da Critical View of Safety (CVS), preconizada por Strasberg, é o padrão ouro para minimizar riscos de lesão biliar[1]. Contudo, a aplicação da CVS deve ser ancorada em marcos confiáveis. Variações da árvore biliar extra-hepática afetam até um terço dos pacientes[3], mas o SR tende a manter-se no mesmo plano do ducto hepático comum e do CBD, facilitando a orientação tridimensional. A identificação do SR deve ser o passo preliminar que habilita a construção segura da CVS, mormente em casos de anatomia distorcida por inflamação.
Estratégias de Contingência: A Linha R4U
Em casos onde o SR está obscurecido por fibrose ou aderências, a segurança não pode ser comprometida. A linha R4U — estendendo-se da fissura umbilical para a direita do hilo — apresenta-se como alternativa viável para delimitar um plano seguro de dissecção[2]. Todavia, a utilização eficaz da linha R4U exige profundo conhecimento da anatomia hepática e treinamento contínuo em técnicas de segurança.
Conclusão
A prevenção de lesões na CL exige uma sistematização que transcende a técnica básica. A identificação rotineira do Sulco de Rouvière e a adesão estrita à CVS são imperativos éticos e técnicos. Ao integrar o conhecimento anatômico clássico com estratégias modernas, elevamos o padrão de cuidado. Como nos lembra a sabedoria cirúrgica secular:
“O cirurgião que ignora a anatomia esculpe o corpo humano como um cego esculpe a madeira.” — Guy de Chauliac (1300–1368), Chirurgia Magna.
Referências Bibliográficas
Referências
- Strasberg, S. M., et al. “The Critical View of Safety in Laparoscopic Cholecystectomy.”
- Hugh, T. B. “Anatomical Landmarks for Safe Laparoscopic Cholecystectomy.”
- Zubair, M., et al. “Anatomical Variations in the Extrahepatic Biliary Tree.”
- Couinaud, C. “Segmental Anatomy of the Liver.”
- Rouvière, H. “Le sillon du processus caudé.”
- Reynaud, C., Coucoravas, G., Giuly, J., et al. “Incisura Dextra de Gans.”
- Hugh, T. B. “Minimal Common Bile Duct Injury During Laparoscopic Cholecystectomy.”
- Gans, H. “Incisura Dextra in Classic Anatomical Literature.”
Variações Anatômicas da Árvore Biliar Extra-Hepática no Contexto da Colecistectomia Laparoscópica
Introdução A compreensão das variações anatômicas dos ductos biliares extra-hepáticos é essencial para a realização segura da colecistectomia laparoscópica. A terminologia frequentemente utilizada para descrever essas variações inclui termos como “acessório”, “anômalo” e “aberrante”. Entretanto, essas variações são naturais e suficientemente frequentes para serem antecipadas pelo cirurgião atento. A preferência é pelo termo “duto variante”.
Marcos Anatômicos Gerais para a Orientação
Durante a colecistectomia laparoscópica, é crucial reconhecer marcos anatômicos adjacentes para evitar lesões. O ligamento falciforme situa-se entre os segmentos hepáticos 3 e 4, e o ducto hepático comum (DHC) está próximo ao plano mediano do fígado entre os segmentos 4 e 5. O sulco de Rouvière é uma fissura que contém porções do pedículo portal direito e demarca o plano ventral-dorsal do ducto biliar comum (DBC), auxiliando na orientação durante a dissecção.

Anatomia dos Ductos Hepáticos Direitos
Na configuração mais comum, o ducto hepático seccional anterior direito (segmentos 5 e 8) e o ducto hepático seccional posterior direito (segmentos 6 e 7) unem-se para formar o ducto hepático direito (DHD), que se junta ao ducto hepático esquerdo para formar o DHC. Essa anatomia ocorre em 57-72% dos indivíduos. Em 15-30% dos casos, os ductos seccionais direito anterior e posterior não se unem, cada um tendo uma junção separada com o DHC ou o ducto hepático esquerdo, aumentando o risco de lesão durante a cirurgia.

Ductos Subvesicais
Os ductos subvesicais, localizados superficialmente no leito da vesícula biliar, são a fonte mais comum de vazamento biliar pós-operatório. Observados em cerca de um terço dos espécimes humanos, esses ductos, geralmente originários do segmento 5, drenam para o ducto hepático direito, o DHD ou o DHC. A dissecção deve ser mantida fora do fígado sempre que possível para evitar lesões.
Anatomia do Ducto Cístico
O ducto cístico geralmente se junta ao DHC, com a localização da junção variando do hilo hepático à área pré-ampular. Configurações paralelas e espirais do ducto cístico são comuns e representam fatores de risco significativos para lesões durante a colecistectomia. Fusão inflamatória e contração do ducto cístico são situações de alto risco.
A variabilidade anatômica dos ductos biliares extra-hepáticos requer uma abordagem cuidadosa durante a colecistectomia laparoscópica para evitar lesões. O conhecimento detalhado das possíveis variações e a identificação precisa dos marcos anatômicos são fundamentais para o sucesso cirúrgico. As variações anatômicas dos ductos biliares são frequentes e devem ser esperadas pelos cirurgiões. A terminologia adequada e o reconhecimento dessas variações são cruciais para prevenir lesões durante a colecistectomia laparoscópica. Como afirmou Lahey: “A variação anatômica é a regra, não a exceção.”
Referências
- Michels, NA. “Every duct drains a definite segmental area of the liver.”
- Strasberg, SM. “Anatomic and historical basis of variations in bile ducts.”
- Bismuth, H. “Variations in the anatomy of the extrahepatic bile ducts.”
Diferenciação Morfológica do Ducto Cístico e do Ducto Colédoco no Contexto da Colecistectomia Laparoscópica
Introdução
Na cirurgia laparoscópica, a precisão na identificação e dissecação das estruturas anatômicas é fundamental para a prevenção de lesões iatrogênicas da via biliar. O conhecimento detalhado das variações anatômicas do ducto cístico e do ducto colédoco é essencial para evitar complicações graves. Conforme disse Lahey em 1954: “Cholecystectomy is a dangerous operation unless one realizes that variations are very common.” Assim, a terminologia anatômica deve ser correta, consistente e padronizada para evitar mal-entendidos.
Anatomia Normal
O ducto cístico conecta a vesícula biliar ao ducto hepático comum, formando o ducto colédoco. Este último é a principal via de passagem da bile do fígado para o duodeno. A correta identificação dessas estruturas é crucial durante a colecistectomia para evitar lesões.
Dimensões e Diâmetro
O ducto cístico geralmente tem um comprimento de 2-4 cm e um diâmetro de 1-5 mm. Já o ducto colédoco mede aproximadamente 6-8 cm de comprimento e tem um diâmetro que varia de 4-10 mm.
Trajeto e Topografia
O ducto cístico apresenta um trajeto sinuoso, que pode variar significativamente entre os pacientes. Ele se une ao ducto hepático comum para formar o ducto colédoco, que desce posteriormente ao duodeno até a ampola de Vater. A topografia dessas estruturas é fundamental para a correta dissecação durante a cirurgia.
Vascularização
O ducto cístico é irrigado principalmente pela artéria cística, um ramo da artéria hepática direita. O ducto colédoco, por sua vez, recebe irrigação de pequenos ramos axiais das artérias hepática direita, gástrica direita e pancreatoduodenal onde 60% é inferior e 40% é superior.
Epônimos e Terminologia Correta
Historicamente, a anatomia hepato-biliar tem sido confundida por diferentes nomenclaturas e epônimos imprecisos. O termo “triângulo de Calot”, descrito por Jean-Francois Calot em 1890, refere-se à área limitada pelo ducto cístico, o ducto hepático comum e a artéria cística. No entanto, o triângulo de Calot não é uma definição anatomicamente precisa, sendo preferível o termo “triângulo hepatocístico”, que é delimitado pelo ducto cístico e a vesícula biliar, o ducto hepático comum e a borda do fígado. Esta é uma área crítica onde ductos hepáticos direitos e a artéria hepática direita podem ser encontrados, sendo comumente obscurecida por inflamação aguda ou crônica.
Principais Variações Anatômicas e Suas Incidências
As variações anatômicas são comuns e devem ser antecipadas. Cerca de 20% dos ductos císticos seguem um trajeto paralelo ao ducto hepático comum, compartilhando uma bainha comum de tecido conjuntivo. Outros 5-10% têm um curso espiralado, cruzando o ducto hepático comum de forma ventral ou dorsal. As variações no trajeto e na união dos ductos são fatores de risco significativos para lesões durante a cirurgia.
Idiotopia em Relação ao Duodeno e Holotipia em Relação à Tríade Portal
O ducto colédoco passa diretamente atrás do duodeno, uma característica que o diferencia do ducto cístico durante a dissecção. Em relação à tríade portal, o ducto cístico e o ducto colédoco são componentes críticos, juntamente com a artéria hepática e a veia porta, sendo importantes marcos anatômicos para a orientação cirúrgica.
Sintopia Entre Eles
A relação espacial entre o ducto cístico e o ducto colédoco é complexa e varia com a inflamação e a dissecção cirúrgica. Durante a colecistectomia, a visualização clara do “triângulo hepatocístico” é fundamental para identificar corretamente o ducto cístico e evitar danos ao ducto colédoco.
Conclusão
O entendimento detalhado das variações anatômicas do ducto cístico e do ducto colédoco é crucial para a realização segura da colecistectomia laparoscópica. A aplicação do conceito da “vista crítica de segurança” ajuda a minimizar os riscos de lesões. Portanto, a terminologia precisa e o conhecimento das variações anatômicas são fundamentais para a prática cirúrgica segura.
Colecistectomia Laparoscópica Segura
Histórico
A primeira colecistectomia laparoscópica foi realizada por Mouret em Lyon, em 1988, com o primeiro relato escrito por Dubois em 1989. Reddick popularizou o procedimento nos Estados Unidos em 1990.
Indicações e Contraindicações
Indicações:
- Mesmas da colecistectomia aberta.
- O cirurgião deve estar adequadamente treinado para realizar o procedimento.
- Manifestações de cálculos biliares sintomáticos: cólica biliar, histórico de icterícia, colecistite crônica e aguda.
- Pancreatite por cálculos biliares.
- Colecistite acalculosa.
- Pólipos grandes na vesícula biliar.
Contraindicações:
- Não há contraindicações absolutas.
- Contraindicações relativas incluem cirrose, hipertensão portal, diátese hemorrágica e gravidez, podendo requerer modificações técnicas.
Investigação Pré-operatória e Preparação
- Testes de Função Hepática: Essenciais para avaliar a função hepática.
- Ultrassonografia: Tipicamente realizada para avaliar a condição da vesícula biliar.
- Estudos Nucleares: Utilizados para avaliar a função da vesícula biliar na colecistite acalculosa.
- Tomografia Computadorizada (TC): Necessária se houver suspeita de câncer na vesícula biliar ou grandes pólipos.
- CPRE (Colangiopancreatografia Retrógrada Endoscópica): Não realizada rotineiramente no pré-operatório.
- Antibióticos Profiláticos: Administrados na indução.
- Medidas Antitrombóticas: Devem ser tomadas medidas preventivas adequadas.
Variações Anatômicas

- As principais variações anatômicas envolvem o ducto biliar comum e a artéria hepática direita.
- Variações do Ducto Biliar Comum: Um ducto biliar comum muito pequeno pode ser confundido com o ducto cístico e excisado.
- Variações de Junção dos Ductos Hepáticos: Junções baixas dos ductos hepáticos ou aberturas diretas da bolsa de Hartmann podem levar à identificação e divisão incorreta dos ductos.
- Ausência de Ducto Cístico: Em alguns casos, a bolsa de Hartmann se abre diretamente no ducto hepático direito ou no ducto comum, complicando o procedimento.
Complicações Intraoperatórias
- Hemorragia: Geralmente ocorre de uma artéria cística curta ou da artéria hepática direita. A hemorragia da veia porta é rara, mas torrencial, exigindo conversão imediata para cirurgia aberta.
- Falha de Progressão: Se o procedimento não está progredindo, deve ser convertido para colecistectomia aberta.
- Lesão do Ducto Biliar: Técnicas adequadas e conversão oportuna para cirurgia aberta minimizam o risco. Consultar imediatamente um especialista em hepatobiliar se ocorrer uma lesão.
Complicações Pós-operatórias
- Fugas Biliares: A maioria é de baixo volume e resolve-se espontaneamente. Fugas de alto volume requerem CPRE para avaliação e manejo.
- Coleção Subfrênica: Pode necessitar de drenagem percutânea.
- Pneumonia: Tratada com fisioterapia e antibióticos.
- Icterícia: Indica obstrução ou lesão maior do ducto, necessitando de CPRE ou encaminhamento a um especialista.
Dicas do Cirurgião Sênior
- Hipertensão Portal e Cirrose: Considerar colecistectomia parcial para evitar hemorragias com risco de vida.
- Colecistite Aguda Severa: Descomprimir a vesícula biliar aspirando seu conteúdo para torná-la mais manejável.
- Cálculo Impactado na Bolsa de Hartmann: Empurrar o cálculo de volta para a vesícula biliar para permitir a manipulação segura do triângulo de Calot.
Técnicas Específicas
Ilustração da Técnica:
- Posicionamento dos Instrumentos: A vesícula biliar é levantada em direção cefálica com um primeiro fórceps inserido pelo portal na linha médio-clavicular, logo abaixo do rebordo costal, para segurar o pescoço da vesícula. Um segundo fórceps é inserido pelo portal na linha axilar anterior para empurrar o cólon e o duodeno para baixo, liberando o campo de visão.
- Incisão na Serosa: A incisão na serosa sobre a junção do ligamento hepatoduodenal é estendida paralelamente a uma linha a 5 mm da borda do fígado, melhorando a visualização do triângulo de Calot.
- Manobras de Tração: O pescoço da vesícula é retraído para baixo e a serosa é retraída para cima com o segundo fórceps, criando contra-tração e ampliando a visualização do triângulo de Calot. Isso também evita lesões térmicas desnecessárias na superfície do fígado.
- Dissecção e Identificação: Tecidos adiposos e bandas fibrosas são removidos até que a relação anatômica entre o ducto cístico e a artéria cística seja clara. A eletrocauterização é usada com cautela para evitar lesões térmicas no ducto biliar comum.
- Colangiografia Intraoperatória: Protagonistas da colangiografia intraoperatória sugerem que essa investigação pode minimizar o risco de lesão do trato biliar extra-hepático, fornecendo um registro anatômico preciso. No entanto, a dissecção cuidadosa e a identificação dos ductos são essenciais.
Complicações durante a Colecistectomia Laparoscópica:
- Cálculos Múltiplos e Aderências: Podem dificultar o procedimento e aumentar o risco de complicações, como lesões térmicas em órgãos adjacentes.
- Hemorragia e Fugas Biliares: A hemorragia deve ser controlada com coagulação ou clipes, e as fugas biliares são geralmente geridas com endoloop após aspiração da bile.
- Extração de Cálculos: Cálculos que escapam devem ser removidos com fórceps para prevenir abscessos intra-abdominais.
Conclusão
A colecistectomia laparoscópica é um procedimento padrão com indicações específicas. A preparação pré-operatória, conhecimento das variações anatômicas e técnicas cirúrgicas meticulosas são cruciais para o sucesso. O manejo eficaz das complicações intra e pós-operatórias garante a segurança e a recuperação do paciente.

Lesão da Via Biliar Durante a Colecistectomia
A lesão da via biliar é uma complicação significativa tanto na colecistectomia aberta quanto na laparoscópica. Na colecistectomia aberta, o risco é de aproximadamente 1 em 1000 casos. No entanto, na colecistectomia laparoscópica as taxas de lesão da via biliar comum variam entre 0,2% e 3%.
Popularidade da Colecistectomia Laparoscópica
Apesar do maior risco de lesão na colecistectomia laparoscópica, sua popularidade continua a crescer entre cirurgiões e o público em geral. Este aumento se deve aos benefícios percebidos, como menor dor pós-operatória, cicatrizes menores e recuperação mais rápida. No entanto, essas vantagens podem ser rapidamente anuladas por uma única lesão da via biliar.
Fatores de Risco e Procedimentos
Estudos, como o de Easter e Moossa, mostraram que a dissecção a laser está associada a um maior risco de lesão em comparação com o uso de eletrocautério. As lesões ocorrem frequentemente devido à dificuldade de visualização clara do campo operatório, exacerbada por inflamação, cicatrizes ou sangramento na região do triângulo de Calot.
Diferenças na Tração Durante a Cirurgia
Durante a colecistectomia aberta, as forças opostas aplicadas ao fígado e ao duodeno tendem a alinhar o ducto biliar comum de maneira a minimizar sua angulação. Em contraste, na colecistectomia laparoscópica, a tração lateral e cefálica na vesícula biliar pode fazer com que o ducto cístico e o ducto biliar distal fiquem alinhados no mesmo plano, aumentando o risco de confusão anatômica e lesão inadvertida do ducto hepático comum.
Estratégias de Prevenção
Para minimizar o risco de lesões, recomenda-se uma tração lateral do fundo da vesícula biliar e uma dissecção cuidadosa no nível do infundíbulo antes da aplicação de clipes ou divisão das estruturas no triângulo de Calot. A colangiografia intraoperatória é fundamental sempre que houver dúvida sobre a anatomia, pois pode ajudar a identificar anomalias anatômicas ou lesões antes que ocorram complicações graves.
Importância do Reconhecimento Precoce
Os sintomas pós-operatórios de anorexia, íleo, náuseas ou vômitos que não melhoram conforme esperado após uma colecistectomia laparoscópica podem indicar uma lesão ductal. A detecção precoce dessas lesões e o reparo imediato por um cirurgião experiente são essenciais para um bom prognóstico a longo prazo. Lesões não detectadas durante o procedimento inicial frequentemente resultam em complicações mais graves, como peritonite biliar e estenoses anastomóticas.
Considerações Finais
Embora a colecistectomia laparoscópica ofereça vantagens significativas, é crucial que os cirurgiões estejam cientes de seus riscos e limitações. A conscientização e o reconhecimento dos fatores de risco podem ajudar a alcançar o nível de segurança esperado na colecistectomia aberta, garantindo melhores resultados para os pacientes.
Colecistectomia Segura
A colecistectomia laparoscópica, amplamente utilizada para a remoção da vesícula biliar, oferece muitas vantagens em relação à técnica aberta tradicional. Entre os benefícios estão a redução da dor pós-operatória, menor tempo de internação hospitalar e recuperação mais rápida. No entanto, esses benefícios não devem compensar a maior incidência de lesões no ducto biliar comum associada ao procedimento laparoscópico em determinadas situações.
Riscos das Lesões no Ducto Biliar
Como enfatizado por Sackier, lesões no ducto biliar comum podem resultar em complicações graves, muitas vezes referidas como “aleijados biliares”. Essas lesões podem levar a estenoses recorrentes, necessitando de múltiplas cirurgias e aumentando o risco de cirrose biliar secundária e falência hepática. O ditado cirúrgico, “o único pecado capital na cirurgia das vias biliares é a lesão do ducto biliar comum”, reflete a gravidade dessas complicações. A morbidade e mortalidade associadas a essas lesões são altas: mais de 25% dos pacientes sofrem complicações em cirurgias de seguimento e a mortalidade pós-operatória imediata de estenoses benignas do ducto biliar é de 8,3%, com uma mortalidade a longo prazo de 13%. A principal causa de morte nesses pacientes é a falência hepática, resultante de sepse ou lesão no suprimento sanguíneo do fígado, ou desenvolvendo-se como cirrose biliar e hipertensão portal.
Incidência e Prevenção
Nos Estados Unidos, são realizadas aproximadamente 500.000 colecistectomias anualmente. Em colecistectomias abertas, o risco de lesão no ducto biliar comum é de cerca de 0,1%, ou seja, 500 pacientes por ano. Para a técnica laparoscópica, os dados variam, com estudos iniciais relatando incidências de 0 a 7%. Estudos mais recentes indicam riscos entre 0,2% e 0,3%, o que significa que cerca de 1.500 pacientes por ano podem sofrer lesões no ducto biliar comum, uma incidência duas a três vezes maior em comparação com a técnica aberta. Trabalhos mais recentes mostram atualmente uma equiparação nos índices de lesões das vias biliares.
Estratégias Preventivas
Para minimizar o risco de lesões, diversas estratégias foram desenvolvidas com base na literatura relevante e nas práticas do Columbia-Presbyterian Medical Center:
- Seleção Apropriada de Pacientes: A colecistectomia laparoscópica não deve ser a escolha para todos os pacientes. Fatores de risco como cicatrizes abdominais, inflamação aguda severa e obesidade grave devem ser consideradas no momento do planejamento cirúrgico.
- Dissecção Cuidadosa: Identificação meticulosa da anatomia é crucial, especialmente devido às limitações visuais bidimensionais da cirurgia laparoscópica.
- Uso do Laparoscópio de 30°: Este oferece uma visão mais ampla do ducto biliar comum, permitindo uma visualização mais segura.
- Retração Apropriada: A tração cefálica no fundo da vesícula biliar e tração posterior e lateral no infundíbulo são necessárias para evitar a distorção do ducto biliar comum.
- Dissecção do Junção Ducto Cístico-Vesícula Biliar: Diferenciar entre o ducto cístico entrando na vesícula e alargando-se no infundíbulo é vital.
- Identificação do Junção Ducto Cístico-Ducto Biliar Comum: A junção deve ser visualizada e o caminho do ducto biliar comum deve ser determinado.
- Relaxamento da Retração: Relaxar a retração no infundíbulo antes de clipar o ducto cístico garante que o ducto biliar comum não esteja sendo tracionado.
- Manutenção de um Remanescente Longo do Ducto Cístico: Evita lesões no ducto biliar comum.
- Evitar Procedimentos Potencialmente Lesivos Próximos à Porta Hepática: Dissecção afiada aumenta o risco de sangramento e lesão.
- Uso liberal de Colangiografia Intraoperatória: Dúvidas na anatomia e diagnosticar lesões imediatamente para reparo imediato (caso o cirurgião tenha experiência em cirurgia hepatobiliar) melhora significativamente os resultados.
- Baixo Limite para Conversão para Cirurgia Aberta: Converte-se para a técnica aberta diante de circunstâncias difíceis, em especial o sangramento, para garantir segurança.
- Curva de Aprendizado: A maioria das lesões no ducto biliar comum ocorre devido à inexperiência (<50 casos). Programas de treinamento adequados podem reduzir essas lesões.
Considerações Finais
Apesar da baixa incidência geral de lesões no ducto biliar comum durante a colecistectomia laparoscópica, a preocupação com o aumento de lesões em comparação com a técnica aberta é válida. As lesões causadas pela técnica laparoscópica são mais extensas e difíceis de reparar, frequentemente ocorrendo em pacientes jovens e saudáveis. As vantagens da colecistectomia laparoscópica não trazem benefícios se aumentarem a possibilidade de lesões graves. Essas medidas preventivas e estratégias adequadas podem tornar a colecistectomia laparoscópica tão segura quanto, ou até mais segura do que, a técnica aberta.
Mechanisms of Bile Duct Injury
Mechanism of Bile Duct Injury: Understanding the Risks in Laparoscopic Cholecystectomy
Introduction
Laparoscopic cholecystectomy, the “gold standard” for treating symptomatic gallbladder disease, has transformed surgical practice since its introduction in the early 1990s. Despite its widespread adoption and the improved safety profile over time, the procedure remains fraught with risks, particularly bile duct injuries (BDIs). The incidence of BDIs during laparoscopic cholecystectomy has declined from its peak, but this complication still represents a significant challenge in digestive surgery, leading to substantial morbidity, mortality, and legal consequences. In Brazil, where an estimated 300,000 cholecystectomies are performed annually, BDIs continue to be a significant concern. This article delves into the mechanisms of bile duct injuries during laparoscopic cholecystectomy, exploring the factors that contribute to these adverse events and their implications for surgical practice.
Development of the Theme
The advent of laparoscopic cholecystectomy marked a turning point in the management of gallbladder disease, offering patients reduced postoperative pain, shorter hospital stays, and faster recovery times. However, the initial enthusiasm for this minimally invasive approach was tempered by a notable increase in bile duct injuries. As surgeons adapted to the new technique, the incidence of BDIs spiked, with early reports indicating injury rates as high as 0.7%. Today, with increased experience and refined techniques, the incidence has decreased to approximately 0.1% to 0.2%. Despite these improvements, the risk remains significant, with estimates suggesting that one in three general surgeons will cause a bile duct injury at some point in their careers.
Iatrogenic bile duct injuries are most often the result of perceptual errors in identifying biliary anatomy during surgery. The most common injury involves a complete transection of the common bile duct, which is also the most difficult to manage. Typically, excessive cephalad retraction of the gallbladder fundus or insufficient lateral retraction on the infundibulum leads to an alignment of the cystic and common bile ducts, causing the common bile duct to be mistaken for the cystic duct. This misidentification results in clipping and transecting the common bile duct—a scenario that can lead to devastating outcomes if not promptly recognized and appropriately managed.
Inflammatory conditions, such as acute or chronic cholecystitis, further complicate the surgical landscape. Thickened and friable tissue, along with adhesions, can obscure normal anatomical landmarks, increasing the difficulty of the procedure. Aberrant biliary anatomy, such as a low-lying right hepatic duct, poses additional risks, as these anatomical variations can be easily overlooked during surgery, leading to unintended ductal injury.
Energy sources used for hemostasis, such as electrocautery, introduce another layer of complexity. Excessive or inappropriate use of these tools can damage the bile duct or its blood supply, resulting in stricture formation or bile leaks. Another common mechanism of injury occurs when a clip is inadvertently placed across the common bile duct, often in a hurried attempt to control bleeding from the hilum without a clear view of the anatomy.
In the context of laparoscopic cholecystectomy, BDIs are particularly perilous when the common bile duct is mistaken for the cystic duct. This classical injury pattern, first described by Davidoff and colleagues, typically involves clipping and dividing the common bile duct, with further proximal dissection leading to injury of the right hepatic artery and more proximal ductal structures, including the common hepatic duct and intrahepatic ducts. Poor visualization due to inadequate illumination, excessive smoke, or intraoperative bleeding exacerbates these risks, making meticulous surgical technique and optimal visualization crucial to avoiding these injuries.
Key Points
- Perceptual Errors: The primary mechanism of bile duct injury during laparoscopic cholecystectomy is the misidentification of biliary anatomy, particularly the confusion between the cystic and common bile ducts.
- Risk Factors: Inflammatory conditions, aberrant anatomy, and excessive use of energy devices significantly increase the risk of bile duct injuries.
- Incidence: Despite advancements in technique, bile duct injuries remain a significant concern, with a 0.1% to 0.2% incidence in laparoscopic cholecystectomy. In Brazil, the annual rate of cholecystectomies underscores the importance of vigilance in preventing these injuries.
- Complications: Bile duct injuries can lead to severe complications, including biliary stricture, leakage, infection, and even death. The financial and legal implications further highlight the need for preventive measures.
Conclusion
Understanding the mechanisms of bile duct injury during laparoscopic cholecystectomy is crucial for improving surgical outcomes and minimizing patient morbidity. Surgeons must remain vigilant in identifying biliary anatomy, particularly in the presence of risk factors such as inflammation and aberrant anatomy. Enhanced visualization techniques, careful dissection, and judicious use of energy devices are essential strategies to reduce the incidence of BDIs. As the field of minimally invasive surgery continues to evolve, ongoing education and training in these areas are paramount to ensuring patient safety and improving the quality of care.
In the words of Alexis Carrel, “There is no such thing as minor surgery, but there are many minor surgeons”. This sentiment is particularly relevant to the surgical treatment of biliary diseases, where the combination of skill, experience, and compassion is vital to patient outcomes.
Did you like it? Leave us a comment ✍️, share on your social networks, and | or send your question via 💬 Online Chat in our Instagram DM.
LaparoscopicCholecystectomy #BileDuctInjury #SurgicalComplications #DigestiveSurgery #SurgicalEducation
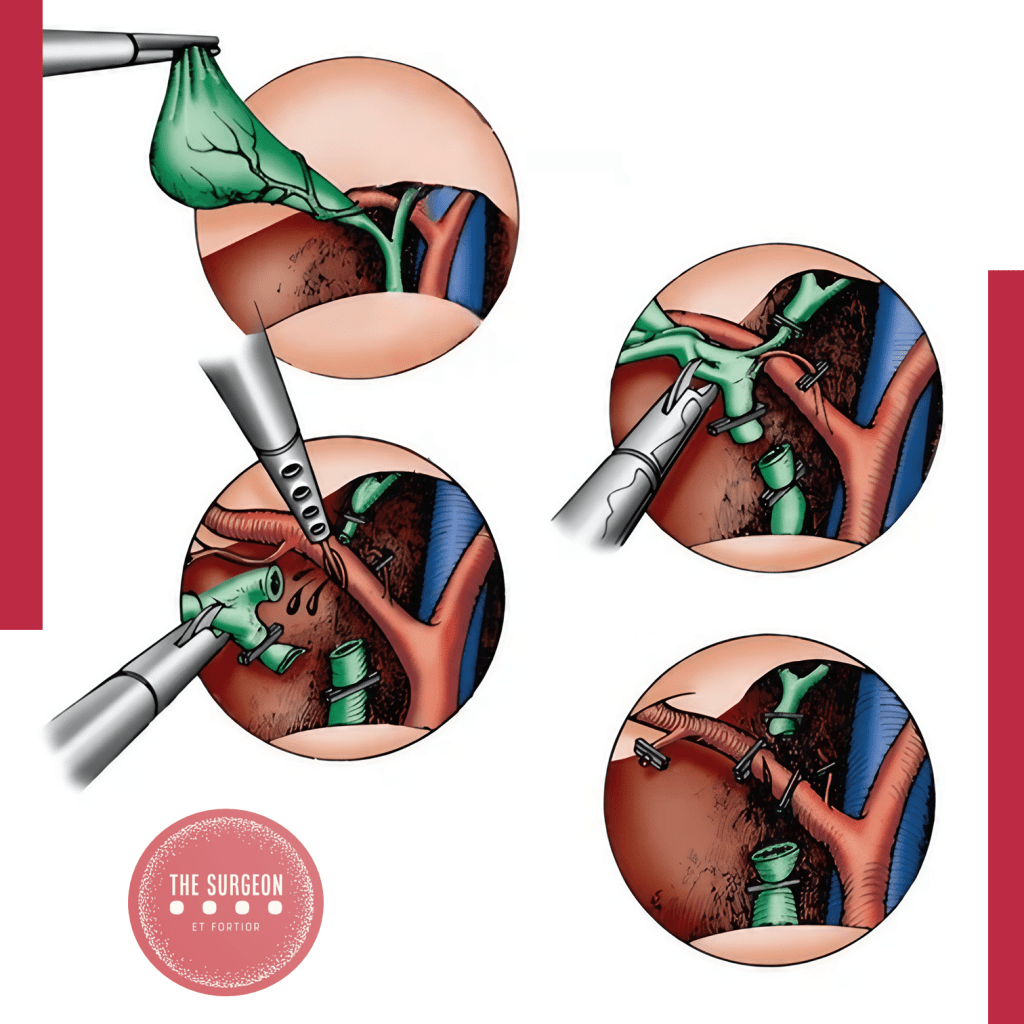
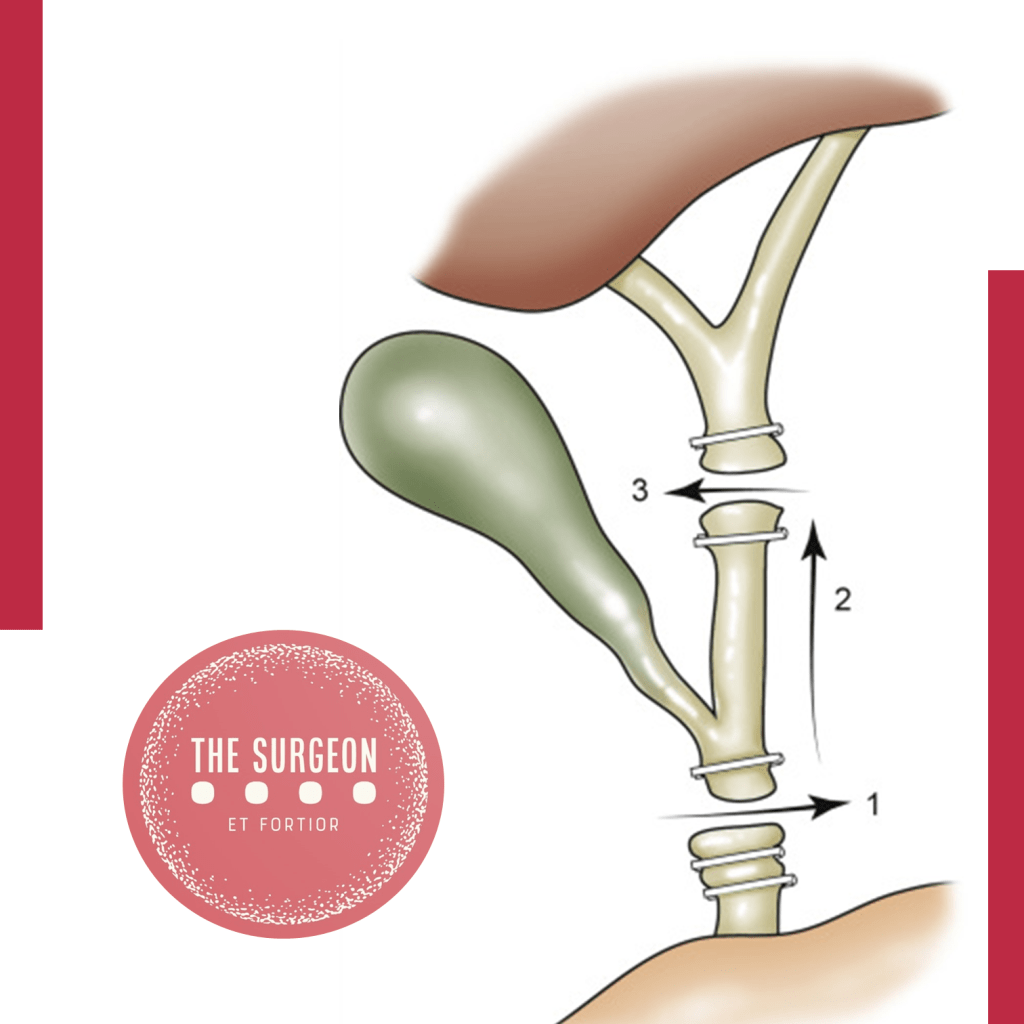
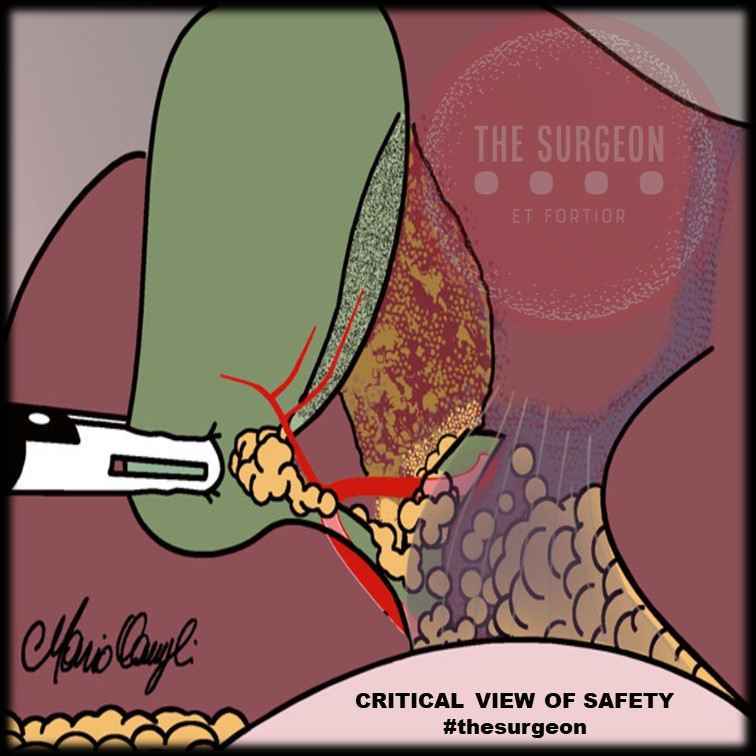
Visão Crítica de Segurança (Colecistectomia)
A colecistectomia laparoscópica (CL) é o padrão-ouro para tratamento de cálculos biliares. No entanto, o risco de lesão do ducto biliar (BDI) continua a ser preocupação significativa, uma vez que CL ainda tem taxa de BDI maior do que a via laparotômica, apesar de muitos esforços propostos para aumentar sua segurança.
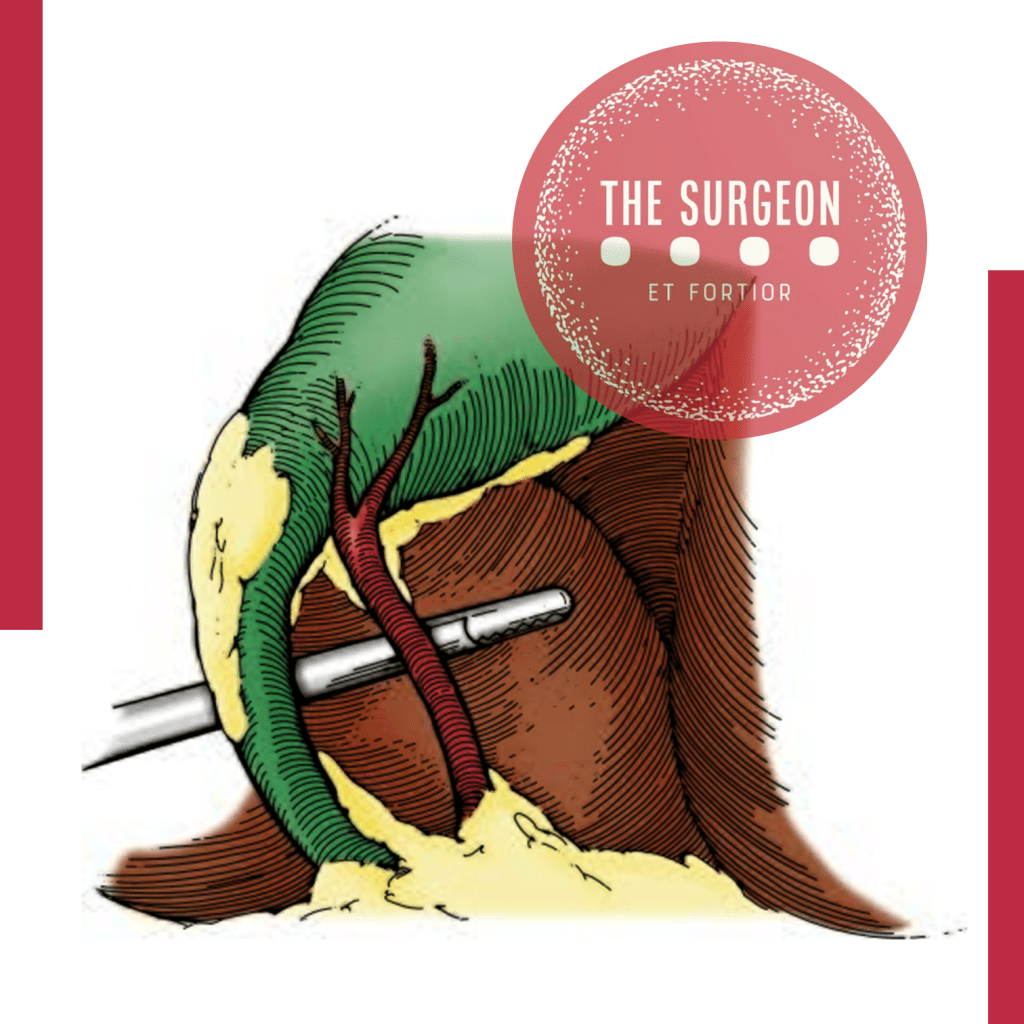
A Visão Crítica da Segurança (CVS) proposta por Strasberg é a técnica para a identificação dos elementos críticos do triângulo de Calot durante a CL. Esta técnica foi adotada em vários programas de ensino e com a proposta de reduzir o risco de BDI e o uso da adequado da CVS está associado a menores taxas de BDI. O objetivo deste #Webinar é abordar a Anatomia Cirúrgica Fundamental para a realização de uma Colecistectomia Laparoscópica.
Critical View Of Safety
“The concept of the critical view was described in 1992 but the term CVS was introduced in 1995 in an analytical review of the emerging problem of biliary injury in laparoscopic cholecystectomy. CVS was conceived not as a way to do laparoscopic cholecystectomy but as a way to avoid biliary injury. To achieve this, what was needed was a secure method of identifying the two tubular structures that are divided in a cholecystectomy, i.e., the cystic duct and the cystic artery. CVS is an adoption of a technique of secure identification in open cholecystectomy in which both cystic structures are putatively identified after which the gallbladder is taken off the cystic plate so that it is hanging free and just attached by the two cystic structures. In laparoscopic surgery complete separation of the body of the gallbladder from the cystic plate makes clipping of the cystic structures difficult so for laparoscopy the requirement was that only the lower part of the gallbladder (about one-third) had to be separated from the cystic plate. The other two requirements are that the hepatocystic triangle is cleared of fat and fibrous tissue and that there are two and only two structures attached to the gallbladder and the latter requirements were the same as in the open technique. Not until all three elements of CVS are attained may the cystic structures be clipped and divided. Intraoperatively CVS should be confirmed in a “time-out” in which the 3 elements of CVS are demonstrated. Note again that CVS is not a method of dissection but a method of target identification akin to concepts used in safe hunting procedures. Several years after the CVS was introduced there did not seem to be a lessening of biliary injuries.
Operative notes of biliary injuries were collected and studied in an attempt to determine if CVS was failing to prevent injury. We found that the method of target identification that was failing was not CVS but the infundibular technique in which the cystic duct is identified by exposing the funnel shape where the infundibulum of the gallbladder joins the cystic duct. This seemed to occur most frequently under conditions of severe acute or chronic inflammation. Inflammatory fusion and contraction may cause juxtaposition or adherence of the common hepatic duct to the side of the gallbladder. When the infundibular technique of identification is used under these conditions a compelling visual deception that the common bile duct is the cystic duct may occur. CVS is much less susceptible to this deception because more exposure is needed to achieve CVS, and either the CVS is attained, by which time the anatomic situation is clarified, or operative conditions prevent attainment of CVS and one of several important “bail-out” strategies is used thus avoiding bile duct injury.
CVS must be considered as part of an overall schema of a culture of safety in cholecystectomy. When CVS cannot be attained there are several bailout strategies such a cholecystostomy or in the case of very severe inflammation discontinuation of the procedure and referral to a tertiary center for care. The most satisfactory bailout procedure is subtotal cholecystectomy of which there are two kinds. Subtotal fenestrating cholecystectomy removes the free wall of the gallbladder and ablates the mucosa but does not close the gallbladder remnant. Subtotal reconstituting cholecystectomy closes the gallbladder making a new smaller gallbladder. Such a gallbladder remnant is undesirable since it may become the site of new gallstone formation and recurrent symptoms . Both types may be done laparoscopically.”
Strasberg SM, Hertl M, Soper NJ. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. J Am Coll Surg 1995;180:101-25.
Tratamento Cirúrgico do Abscesso Hepático Piogênico
Introdução
O abscesso hepático piogênico (AHP) é uma condição infecciosa grave caracterizada por uma coleção encapsulada de material purulento no fígado. Frequentemente, essa condição é resultante de infecções bacterianas, originárias do trato biliar ou de fontes intra-abdominais, como diverticulite. O manejo do AHP requer uma abordagem multidisciplinar, combinando diagnóstico rápido, antibioticoterapia e, em muitos casos, intervenção cirúrgica. No Brasil, a mortalidade associada a essa condição pode variar de 10% a 20%, sendo particularmente elevada em pacientes com comorbidades, como diabetes e cirrose. A presente revisão discute as abordagens cirúrgicas no tratamento do AHP, com ênfase nos critérios de intervenção, técnicas cirúrgicas e melhores práticas para o cirurgião do aparelho digestivo.
Diagnóstico e Classificação
O diagnóstico precoce do AHP é essencial para determinar a abordagem terapêutica mais adequada. Exames de imagem, como ultrassonografia (USG) e tomografia computadorizada (TC), são as ferramentas primárias para identificar a extensão da lesão e guiar a tomada de decisões. A classificação dos abscessos hepáticos baseia-se em seu tamanho e características morfológicas:
- Abscessos pequenos (menores que 3 cm) podem, muitas vezes, ser tratados com antibioticoterapia isolada.
- Abscessos maiores (geralmente >5 cm) e multiloculados exigem drenagem percutânea ou intervenção cirúrgica.
A etiologia do AHP no Brasil é predominantemente associada a bactérias como Escherichia coli e Klebsiella pneumoniae, e pacientes imunocomprometidos, como diabéticos, estão em maior risco de desenvolver complicações graves.
Abordagem Terapêutica
O tratamento do AHP é multimodal e deve ser adaptado à gravidade do caso, com o uso combinado de antibióticos, drenagem percutânea e intervenção cirúrgica, quando necessário. As diretrizes atuais propõem um algoritmo terapêutico baseado no tamanho e nas características dos abscessos.
1. Antibioticoterapia
A antibioticoterapia empírica deve ser iniciada imediatamente após o diagnóstico, visando cobertura para bactérias gram-negativas e anaeróbias. Ciprofloxacina ou cefixima combinadas com metronidazol são frequentemente utilizadas no manejo de abscessos hepáticos não complicados. A escolha do antibiótico deve ser ajustada conforme os resultados das culturas de sangue e de amostras do abscesso, garantindo uma abordagem personalizada.
2. Drenagem Percutânea
A drenagem percutânea, guiada por USG ou TC, é o tratamento de escolha para abscessos maiores que 3 cm e uniloculares (Tipo II). Esse método minimamente invasivo apresenta uma alta taxa de sucesso, próxima a 90%, sendo eficaz na maioria dos casos. No entanto, falhas podem ocorrer em abscessos multiloculados ou com conteúdo viscoso ou necrótico, situações em que a drenagem percutânea se torna inadequada, necessitando de intervenção cirúrgica.
3. Intervenção Cirúrgica
A cirurgia está indicada em abscessos multiloculados grandes (>3 cm, Tipo III), em abscessos que não respondem à drenagem percutânea ou na presença de complicações, como ruptura do abscesso. A cirurgia pode envolver drenagem minimamente invasiva ou ressecção hepática, dependendo da complexidade do abscesso e da experiência do cirurgião. Abscessos maiores que 10 cm apresentam maior risco de complicações, e nesses casos, a drenagem cirúrgica pode ser preferível. A laparotomia é recomendada em situações de peritonite ou quando o abscesso é de difícil acesso para drenagem percutânea.
4. Laparoscopia
A laparoscopia é uma alternativa minimamente invasiva à cirurgia aberta, indicada em abscessos uniloculares de tamanho moderado. Essa técnica oferece vantagens significativas, como menor tempo de internação e recuperação mais rápida, além de menor risco de complicações pós-operatórias.
Aplicação na Cirurgia Digestiva
O papel do cirurgião do aparelho digestivo é central no manejo dos abscessos hepáticos, especialmente em casos que requerem intervenção cirúrgica. A drenagem percutânea deve ser considerada a primeira linha de tratamento sempre que viável, mas o cirurgião deve estar preparado para realizar intervenções mais invasivas quando necessário. A laparoscopia tem demonstrado resultados promissores, reduzindo o tempo de internação e o risco de complicações. No Brasil, as infecções intra-abdominais complicadas são uma das principais causas de internação em emergências cirúrgicas, e o manejo adequado desses casos depende de uma sólida formação técnico-cirúrgica.
Algoritmo de Tratamento
Com base nas evidências disponíveis, um algoritmo de tratamento para o AHP pode ser delineado da seguinte forma:
- Abscessos pequenos (<3 cm, Tipo I): Tratamento com antibióticos isolados.
- Abscessos grandes uniloculares (>3 cm, Tipo II): Drenagem percutânea associada a antibioticoterapia.
- Abscessos grandes multiloculados (>3 cm, Tipo III): Intervenção cirúrgica.
Pontos-Chave
- Diagnóstico Precoce: O uso da TC com contraste é fundamental para o diagnóstico preciso do tamanho e da localização dos abscessos hepáticos, orientando a decisão terapêutica.
- Intervenção Cirúrgica: Abscessos multiloculados ou maiores que 5 cm frequentemente requerem intervenção cirúrgica, especialmente quando a drenagem percutânea falha.
- Abordagem Minimamente Invasiva: A laparoscopia oferece uma alternativa eficaz à cirurgia aberta, proporcionando uma recuperação mais rápida e com menor morbidade.
- Manejo Integral pelo Cirurgião Digestivo: O conhecimento técnico-cirúrgico é essencial para o manejo de abscessos hepáticos complexos, garantindo uma abordagem eficaz e personalizada.
Conclusão
O manejo do abscesso hepático piogênico exige uma abordagem multidisciplinar, sendo o cirurgião digestivo uma peça-chave no tratamento de casos complexos. A decisão entre drenagem percutânea e intervenção cirúrgica deve considerar múltiplos fatores, como o tamanho do abscesso, a resposta ao tratamento conservador e as condições clínicas do paciente. Como afirmou o Prof. Henri Bismuth: “Le traitement chirurgical n’est pas seulement une question de technique, mais de jugement. Le moment de l’intervention est aussi important que l’intervention elle-même.” Assim, o domínio técnico e a tomada de decisões precisas são fundamentais para o sucesso terapêutico no tratamento do AHP.
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#AbscessoHepatico #CirurgiaDigestiva #TratamentoAbscesso #DrenagemPercutanea #AparelhoDigestivo
Anatomia Cirúrgica Pancreática
A anatomia cirúrgica do pâncreas é um dos tópicos mais fascinantes e desafiadores da cirurgia do aparelho digestivo. Conhecer detalhadamente a estrutura e a topografia do pâncreas é crucial para a realização de procedimentos cirúrgicos seguros e eficazes. Neste artigo, vamos explorar os aspectos mais importantes da anatomia pancreática, abordando pontos-chave para estudantes de medicina e residentes de cirurgia do aparelho digestivo.
Estrutura Anatômica do Pâncreas
O pâncreas é uma glândula retroperitoneal situada transversalmente no abdome, na altura das vértebras L1-L2, abrangendo os principais vasos sanguíneos e a coluna vertebral. Ele é composto por cinco partes principais: cabeça, colo, corpo, cauda e processo uncinado.
- Cabeça: Localizada à direita da linha média, cercada pelo duodeno. A cabeça do pâncreas possui uma extensão inferior chamada processo uncinado, que está intimamente relacionada com a veia mesentérica superior e a artéria mesentérica superior.
- Colo: Uma parte estreita entre a cabeça e o corpo, situada anteriormente à veia porta, definida pela localização anatômica anterior à formação da veia porta, geralmente pela confluência das veias mesentérica superior e esplênica.
- Corpo: Estende-se para a esquerda, posterior ao estômago, com a superfície anterior coberta pelo peritônio, formando parte da parede posterior do saco menor.
- Cauda: Parte terminal que se estende até o hilo esplênico, confinada entre as camadas do ligamento esplenorrenal juntamente com a artéria esplênica e a origem da veia esplênica.
- Processo Uncinado: Considerado uma parte distinta do pâncreas devido à sua origem embriológica diferente, estendendo-se posteriormente aos vasos mesentéricos superiores.
Peso e Dimensões Normais
Em um adulto saudável, o pâncreas tem um peso médio de aproximadamente 80 a 120 gramas. As dimensões normais do pâncreas variam, mas geralmente medem cerca de 15 a 20 cm de comprimento, 4 a 5 cm de largura na cabeça, e 1,5 a 2,5 cm de espessura.
Vascularização do Pâncreas
A vascularização do pâncreas é complexa e vital para a compreensão cirúrgica. As principais artérias que irrigam o pâncreas são:
- Artéria Pancreatoduodenal Superior: Ramo da artéria gastroduodenal que irriga a cabeça do pâncreas.
- Artéria Pancreatoduodenal Inferior: Ramo da artéria mesentérica superior que também fornece sangue à cabeça do pâncreas.
- Ramos Pancreáticos da Artéria Esplênica: Irrigam o corpo e a cauda do pâncreas.
As veias pancreáticas drenam para a veia esplênica, veia mesentérica superior e, eventualmente, para a veia porta.
Ductos Pancreáticos
O pâncreas possui dois principais ductos: o ducto pancreático principal (ducto de Wirsung) e o ducto pancreático acessório (ducto de Santorini).
- Ducto Pancreático Principal (Ducto de Wirsung): Começa na cauda do pâncreas e percorre o corpo até a cabeça, onde geralmente se junta ao ducto biliar comum na ampola de Vater, regulada pelo esfíncter de Oddi. O diâmetro normal do ducto pancreático principal varia de 1 mm na cauda até 3 mm na cabeça.
- Ducto Pancreático Acessório (Ducto de Santorini): Corre superior e paralelo ao ducto de Wirsung, drenando parte da cabeça do pâncreas na papila duodenal menor.
O esfíncter de Oddi é uma estrutura única de fibras musculares lisas que regula o fluxo das secreções biliares e pancreáticas para o duodeno e impede o refluxo do conteúdo intestinal para o sistema ductal pancreatobiliar.
Considerações Cirúrgicas
Entender a anatomia pancreática é essencial para evitar complicações durante procedimentos cirúrgicos. Algumas das considerações importantes incluem:
- Ressecção Pancreática: Procedimentos como a pancreatoduodenectomia (procedimento de Whipple) requerem um conhecimento detalhado das relações anatômicas para garantir a remoção eficaz do tumor com a menor morbidade possível.
- Drenagem Biliar: A proximidade do pâncreas com o ducto biliar comum exige precisão ao evitar danos durante as cirurgias.
- Anastomoses Pancreáticas: A criação de anastomoses seguras entre o pâncreas e o intestino é crítica para prevenir complicações pós-operatórias, como fístulas pancreáticas.
Variações Anatômicas
As variações anatômicas do pâncreas e dos ductos pancreáticos são comuns e podem impactar significativamente a abordagem cirúrgica. Uma compreensão detalhada dessas variações é essencial para a personalização do plano cirúrgico. Por exemplo, o pâncreas anular é uma condição em que o tecido pancreático forma um anel ao redor do duodeno, podendo causar estenose duodenal.
Conclusão
A anatomia cirúrgica pancreática é um campo complexo e detalhado que exige estudo e prática contínuos. Compreender as nuances dessa anatomia é fundamental para qualquer cirurgião do aparelho digestivo. Como disse o renomado anatomista Andreas Vesalius: “A anatomia é a fundação de todas as ciências médicas.”
Gostou? Nos deixe um comentário ✍️, ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#AnatomiaPancreática #CirurgiaDigestiva #EstudantesDeMedicina #ResidentesDeCirurgia #Pancreas

Nutritional Management of Acute Pancreatitis
Acute pancreatitis is a common intra-abdominal inflammatory condition of varied aetiology. The disease is mild in the vast majority of patients and has a favourable outcome. The acute severe form of the disease on the other hand is a lethal form with a high mortality and morbidity. A number of strategies have provided clinical benefit in severe acute pancreatitis (SAP). Of these, nutritional management is by far the most effective. SAP is associated with persistent end-organ failure, commonly respiratory, circulatory and renal. Treatment is targeted to support these organs. As of now there is no definitive therapy for acute pancreatitis. Patients are managed with fluids, analgesics, antibiotics and nutritional supplements besides adequately treating local complications such as pseudocyst and walled-off pancreatic necrosis by suitable interventional methods, be it endoscopic or percutaneous. The focus here is nutritional support in the management of SAP.
Which Form of Nutrition: Parenteral or Enteral?
This depends largely on the functional integrity of the stomach and small intestine. Patients of SAP often have poor gastric emptying and paralytic ileus, which is made worse with the use of narcotics. Moreover, local complications of pancreatitis (peripancreatic fluid collections) can have a pressure effect on the stomach and/or duodenum. As a result oral feeds may not be possible in these patients. Patients on ventilator support also cannot be given oral feeds.
Enteral feeding through the nasogastric or nasojejunal tubes is often not tolerated by patients because of discomfort. In addition, these tubes often get displaced or withdrawn. Reinsertion of the tubes, under endoscopic or radiological guidance, is cumbersome in such patients. All these factors favour parenteral feeding. The distinct advantage of enteral nutrition is that it prevents mucosal atrophy and transmigration of bacteria (an important causeof sepsis in SAP). Also, enteral feeding augments intestinal motility and is cheaper than parenteral preparations. Enteral nutrition improves motility in patients with paralytic ileus. The relative merits of these forms of nutritional therapy have been evaluated in a systematic review. Eight published randomized trials including a total of 348 patients were included. Enteral feeding was given through a nasojejunal tube and parenteral nutrition through a catheter placed in a central vein. Enteral nutrition was shown to reduce mortality, multi-organ failure, systemic infection and surgical intervention in comparison with parenteral nutrition. The length of hospital stay too was shown to be reduced. In view of these, enteral nutrition appears to be a better option while managing patients of SAP and has been recommended by the American College of Gastroenterology, American Gastroenterological Association and International Association of Pancreatology.
When should enteral feeding be started?
Patients with mild acute pancreatitis can usually be started on oral feeds in 2–3 days. Those with moderately severe acute pancreatitis can be started on oral feeding only after a variable period and hence should receive enteral nutritional support. Early enteral feeding has been shown to avoid end-organ failure in a large series of patients (1200).
Enteral feeding started within 48 h of onset of illness was associated with organ failure in 21% of patients as opposed to 81% when enteral feeding was started after 48 h. This benefit of early enteral feeding has also been shown in a recent meta-analysis. However, there was no benefit in mortality with early enteral feeding. In yet another randomized controlled trial, early enteral feeding (within 24 h) was compared with on-demand enteral feeding after 72 h.
The primary endpoint of this study was major infection or death. The study did not detect any significant difference in the primary endpoint in either group (early or on-demand feeding). However, it did show that patients receiving on-demand nutrition tolerated oral feeds without using a tube.
- Nasogastric or Nasojejunal
Should the feed be administered in the stomach through a nasogastric (NG) tube or in the jejunum through a nasojejunal (NJ) tube? Gastric feeding is thought to increase pain and aggravate pancreatitis due to food-induced pancreatic stimulation. In view of this, NJ feeding is practised. However, placement of a NJ tube is cumbersome and needs a skilled endoscopist or radiologist. It causes more inconvenience to patients. A nasogastric (NG) tube is thus an alternative. A number of studies have been published comparing NG and NJ feeding. The results of these studies can be summarized as follows: There was no difference in mortality. Feeds were equally tolerated in the two groups and NG feeding is simple. NG feed was not shown to increase pain and is thus as good as NJ feeding. A meta-analysis subsequently published showed no difference in mortality, hospital stay and infection rate between the two groups. Both forms of feeding were equally well tolerated. NJ feeding thus is not advised in the management of most patients with SAP. However, it still has a place when the patient has a high risk of aspiration. Also, patients on a ventilator and those not tolerating NG feed should be fed through NJ tube. The other issue concerning enteral feeding in SAP is the composition of the feed.
- Type of Formulation
Various commercially available formulations include (1) polymeric formulations comprising complex lipids, carbohydrates and proteins and (2) elemental formulations comprising simple amino acids, carbohydrates and free fatty acids. Other formulations used are glutamine-rich feeds and feeds with probiotics, fibres, etc. Immuno-nutrition using arginine, glutamine and polyunsaturated fatty acids has been evaluated in multiple studies and compared with standard feeding. A metaanalysis showed some benefit in mortality but not for prevention of infection, end-organ failure or inflammatory response. This benefit was not seen with the use of probiotics or fibre-based feeds. A systematic review did not show any benefit of immuno-nutrition or probiotics. It also showed that polymeric formulations are as well tolerated as oligomeric ones (elemental).
ERCP Induced Perforations
In the epoch of minimally invasive management of biliary and pancreatic disorders, endoscopic retrograde cholangiopancreatography (ERCP) combined with endoscopic sphincterotomy (ES) has become a prevalent procedure all over the world. Even though ES is a safe procedure, it carries a small but significant number of serious complications which include pancreatitis, bleeding, cholangitis and perforation. As per old literature, ERCP-related perforations were reported in 0.5–2.1% of sphincterotomies with a mortality rate of 16–18%. However, the improvement in the experience and skill of the endoscopy specialists combined with advancements in technology have reduced the incidence of perforation to <0.5% over the years. Sphincterotomy (56%) and guidewire manipulation (23%) are widespread causes of perforations related to endoscopic retrograde cholangiopancreatography (ERCP). There is a dearth of evidence-based strategies with respect to the proper management of ERCP perforations. While one set of investigators promote on-demand conservative and surgical management, based on a clinical course, the others support operative repair in all cases on account of the complications associated with the delayed operative intervention.
INDICATIONS OF SURGICAL MANAGEMENT
1. Large extravasation of contrast at the time of ERCP defined as incomplete dissipation of contrast after 1 min on follow-up plain film.
2. If there is only a small amount of contrast extravasation, where there is complete dissipation after 1 min of ERCP, on follow-up plain film, then a UGI with contrast injection on fluoroscopy is performed in 2–8 h. If this shows extravasation, we recommend surgical exploration.
3. Follow-up CT scan showing a collection due to perforation in the retroperitoneum or intraperitoneum.
4. Retained hardware unable to be removed by endoscopy along with perforation.
5. Massive subcutaneous emphysema.
6. Failure of conservative management.
A delay in diagnosis or in surgery will lead to death. The reason is that there is a massive autodigestion of body tissues which is due to a constant release of enzymes, and this eventually leads to sepsis. The principle of treatment by surgery is the same as endoscopic treatment. Any case that is suspected to have ERCP-induced perforation is kept nil by mouth, and the gastric contents are decompressed by Ryles tube and intravenous antibiotics.
This is done by diverting bile, enteric and pancreatic juices away from the site of perforation. However simple drainage will also cause the juices to flow through the perforation site and body cavities before draining out of the tubes. This could be avoided by diverting the juices through well-controlled different paths which could be done by the following procedures:
1. T-tube in CBD;
2. Placement of duodenostomy tube—lateral/end duodenostomy;
3. Duodenal diverticulization;
4. Pyloric exclusion;
5. Roux-en-Y duodenojejunostomy.
The disadvantage of using Roux-en-Y duodenojejunostomy is that if the edges are inflamed, then the sutures will not hold properly. However other procedures can be used even when the edges are inflamed. Even though duodenostomy appears to be simple, a part of gastric and duodenal contents pass across the perforation site.
Duodenal diverticulization involves three things: (1) tube to divert duodenal and pancreatic juice, (2) T-tube in CBD to divert bile and (3) distal
gastrectomy and Billroth II anastomosis to provide an alternate pathway for food and gastric juice, thereby preventing these from passing through the site of perforation. Although this procedure has been proved to be successful, it is less widely used due to its complex nature. Pyloric exclusion is a simpler form in which the pylorus is closed by purse string by long-standing absorbing sutures like PDS 2.0 instead of distal gastrectomy. Similar to duodenal diverticulization, T-tube drainage of the CBD and loop gastrojejunostomy are done. The duodenal perforation is closed over a duodenostomy tube.
Whenever there is collection which is localized to the retroperitoneum, retroperitoneal surgical approach can be carried out. Advantages of this procedure are (1) it permits gravitational drainage, (2) avoids septic complication of the peritoneal cavity, (3) directs retroperitoneal necrosectomy with post-operative washes and (4) avoids complex intra-abdominal surgeries. However the disadvantage of this procedure is that it can be used only for retroperitoneal-contained perforations.
Surgical Management of Cholangiocarcinoma

Cholangiocarcinoma (CCA) is a rare but lethal cancer arising from the bile duct epithelium. As a whole, CCA accounts for approximately 3 % of all gastrointestinal cancers. It is an aggressive disease with a high mortality rate. Unfortunately, a significant proportion of patients with CCA present with either unresectable or metastatic disease. In a retrospective review of 225 patients with hilar cholangiocarcinoma, Jarnagin et al. reported that 29 % of patients had either unresectable disease were unfit for surgery. Curative resection offers the best chance for longterm survival. Whereas palliation with surgical bypass was once the preferred surgical procedure even for resectable disease, aggressive surgical resection is now the standard.
Classroom: Surgical Management of Cholangiocarcinoma
Minimally Invasive Approach to Choledocholithiasis
Introduction
The incidence of choledocholithiasis in patients undergoing cholecystectomy is estimated to be 10 %. The presence of common bile duct stones is associated with several known complications including cholangitis, gallstone pancreatitis, obstructive jaundice, and hepatic abscess. Making the diagnosis early and prompt management is crucial. Traditionally, when choledocholithiasis is identified with intraoperative cholangiography during the cholecystectomy, it has been managed surgically by open choledochotomy and place- ment of a T-tube. This open surgical approach has a morbidity rate of 10–15 %, mortality rate of <1 %, with a <6 % incidence of retained stones. Patients who fail endoscopic retrieval of CBD stones, as well as cases in which an endoscopic approach is not appropriate, should be explored surgically.
Clinical Manifestation
Acute obstruction of the bile duct by a stone causes a rapid distension of the biliary tree and activation of local pain fibers. Pain is the most common presenting symptom for choledocholithiasis and is localized to either the right upper quadrant or to the epigastrium. The obstruction will also cause bile stasis which is a risk factor for bacterial over- growth. The bacteria may originate from the duodenum or the stone itself. The combination of biliary obstruction and colo- nization of the biliary tree will lead to the development of fevers, the second most common presenting symptom of cho- ledocholithiasis. Biliary obstruction, if unrelieved, will lead to jaundice. When these three symptoms (pain, fever, and jaundice) are found simultaneously, it is known as Charcot’s triad. This triad suggests the diagnosis of acute ascending cholangitis, a potentially life-threatening condition. If not treated promptly, this can lead to hypotension and decreased metal status, both signs of severe sepsis. When combined with Charcot’s triad, this constellation of symptoms is commonly referred to as Reynolds pentad.
Laparoscopic common bile duct exploration
Laparoscopic common bile duct exploration (LCBDE) allows for single stage treatment of gallstone disease, reducing overall hospital stay, improving safety and cost-effectiveness when compared to the two-stage approach of ERCP and laparoscopic cholecystectomy. Bile duct clearance can be confirmed by direct visualization with a choledochoscope. But, before the advent of choledochoscope, bile duct clearance was uncertain, and blind instrumentation of the duct resulted in accentuated edema and inflammation. Due to advancement in instruments, optical magnification, and direct visualization, laparoscopic exploration of the CBD results in fewer traumas to the bile duct. This has led to an increasing tendency to close the duct primarily, reducing the need for placement of T-tubes. Still, laparoscopic bile duct exploration is being done in only a few centers. Apart from the need for special instruments, there is also a significant learning curve to acquire expertise to be able to perform a laparoscopic bile duct surgery.
Morbidity and mortality rates of laparoscopic exploration are comparable to ERCP (2–17 and 1–5 %), and there is no clear difference in primary success rates between the two approaches. However, the endoscopic approach may be preferable for elderly and frail patients, who are at higher risk with surgery. Patients older than 70–80 years of age have a 4–10 % mortality rate with open duct exploration. It may be as high as 20 % in elderly patients undergoing urgent procedures. In comparison, advanced age and comor- bidities do not have a significant impact on overall complication rates for ERCP. A success rate of over 90 % has been reported with laparoscopic CBD exploration. Availability of surgical expertise and appropriate equipment affect the success rate of laparoscopic exploration, as does the size, number of the CBD stones, as well as biliary anatomy. Over the years, laparoscopic exploration has become efficient, safe, and cost effective. Complications include CBD laceration, stricture formation, bile leak, abscess, pancreatitis, and retained stones.
In cases of failure of laparoscopic CBD exploration, a guidewire or stent can be passed through the cystic duct, common bile duct, and through the ampulla into the duodenum followed by cholecystectomy. This makes the identification and cannulation of the ampulla easier during the post- operative ERCP. Laparoscopic common bile duct exploration is traditionally performed through a transcystic or transductal approach. The transcystic approach is appropriate under certain circumstances. These include a small stone (<10 mm) located in the CBD, presence of small common bile duct (<6 mm), or if there is poor access to the common duct. The transductal approach is preferable in cases of large stones, stones in proximal ducts (hepatic ducts), large occluding stones in a large duct, presence of multiple stones, or if the cystic duct is small (<4 mm) or tortuous. Contraindications for laparoscopic approach include lack of training, and severe inflammation in the porta hepatis making the exploration difficult and risky.
Key Points
With advancement in imaging technology, laparoscopic and endoscopic techniques, management of common bile duct stone has changed drasti- cally in recent years. This has made the treatment of this condition safe and more efficient. Many options are now available to manage this condition, and any particular modality for treatment should be chosen carefully based on the patient related factors, institutional protocol, available expertise, resources, and cost-effectiveness.
Classroom: M.I.A. of Choledocholithiasis
IPMN Surgical Management

INTRODUCTION
IPMNs were first recognized in 1982 by Ohashi, but the term IPMN was not officially used until 1993. IPMNs are defined in the WHO Classification of Tumors of the Digestive System as an intraductal, grossly visible epithelial neoplasm of mucin-producing cells. Using imaging and histology, IPMNs can be classified into three types based on duct involvement:
1. Main-duct IPMN (approximately 25% of IPMNs): Segmental or diffuse dilation of the main pancreatic duct (>5 mm) in the absence of other causes of ductal obstruction.
2. Branch-duct IPMN (approximately 57% of IPMNs): Pancreatic cysts (>5 mm) that communicate with the main pancreatic duct.
3. Mixed type IPMN (approximately 18% of IPMNs): Meets criteria for both main and branch duct.
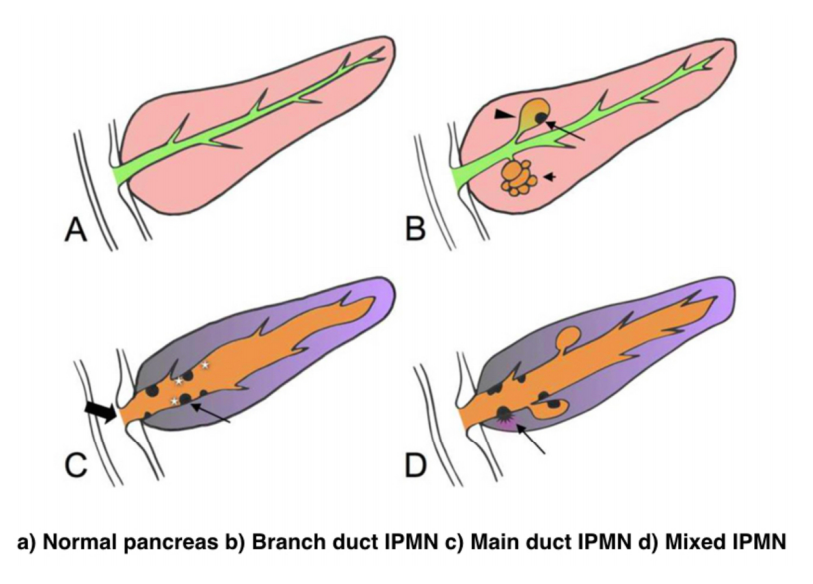
Due to the asymptomatic nature of the disease, the overall incidence of IPMNs is difficult to define but is thought to account for approximately 3% to 5% of all pancreatic tumors. Most IPMNs are discovered as incidental lesions from the workup of an unrelated process by imaging or endoscopy. IPMNs are slightly more prevalent in males than in females, with a peak incidence of 60 to 70 years of age. Branch-duct IPMNs tend to occur in a slightly younger population and are less associated with malignancy compared with main-duct or mixed variants.
Because a majority of IPMNs are discovered incidentally, most are asymptomatic. When symptoms do occur, they tend to be nonspecific and include unexplained weight loss, anorexia, abdominal pain, and back pain. Jaundice can occur with mucin obstructing the ampulla or with an underlying invasive carcinoma. The obstruction of the pancreatic duct can also lead to pancreatitis. IPMNs may represent genomic instability of the entire pancreas. This concept, known as a “field defect,” has been described as a theoretical risk of developing a recurrent IPMN or pancreatic adenocarcinoma at a site remote from the original IPMN. The three different types of IPMNs, main duct, branch duct, and mixed duct, dictate different treatment algorithms.
MAIN DUCT IPMNs
Main-duct IPMNs should be resected in all patients unless the risks of existing comorbidities outweigh the benefits of resection. The goal of operative management of IPMNs is to remove all adenomatous or potentially malignant epithelium to minimize recurrence in the pancreas remnant. There are two theories on the pathophysiologic basis of IPMNs. The first groups IPMNs into a similar category as an adenocarcinoma, a localized process involving only a particular segment of the pancreas. The thought is that removal of the IPMN is the only treatment necessary. In contrast, some believe IPMNs to represent a field defect of the pancreas. All of the ductal epithelium remains at risk of malignant degeneration despite removal of the cyst. Ideally, a total pancreatectomy would eliminate all risk, but this is a radical procedure that is associated with metabolic derangements and exocrine insufficiency. Total pancreatectomy should be limited to the most fit patients, with a thorough preoperative assessment and proper risk stratification prior to undertaking this surgery.
There is less uncertainty with treatment of main-duct IPMNs. The high incidence of underlying malignancy associated with the IPMNs warrants surgical resection. IPMNs localized to the body and tail (approximately 33%) can undergo a distal pancreatectomy with splenectomy. At the time of surgery, a frozen section of the proximal margin should be interpreted by a pathologist to rule out high-grade dysplasia. A prospective study identified a concordance rate of 94% between frozen section and final pathologic examination. If the margin is positive (high-grade dysplasia, invasion) additional margins may be resected from the pancreas until no evidence of disease is present. However, most surgeons will proceed to a total pancreatectomy after two subsequent margins demonstrate malignant changes. This more extensive procedure should be discussed with the patient prior to surgery, and the patient should be properly consented regarding the risks of a total pancreatectomy.
IPMNs localized to the head or uncinate process of the pancreas should undergo a pancreaticoduodenectomy. A frozen section of the distal margin should be analyzed by pathology for evidence of disease. As mentioned before, after two additional margins reveal malignant changes, a total pancreatectomy is usually indicated (approximately 5%). The absence of abnormal changes in frozen sections does not equate to negative disease throughout the pancreas remnant. Rather, skip lesions involving the remainder of the pancreas can exist and thus patients ultimately still require imaging surveillance after successful resection. A prophylactic total pancreatectomy is rarely performed because the subsequent pancreatic endocrine (diabetes mellitus) and exocrine deficits (malnutrition) carry an increased morbidity.
BRANCH DUCT IPMNs
Localized branch-duct IPMN can be treated with a formal anatomic pancreatectomy, pancreaticoduodenectomy, or distal pancreatectomy, depending on the location of the lesion. However, guidelines were established that allow for nonoperative management with certain branch- type IPMN characteristics.
These include asymptomatic patients with a cyst size less than 3 cm and lack of mural nodules. The data to support this demonstrate a very low incidence of malignancy (approximately 2%) in this patient group. Which nearly matches the anticipated mortality of undergoing a formal anatomic resection. In approximately 20% to 30% of patients with branch- duct IPMNs, there is evidence of multifocality. The additional IPMNs can be visualized on high-resolution CT or MRI imaging. Ideally, patients with multifocal branch-duct IPMNs should undergo a total pancreatectomy. However, as previously mentioned, the increased morbidity and lifestyle alterations associated with a total pancreatectomy allows for a more conservative approach. This would include removing the most suspicious or dominant of the lesions in an anatomic resection and follow-up imaging surveillance of the remaining pancreas remnant. If subsequent imaging demonstrates malignant charac- teristics, a completion pancreatectomy is usually indicated.
RECURRENCE RATES
Recurrence rates with IPMNs are variable. An anatomic resection of a branch-duct IPMN with negative margins has been shown to be curative. The recurrence of a main- duct IPMN in the remnant gland is anywhere from 0% to 10% if the margins are negative and there is no evidence of invasion. Most case series cite a 5-year survival rate of at least 70% after resection of noninvasive IPMNs. In contrast, evidence of invasive disease, despite negative margins, decreases 5-year survival to 30% to 50%. The recurrence rate in either the pancreatic remnant or distant sites approaches 50% to 90% in these patients. Histopathologic subtype of the IPMN is correlated with survival. The aggressive tubular subtype has a 5-year survival ranging from 37% to 55% following surgical resection, whereas the colloid subtype has 5-year survival ranging from 61% to 87% post resection. Factors associated with decreased survival include tubular subtype, lymph node metastases, vascular invasion, and positive margins. IPMNs with evidence of invasion should be treated similar to pancreatic adenocarcinomas. Studies show that IPMNs tend to have better survival than pancreatic adenocarcinoma. This survival benefit may be secondary to the less aggressive tumor biology or the earlier diagnosis of IPMNs.
SURVEILLANCE
All patients who have a resected IPMN should undergo imaging surveillance. There is continual survival benefit with further resection if an IPMN does recur. International Consensus Guidelines published in 2017 offer recom- mendations for the frequency and modality of imaging surveillance after resection. Routine serum measurement of CEA and CA 19-9 has a limited role for detection of an IPMN recurrence. Of note, a new pancreatic lesion discovered on imaging after resection could represent a postoperative pseudocyst, a recurrence of the IPMN from inadequate resection, a new IPMN, or an unrelated new neoplastic process. IPMNs may also be associated with extrapancreatic neoplasms (stomach, colon, rectum, lung, breast) and pancreatic ductal adenocarcinoma. It is unclear if this represents a true genetic syndrome. However, patients with IPMNs should have a discussion about the implications of their disease with their physician and are encouraged to undergo colonoscopy to exclude a synchronous neoplastic process.
The incidence of PANCREATIC CYSTIC LESIONS will continue to increase as imaging technology improves. EUS, cytology, and molecular panels have made differentiating the type of PCN less problematic. The importance of an accurate preoperative diagnosis ensures that operative management is selectively offered to those with high-risk lesions. Management beyond surgery, including adjuvant therapy and surveillance, continue to be active areas of research.
Hepatocellular Carcinoma: Resection Versus Transplantation

Hepatocellular carcinoma is the second most common cause of cancer mortality worldwide and its incidence is rising in North America, with an estimated 35,000 cases in the U.S. in 2014. The best chance for cure is surgical resection in the form of either segmental removal or whole organ transplantation although recent survival data on radiofrequency ablation approximates surgical resection and could be placed under the new moniker of “thermal resection”. The debate between surgical resection and transplantation focuses on patients with “within Milan criteria” tumors, single tumors, and well compensated cirrhosis who can safely undergo either procedure. Although transplantation historically has had better survival outcomes, early diagnosis, reversal of liver disease, and innovations in patient selection and neo-adjuvant therapies have led to similar 5-year survival. Transplantation clearly has less risk of tumor recurrence but exposes recipients to long term immunosuppression and its side effects. Liver transplantation is also limited by the severe global limit on the supply of organ donors whereas resection is readily available. The current data does not favor one treatment over the other for patients with minimal or no portal hypertension and normal synthetic function. Instead, the decision to resect or transplant for HCC relies on multiple factors including tumor characteristics, biology, geography, co-morbidities, location, organ availability, social support and practice preference.
Resection Versus Transplantation
The debate between resection and transplantation revolves around patients who have well compensated cirrhosis with Milan criteria resectable tumors. Patients within these criteria represent a very small proportion of those who initially present with HCC. This is especially true in western countries where hepatitis C is the most common cause of liver failure and HCC is a result of the progressive and in most cases advanced cirrhosis.
Given the need for a large number of patients to show statistical significance, it would be difficult to perform a high-quality prospective randomized controlled trial comparing resection and transplantation. In fact the literature revealed that no randomized controlled trials addressing this issue exist. Instead, outcomes of surgical treatment for HCC stem from retrospective analyses that have inherent detection, selection and attrition biases.
Given the numerous articles available on this subject, several meta-analyses have been published to delineate the role of transplantation and resection for treatment of HCC. However, there is reason to be wary of these meta-analyses because they pool data from heterogeneous populations with variable selection criteria and treatment protocols. One such meta-analysis by Dhir et al. focused their choice of articles to strict criteria which excluded studies with non-cirrhotic patients, fibrolamellar HCC and hepato-cholangiocarcinomas but included those with HCC within Milan criteria and computation of 5-year survival; between 1990 and 2011 they identified ten articles that fit within these criteria, of which six were ITT analyses, six included only well-compensated cirrhotics (Child-Pugh Class A without liver dysfunction) and three were ITT analyses of well-compensated cirrhotics.
Analysis of the six ITT studies that included all cirrhotics (n = 1118) (Child-Pugh Class A through C) showed no significant difference in survival at 5 years (OR = 0.600, 95 % CI 0.291– 1.237 l; p=0.166) but ITT analysis of only well-compensated cirrhotics (Child- Pugh Class A) revealed that patients undergoing transplant had a significantly higher 5-year survival as compared to those with resection (OR=0.521, 95 % CI 0.298–0.911; p=0.022).
A more recent ITT retrospective analysis from Spain assessed long-term survival and tumor recurrence following resection or transplant for tumors <5 cm in 217 cirrhotics (Child-Pugh Class A, B and C) over the span of 16 years. Recurrence at 5 years was significantly higher in the resection group (71.6 % vs. 16 % p<0.001) but survival at 4 years was similar (60 % vs. 62 %) which is likely explained by the evolving role of adjuvant therapies to treat post-resection recurrence.
Conclusions
- Patients with anatomically resectable single tumors and no cirrhosis or Child-Pugh Class A cirrhosis with normal bilirubin, HVPG (<10 mmHg), albumin and INR can be offered resection (evidence quality moderate; strong recommendation).
- Patients with Milan criteria tumors in the setting of Child- Pugh Class A with low platelets and either low albumin or high bilirubin or Child-Pugh Class B and C cirrhosis, especially those with more than one tumor, should be offered liver transplantation over resection (evidence quality moderate; strong recommendation).
- Those with Milan criteria tumors and Child-Pugh Class A cirrhosis without liver dysfunction should be considered for transplantation over resection (evidence quality low; weak recommendation).
- No recommendation can be made in regard to transplanting tumors beyond Milan criteria (evidence quality low) except to follow regional review board criteria.
- Pre-transplant therapies such as embolic or thermal ablation are safe and by expert opinion considered to be effective in decreasing transplant waitlist dropout and bridging patients to transplant (evidence quality low, weak recommendation). These interventions should be considered for those waiting longer than 6 months (evi- dence quality low, moderate recommendation).
- Living donor liver transplantation is a safe and effective option for treatment of HCC that are within and exceed Milan criteria (evidence quality moderate, weak recommendation).
Modern Concepts of Pancreatic Surgery
 Operations on the gallbladder and bile ducts are among the surgical procedures most commonly performed by general surgeons. In most hospitals, cholecystectomy is the most frequently performed operation within the abdomen. Pancreatic surgery is less frequent , but because of the close relation between the biliary system and the pancreas, knowledge of pancreatic problems is equally essential to the surgeon. Acute and chronic pancreatitis and cancer of the pancreas are often encountered by surgeons, with apparently increasing frequency; their treatment remains difficult and perplexing. This review demonstrates the modern aspects of pancreatic surgery. Good study.
Operations on the gallbladder and bile ducts are among the surgical procedures most commonly performed by general surgeons. In most hospitals, cholecystectomy is the most frequently performed operation within the abdomen. Pancreatic surgery is less frequent , but because of the close relation between the biliary system and the pancreas, knowledge of pancreatic problems is equally essential to the surgeon. Acute and chronic pancreatitis and cancer of the pancreas are often encountered by surgeons, with apparently increasing frequency; their treatment remains difficult and perplexing. This review demonstrates the modern aspects of pancreatic surgery. Good study.
AULA: PRÍNCIPIOS MODERNOS DA CIRURGIA PANCREÁTICA
Surgical treatment of ACUTE PANCREATITIS
Acute pancreatitis is more of a range of diseases than it is a single pathologic entity. Its clinical manifestations range from mild, perhaps even subclinical, symptoms to a life-threatening or life-ending process. The classification of acute pancreatitis and its forms are discussed in fuller detail by Sarr and colleagues elsewhere in this issue. For the purposes of this discussion, the focus is on the operative interventions for acute pancreatitis and its attendant disorders. The most important thing to consider when contemplating operative management for acute pancreatitis is that we do not operate as much for the acute inflammatory process as for the complications that may arise from inflammation of the pancreas. In brieSurgical treatment of acute pancreatitisf, the complications are related to: necrosis of the parenchyma, infection of the pancreas or surrounding tissue, failure of pancreatic juice to safely find its way to the lumen of the alimentary tract, erosion into vascular or other structures, and a persistent systemic inflammatory state. The operations may be divided into three major categories: those designed to ameliorate the emergent problems associated with the ongoing inflammatory state, those designed to ameliorate chronic sequelae of an inflammatory event, and those designed to prevent a subsequent episode of acute pancreatitis. This article provides a review of the above.
SURGICAL TREATMENT OF ACUTE PANCREATITIS
Tratamento Cirúrgico da Hemorragia digestiva alta por varizes esofágicas | Hipertensão Porta
O sistema portal é uma rede venosa de baixa pressão, com níveis fisiológicos <5 mmHg. Desta forma, o termo hipertensão portal (HP) designa uma síndrome clínica caracterizada pelo aumento mantido na pressão venosa em níveis acima dos fisiológicos. Ela é considerada clinicamente significante quando acima de 10 mmHg; neste nível existe o risco de surgimento de varizes esofagogástricas (VEG). Por sua vez, valores acima de 12 mmHg cursam com risco de rompimento dessas varizes, sua principal complicação.
ARTIGO DE REVISÃO – HIPERTENSÃO PORTAL
O aumento do fluxo como fator preponderante inicial da HP é raro e representado por fístulas arterioportais congênitas, traumáticas ou neoplásicas. O aumento da resistência é a condição fisiopatológica inicial mais comum e pode ser classificada de acordo com o local de obstrução ao fluxo em: pré-hepática, intra-hepática e pós-hepática. A HP intra-hepática responde pela grande maioria dos casos e pode ser subdividida de acordo com o local de acometimento estrutural no parênquima hepático em: pré-sinusoidal (ex: esquistossomose hepatoesplênica – EHE), sinusoidal (ex: cirrose hepática) e pós-sinusoidal (ex: doença venoclusiva). Em nosso meio, a maioria dos casos é decorrente da EHE e das hepatopatias crônicas complicadas com cirrose.
O tratamento da HP depende da causa subjacente, da condição clínica e do momento em que é realizado. Pacientes com função hepática comprometida têm abordagem diversa daqueles com ela preservada, como os portadores de EHE. Além disso, o tratamento pode ser emergencial (durante episódio agudo de hemorragia) ou eletivo, como profilaxia pré-primária, primária ou secundária. Por essa diversidade de situações clínicas, não existe modalidade única de tratamento.
O objetivo da aula abaixo foi avaliar os avanços e as estratégias atuais empregadas no tratamento emergencial e eletivo da hemorragia digestiva varicosa em pacientes cirróticos e esquistossomóticos.
AULA: TRATAMENTO CIRÚRGICO DA HIPERTENSÃO PORTAL
POST-HEPATECTOMY ADVERSE EVENTS
Hepatic resection had an impressive growth over time. It has been widely performed for the treatment of various liver diseases, such as malignant tumors, benign tumors, calculi in the intrahepatic ducts, hydatid disease, and abscesses. Management of hepatic resection is challenging. Despite technical advances and high experience of liver resection of specialized centers, it is still burdened by relatively high rates of postoperative morbidity and mortality. Especially, complex resections are being increasingly performed in high risk and older patient population. Operation on the liver is especially challenging because of its unique anatomic architecture and because of its vital functions. Common post-hepatectomy complications include venous catheter-related infection, pleural effusion, incisional infection, pulmonary atelectasis or infection, ascites, subphrenic infection, urinary tract infection, intraperitoneal hemorrhage, gastrointestinal tract bleeding, biliary tract hemorrhage, coagulation disorders, bile leakage, and liver failure. These problems are closely related to surgical manipulations, anesthesia, preoperative evaluation and preparation, and postoperative observation and management. The safety profile of hepatectomy probably can be improved if the surgeons and medical staff involved have comprehensive knowledge of the expected complications and expertise in their management.
Classroom: Hepatic Resections
The era of hepatic surgery began with a left lateral hepatic lobectomy performed successfully by Langenbuch in Germany in 1887. Since then, hepatectomy has been widely performed for the treatment of various liver diseases, such as malignant tumors, benign tumors, calculi in the intrahepatic ducts, hydatid disease, and abscesses. Operation on the liver is especially challenging because of its unique anatomic architecture and because of its vital functions. Despite technical advances and high experience of liver resection of specialized centers, it is still burdened by relatively high rates of postoperative morbidity (4.09%-47.7%) and mortality (0.24%-9.7%). This review article focuses on the major postoperative issues after hepatic resection and presents the current management.
REVIEW_ARTICLE_HEPATECTOMY_COMPLICATIONS
PANCREATIC PSEUDOCYST
Classroom: Principles of Pancreatic Surgery
The pancreatic pseudocyst is a collection of pancreatic secretions contained within a fibrous sac comprised of chronic inflammatory cells and fibroblasts in and adjacent to the pancreas contained by surrounding structures. Why a fibrous sac filled with pancreatic fluid is the source of so much interest, speculation, and emotion amongst surgeons and gastroenterologists is indeed hard to understand. Do we debate so vigorously about bilomas, urinomas, or other abdominal collections of visceral secretions? Perhaps it is because the pancreatic pseudocyst represents a sleeping tiger, which though frequently harmless, still can rise up unexpectedly and attack with its enzymatic claws into adjacent visceral and vascular structures and cause lifethreatening complications. Another part of the debate and puzzlement about pancreatic pseudocysts is related to confusion about pancreatic pseudocyst definition and nomenclature. The Atlanta classification, developed in 1992, was a pioneering effort in describing and defining morphologic entities in acute pancreatitis. Since then, a working group has been revising this system to incorporate more modern experience into the terminology. In the latest version of this system, pancreatitis is divided into acute interstitial edematous pancreatitis (IEP) and necrotizing pancreatitis (NP), based on the presence of pancreatic tissue necrosis. The fluid collections associated with these two “types” of pancreatitis are also differentiated. Early (<4 weeks into the disease course) peripancreatic fluid collections in IEP are referred to as acute peripancreatic fluid collections (APFC), whereas in NP, they are referred to as postnecrotic peripancreatic fluid collections (PNPFC). Late (>4 weeks) fluid collections in IEP are called pancreatic pseudocysts, and in NP, they are called walled-off pancreatic necrosis (WOPN).
Ebook: Princípios da Cirurgia Hepatobiliar

Cirurgia Hepatobiliar
Considera-se que a cirurgia hepática começou após o advento da anestesia e da anti-sepsia. No entanto, muito antes disso, diversos autores já relatavam suas experiências com ressecções do fígado. As primeiras descrições de “cirurgias hepáticas” consistiam no relato de avulsões parciais ou totais de porções do fígado após lesões traumáticas do abdome. O relato de Elliot (1897) exemplifica muito dos temores dos cirurgiões da época: “O fígado (…) é tão friável, tão cheio de vasos e tão evidentemente impossível de ser suturado que parece ser improvável o manejo bem sucedido de grandes lesões de seu parênquima”.
CIRURGIA HEPATOBILIAR_ASPECTOS BÁSICOS
Cystic Disorders of the Bile Ducts
 OVERVIEW
OVERVIEW
Cystic disorders of the bile ducts, although rare, are well-defined malformations of the intrahepatic and/or extrahepatic biliary tree. These lesions are commonly referred to as choledochal cysts,which is a misnomer, as these cysts often extend beyond the common bile duct (choledochus).
EPIDEMIOLOGY
Cystic disorders of the bile ducts account for approximately 1% of all benign biliary disease. Also, biliary cysts are four times more common in females than males. The majority of patients (60%) with bile duct cysts are diagnosed in the first decade of life, and approxi-mately 20% are diagnosed in adulthood.
CLASSIFICATION
Cystic dilatation of the bile ducts occurs in various shapes—fusi-form, cystic, saccular, and so on—and in different locations through-out the biliary tree. The most commonly used classification is the Todani modification of the Alonso-Lej classification.
ETIOLOGY
The exact etiology of biliary cysts is unknown.
CLINICAL PRESENTATION
The initial clinical presentation varies significantly between children and adults. In children, the most common symptoms are intermittent abdominal pain, nausea and vomiting, mild jaundice, and an abdom-inal mass. The classical triad of abdominal pain, jaundice, and a pal-pable abdominal mass associated with choledochal cyst is observed in only 10% to 15% of children, and it is rarely seen in adults. Symp-toms in adults often mimic those seen in patients with biliary tract disease or pancre-atitis.
SURGICAL MANAGEMENT
The definitive treatment of bile duct cysts usually includes surgical excision of the abnormal extrahepatic bile duct with biliary-enteric reconstruction. This approach relieves biliary obstruction, prevent-ing future episodes of cholangitis, stone formation, or biliary cirrho-sis and thus interrupting the inflammatory liver injury cycle. It also stops pancreatic juice reflux, and more importantly, it removes tissue at risk of malignant transformation.
Avanços no tratamento cirúrgico das METÁSTASES HEPÁTICAS DE ORIGEM COLORRETAL
O câncer colorretal é o terceiro tumor mais frequente no ocidente. Cerca de 50% dos pacientes desenvolvem metástases hepáticas na evolução da doença, as quais são responsáveis por, no mínimo, dois terços das mortes. O avanço nas técnicas cirúrgicas e a melhora dos esquemas quimioterápicos têm permitido oferecer tratamento com intuito curativo a um número cada vez maior de pacientes. Os avanços recentes do tratamento das metástases hepáticas, incluindo estratégias para aumentar as ressecções (por exemplo: embolização da veia porta, ablação por radiofrequência, hepatectomia em dois tempos, quimioterapia de conversão e estratégia inversa de tratamento) e hepatectomias na presença de doença extra-hepática possibilitam uma melhor sobrevida dos pacientes.
TRANSPLANTE DE FÍGADO
Este artigo é destinado a pacientes que irão passar por um transplante hepático e seus familiares. Ele visa esclarecer dúvidas comuns e fornecer informações importantes para enfrentar a experiência de forma mais tranquila e informada.
1. Quando está indicado o transplante?
O transplante hepático é recomendado em casos de:
- Cirrose Hepática: Quando exames mostram função hepática diminuída ou sintomas como ascite, sangramento digestivo, encefalopatia hepática ou peritonite bacteriana.
- Hepatocarcinoma: Tumores originários do fígado, muitas vezes associados à cirrose, podem ser tratados com transplante.
- Colangite Esclerosante e Obstrução Intratável de Vias Biliares: Doenças que causam obstrução das vias biliares e infecções graves.
- Hepatite Fulminante e Perda do Fígado Transplantado: Em casos de hepatite grave ou perda do enxerto transplantado dentro de 30 dias, a urgência é priorizada.
2. Quais são as contra-indicações ao transplante hepático?
Não é indicado realizar o transplante em situações como:
- Doença avançada em outros órgãos.
- Tumores fora do fígado.
- Abuso atual de drogas ou álcool.
- Incapacidade de seguir orientações médicas.
- Infecção ativa (o transplante pode ser realizado após a infecção ser controlada).
A idade avançada não é mais uma contra-indicação absoluta, mas deve ser avaliada individualmente.
3. A fila de transplante
Atualmente, a fila de transplante no Brasil é organizada pelo sistema Meld/Peld, que prioriza pacientes com base na gravidade da doença. A fila é subdividida por grupo sanguíneo (A, B, AB, O) e compatibilidade com o tamanho do paciente. Pacientes com grupo sanguíneo raro (AB) podem receber órgãos de todos os grupos.
4. O fígado “não ideal” (marginal)
Órgãos “não ideais” ou marginais podem ter características menos perfeitas, como mais gordura ou doadores com condições subótimas. Eles são destinados a pacientes com necessidades urgentes, como aqueles com tumores hepáticos.
5. A equipe
A equipe de transplante é composta por diversos profissionais, incluindo médicos, enfermeiros, nutricionistas, psicólogos e fisioterapeutas. Cada paciente passa por avaliações detalhadas de todos esses profissionais.
6. Como proceder em caso de emergências durante a espera pelo transplante
Em situações urgentes, dirija-se ao pronto-socorro ou entre em contato com sua equipe médica. As emergências incluem:
- Vômitos com sangue.
- Fezes com sangue ou escurecidas.
- Queda de pressão, mal-estar súbito.
- Colangite (febre, dor abdominal, icterícia).
- Peritonite (infecção abdominal).
7. As reuniões com a Coordenação de Enfermagem de Transplantes
Reuniões regulares são realizadas para pacientes na fila e seus familiares, oferecendo a oportunidade de trocar experiências, fazer perguntas e receber atualizações sobre a lista de espera.
8. A doação de órgãos através de doador em morte encefálica
A doação é um ato voluntário feito com consentimento familiar. O paciente deve estar em morte encefálica, uma condição onde não há atividade cerebral, mas o coração e outros órgãos ainda funcionam. A entidade responsável é o Rio Transplante e os dados do doador são confidenciais.
9. Chamada para o transplante
Mantenha-se disponível e acessível para a equipe de transplante, com telefone atualizado e a uma distância máxima de duas horas do hospital. Caso seja chamado, esteja preparado para o possível ajuste no órgão doado.
A CIRURGIA DE TRANSPLANTE HEPÁTICO
A cirurgia dura entre 5 a 8 horas e é dividida em duas etapas principais:
- Captação: Retirada do fígado doado, que pode ser considerado apto, marginal ou inapto.
- Transplante: O fígado doente é retirado e o novo órgão é implantado, com a realização das anastomoses das veias, artéria hepática e via biliar.
Pós-operatório Imediato
Você será monitorado na UTI por aproximadamente 48 horas. Equipamentos como tubos respiratórios, eletrodos, sondas e drenos serão usados para garantir segurança e monitoramento.
Pós-operatório
A internação média é de 2 semanas, variando conforme o paciente. É importante realizar exames regularmente e seguir orientações médicas para movimentação e exercícios respiratórios.
Medicação
Os imunosupressores, fornecidos pelo SUS, são essenciais para evitar a rejeição do transplante. Familiarize-se com o processo de obtenção e renovação desses medicamentos. Outras medicações de rotina devem ser providenciadas pela família.
Intercorrências após o Transplante
Monitorar sinais de rejeição e infecções é crucial. Mantenha-se saudável, evite álcool e siga as orientações médicas rigorosamente.
Alta Hospitalar
Antes da alta, você receberá orientações detalhadas e agendamentos para consultas e exames. Siga as recomendações de fisioterapia, nutrição e outros cuidados necessários.
Seguimento Inicial e Tardio
O acompanhamento pós-transplante é fundamental. As consultas variam ao longo do tempo, com exames laboratoriais e visitas regulares ao hospital.
Efeitos Colaterais
Os imunosupressores podem causar efeitos colaterais, como tremores e aumento da glicose. Informe seu médico sobre qualquer efeito adverso e não suspenda a medicação por conta própria.
Cuidados Gerais
Controle o peso, colesterol, glicose e pressão arterial. Evite bebidas alcoólicas, use máscara em locais públicos, evite contato com pessoas doentes e exposição solar excessiva. Mantenha acompanhamento ginecológico e dentário regular e consulte seu médico antes de tomar novos medicamentos. Este artigo é uma referência para ajudar você a entender e gerenciar o processo de transplante hepático. Mantenha-se em contato com sua equipe médica para qualquer dúvida ou preocupação.
Lesão de Vias Biliares na Colecistectomia: Prevenção e Tratamento
A via laparoscópica tem sido reconhecida como padrão de excelência para a colecistectomias. Phillipe Mouret foi quem primeiro a realizou em 1987, mas outros procedimentos já haviam sido realizados por laparoscopia e foram descritos por ginecologistas. Desenvolvida no final da década de 80 e início dos anos 90, a videolaparoscopia mudou os conceitos de acesso cirúrgico e campo operatório, introduzindo a concepção de “cirurgia minimamente invasiva”.A colecistectomia é um dos procedimentos cirúrgicos mais realizados no mundo. Com o advento da videolaparoscopia, tornou-se uma cirurgia menos traumática, mais estética, com períodos mais curtos de internação. Em contrapartida, observou-se o aumento da incidência de lesões de via biliar extra-hepática quando comparado ao procedimento aberto, fato preocupante devido à morbidade elevada desse tipo de lesão, cuja mortalidade não é desprezível.
Tratamento Cirúrgico do HEMANGIOMA HEPÁTICO

Introdução
O hemangioma é o tumor hepático mais comum, identificado em 5% a 7% das necropsias. Sua incidência é maior entre a terceira e a quinta décadas de vida, com prevalência nas mulheres. Este tumor pode aumentar de tamanho durante a gravidez e com o uso de estrogênios.
Conceito
Hemangiomas hepáticos são tumores benignos dos vasos sanguíneos do fígado. Apesar de sua causa não estar completamente esclarecida, há indícios do papel dos hormônios sexuais em seu desenvolvimento. Observações como a presença de receptores de estrogênio em alguns hemangiomas e o aumento de tamanho durante a puberdade, gravidez e uso de anticoncepcionais sugerem essa relação.
Epidemiologia
A maioria dos hemangiomas hepáticos é única e mede menos de 4 cm de diâmetro, com apenas 10% sendo múltiplos e podendo alcançar até 27 cm. Hemangiomas gigantes são definidos como aqueles com mais de 4 cm de diâmetro. Em geral, o tamanho da maioria dos hemangiomas permanece inalterado ao longo do tempo.
Diagnóstico
O diagnóstico de hemangioma hepático é geralmente realizado por exames de imagem, como tomografia computadorizada e ressonância magnética. Esses exames identificam padrões típicos de impregnação nodular periférica e descontínua, com aumento gradual da impregnação. Na ressonância magnética, os hemangiomas tipicamente apresentam um sinal alto nas sequências ponderadas em T2. A cintilografia com hemácias marcadas também é precisa para hemangiomas maiores que 2 cm, mas raramente necessária.
Indicações de Tratamento Cirúrgico
A maioria dos hemangiomas não requer tratamento. Não há evidências para interromper o uso de anticoncepcionais hormonais ou evitar a gravidez em pacientes com hemangioma, mesmo em casos de tumores gigantes. Complicações são raras, mas incluem inflamação, coagulopatia, sangramento e compressão de estruturas vizinhas. O tratamento cirúrgico é indicado apenas em casos de sintomas significativos, crescimento tumoral, síndrome de Kasabach-Merritt, ou quando não é possível excluir malignidade.
Conclusões
Hemangiomas hepáticos, em sua maioria, são assintomáticos e não necessitam de intervenção. O tratamento cirúrgico, apesar de raramente necessário, é realizado em casos selecionados para evitar complicações maiores. A decisão cirúrgica deve ser cuidadosa, considerando os riscos operatórios. Como disse William Osler, “A prática da medicina é uma arte, não um comércio; uma vocação, não um negócio; uma chamada em que seu coração será exercitado igualmente com sua cabeça.”