PRINCIPLES OF OSTOMY MANAGEMENT

The creation of a stoma is a technical exercise. Like most undertakings, if done correctly, the stoma will usually function well with minimal complications for the remainder of the ostomate’s life. Conversely, if created poorly, stoma complications are common and can lead to years of misery. Intestinal stomas are in fact enterocutaneous anastomoses and all the principles that apply to creation of any anastomosis (i.e., using healthy intestine, avoiding ischemia and undue tension) are important in stoma creation.
PREVENTION COMPLICATIONS OF COLON SURGERY
COMPLICATIONS OF COLON SURGERY_REVIEW ARTICLE

Colon surgery represents a high number of patients treated at a department of gastrointestinal surgery and is not limited to colon cancer. It includes other non-neoplastic pathologies such as inflammatory bowel disease, diverticular disease or colonic volvulus. As with any major procedure, colon surgery patients may present serious or even fatal complications. The incidence of postoperative complications from colon surgery has been estimated at between 10% and 30% according to selected series. Preventive measures against surgical complications include selection of an appropriate procedure for the patient as well as good preoperative care, appropriate surgical technique and good postoperative management. When diagnosis has been established, risks for patient should be assessed according to patient’s health conditions and type of surgery accomplished. When the patient meets the surgical requirements, an appropriate course of preoperative care should be carried out including colon wash antibiotics and antithrombotic prophylaxis. Postoperative period will be equivalent to any major abdominal surgery. Typically, it was considered appropriate to wait a few days before initiating feeding in order to protect anastomosis; however, some authors agree that an early oral diet hours after intervention is not associated with a higher risk of anastomotic dehiscence and other complications.
Lymph Node Dissection in Gastric Adenocarcinoma
Extent of lymph node dissection has been an area of controversy in gastric adenocarcinoma for many years. Some surgeons believe that cancer metastasizes through a stepwise progression, and an extensive lymphadenectomy is necessary to improve survival and/or cure the patient. Other physicians argue that extensive ly-mphadenectomies only add pe-rioperative morbidity and mor-tality and do not improve survival. Asian countries have been performing extended lymphadenectomies routinely for many years with promising survival data, although Western countries have not been able to reproduce those results. Much of the controversy surrounding lymphadenectomies started in the 1980s when Japanese studies reported superior survival rates matched stage for stage, compared to the United States. This was theorized to be secondary to the more extensive lymphadenectomy performed in Japan compared to the United States.

A United Kingdom study randomized 400 patients to either a D1 or a D2 lymph node dissection. Those patients with tumors in the upper or middle third of the stomach underwent a distal pancreaticosplenectomy to obtain retropancreatic and splenic hilar nodes. While the 5-year survival rates were not statistically significant between the two groups, on multivariate analyses it was noted that those patients in the D2 group that did not undergo the distal pancreaticosplenectomy had an increased survival compared with the D1 group. A trial in the Netherlands randomized 380 gastric cancer patients to a D1 lymphadenectomy and 331 patients to a D2 lymphadenectomy. Similar to the United Kingdom study, there was not a significant difference in survival between the two groups, even when followed out to 11 years. There was a significant increase in postoperative complications in the D2 group compared with the D1 group (43 % vs. 25 %, respectively) as well as mortality (10 % vs. 4 %, respectively).
The data from these two studies suggest that a pancreaticosplenectomy performed to harvest lymph nodes seems to only add morbidity and mortality while not improving survival. One concern raised about the prior two studies was the variation in surgical technique and lack of standardization of surgeon experience. A Taiwanese study accounted for this by performing the study at a single institution with three surgeons, each of whom had completed at least 25 D3 lymph node dissections prior to the study. Patients with gastric cancer were randomized to a D1 lymph node dissection (defined as resection of perigastric lymph nodes along the lesser and greater curves of the stomach) or a D3 lymph node dissection (defined as resection of additional lymph nodes surrounding the splenic, common hepatic, left gastric arteries, nodes in the hepatoduodenal ligament, and retropancreatic lymph nodes). There was an overall 5-year survival benefit with the D3 group of 60 % compared with the D1 group of 54 %. A Japanese study evaluated a more aggressive lymph node dissection and randomized patients to a D2 dissection or a para-aortic lymph node dissection (PAND). There was no significant difference in 5-year survival between the two groups with a trend toward an increase in complications in the PAND group. Multiple studies have shown that the number of positive lymph nodes is a significant predictor of survival. Current AJCC guidelines stipulate that at least 15 lymph nodes are needed for pathologic examination to obtain adequate staging.
Laparoscopic techniques have become an integral part of surgical practice over the past several decades. For gastric cancer, multiple retrospective studies have reported the advantages of laparoscopic gastrectomy (LG) over open gastrectomy (OG). A recent meta-analysis of 15 nonrandomized comparative studies has also shown that although LG had a longer operative time than OG, it was associated with lower intraoperative blood loss, overall complication rate, fewer wound-related complications, quicker recovery of gastrointestinal motility with shorter time to first flatus and oral intake, and shorter hospital stay. A randomized prospective trial comparing laparoscopic assisted with open subtotal gastrectomy reported that LG had a significantly lower blood loss (229 ± 144 ml versus 391 ± 136 ml; P< 0.001), shorter time to resumption of oral intake (5.1 ± 0.5 days versus 7.4 ± 2 days; P< 0.001), and earlier discharge from hospital (10.3 ± 3.6 days versus 14.5 ± 4.6 days; P< 0.001).
Transanal Endoscopic Microsurgery for Rectal Tumors

Cancer of the rectum is the fifth most common form of cancer in adults worldwide. In 2012, an estimated 40,300 new rectal cancers will be diagnosed in the US with a median age 69 years. Five-year survival rates for rectal cancer are high for early stage disease (90% for Stage I disease) but drop significantly with worsening stage (7% for metastatic Stage IV disease). Recently, advances in neoadjuvant and adjuvant therapy have decreased the rate of local recurrence and improved long-term survival for some patients. Although the treatment for rectal cancer has become increasingly multimodal, surgical excision of the primary tumor remains essential for eradication of disease.
For a long time there has been a debate about the best surgical approach to early stage rectal cancer, whether treatment should involve radical excision (excision of the rectum) or local excision (tumor alone). Proponents of radical surgery argue that excision of the rectum with its surrounding lymphatic drainage offers the best chance for cure. On the other hand, advocates of local excision feel that a less-aggressive approach can avoid the potential ramifications of major pelvic surgery such as sepsis, poor anorectal function, sexual dysfunction, and difficulty with urination and can eliminate the potential need for a permanent stoma. Although the debate has gone back and forth on the adequacy of local excision, there is a growing body of scientific data that suggests that local excision can be sufficient in patients with early rectal cancer of the mid and distal rectum with good histologic features and preoperative imaging (computed tomography, magnetic resonance imaging, and endorectal ultrasound) that shows no evidence of lymph node involvement.
Traditionally, transanal excision has been performed with the conventional technique using traditional equipment. Although this conventional technique can give surgeons operative access to most distal rectal lesions, it can be difficult to conduct on mid-rectal tumors or in large patients with a deep buttock cleft. The technical difficulties experienced under such circumstances can lead to poor visualization, inadequate margins, or specimen fragmentation. In response to the technical limitations of conventional transanal excision, in the 1980s Professor Gehard Buess from Tubingen, Germany, began to develop the technique of transanal endoscopic microsurgery (TEM).

In collaboration with the Richard Wolf Company in Germany, Dr Buess developed the specialized instruments necessary to perform endoscopic surgery transanally. TEM was introduced into clinical practice in 1983, and was gradually implemented in several European countries and eventually introduced in North America and Asia. The last decade has witnessed international growth in the application of TEM yielding a significant amount of scientific data to support its clinical merits and advantages and also shedding some light on its limitations.
Câncer de Esôfago
Epidemiologia, Diagnóstico Precoce e a Complexidade do Tratamento Multimodal
Autor: Prof. Dr. Ozimo Gama
Categoria: Oncologia Cirúrgica / Cirurgia do Aparelho Digestivo
Tempo de Leitura: 9 minutos
Introdução
O esôfago, um tubo musculomembranoso de aproximadamente 25 a 30 centímetros, desempenha a função vital de transportar o bolo alimentar da hipofaringe ao estômago através de peristalse coordenada. Apesar de sua anatomia aparentemente simples, desprovida de serosa, este órgão é sítio de uma das neoplasias mais agressivas e desafiadoras para o cirurgião do aparelho digestivo: o câncer de esôfago. Esta patologia é caracterizada por sua latência clínica. Em fases iniciais, a doença é assintomática, o que retarda o diagnóstico e compromete o prognóstico. Para o estudante de medicina e o residente de cirurgia, compreender a dualidade histológica predominante — Carcinoma Epidermoide (CEC) versus Adenocarcinoma — e seus respectivos fatores de risco é fundamental para a suspeição clínica e o rastreamento adequado.
Epidemiologia e o Cenário Brasileiro
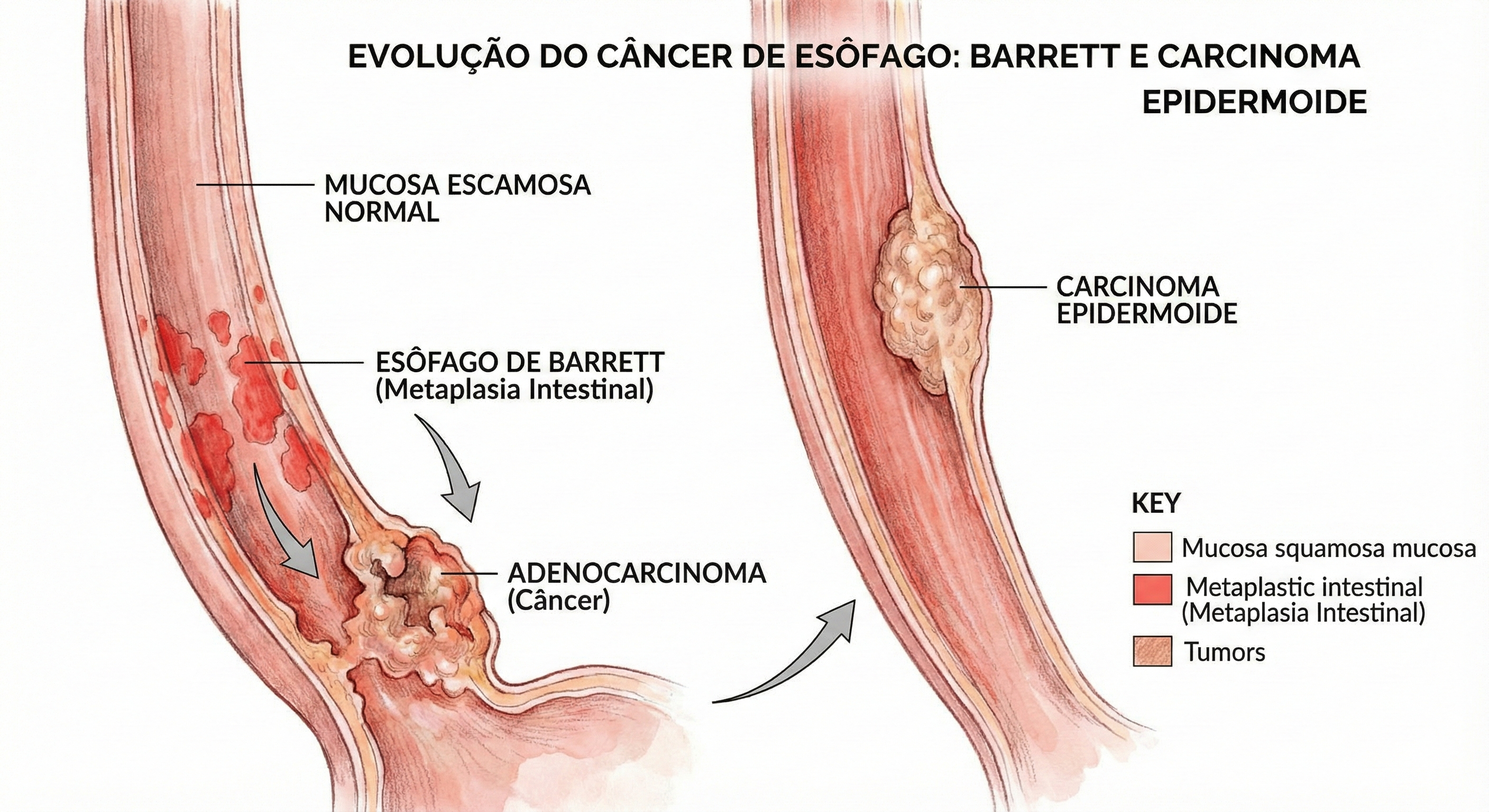
O câncer de esôfago é uma questão de saúde pública global, com alta incidência em regiões do “cinturão do câncer de esôfago” (que se estende da China ao norte do Irã). No Brasil, a doença mantém-se relevante e letal. Dados atualizados da Estimativa 2023-2025 do Instituto Nacional de Câncer (INCA) projetam cerca de 10.990 novos casos anuais no país. A incidência é marcadamente maior no sexo masculino, ocupando a 6ª posição entre os tipos de câncer mais frequentes nos homens (excetuando-se o câncer de pele não melanoma). Historicamente, o Carcinoma Epidermoide representa a grande maioria dos casos (cerca de 96% em séries históricas brasileiras), intimamente ligado ao tabagismo e etilismo. Contudo, observamos uma transição epidemiológica importante: o Adenocarcinoma distal tem apresentado um crescimento exponencial, impulsionado pela epidemia de obesidade e pela Doença do Refluxo Gastroesofágico (DRGE) que culmina no Esôfago de Barrett.
Fatores de Risco e Prevenção
A gênese do câncer esofágico é multifatorial, e a prevenção passa pela mitigação destes agentes:
- Tabagismo e Etilismo: A combinação destes dois fatores tem efeito sinérgico, multiplicando exponencialmente o risco para o tipo Epidermoide.
- Hábitos Alimentares: O consumo frequente de bebidas em temperaturas muito elevadas (comum em certas culturas regionais brasileiras) causa dano térmico crônico à mucosa. Dietas pobres em frutas e vegetais também são fatores predisponentes.
- Condições Precursoras:
- Acalasia: A estase alimentar crônica promove inflamação da mucosa.
- Tilose: Hiperqueratose palmoplantar associada a alto risco de CEC.
- Esôfago de Barrett: A metaplasia intestinal causada pelo refluxo ácido crônico é a lesão precursora do Adenocarcinoma.
- Outros: Síndrome de Plummer-Vinson, ingestão de cáusticos e infecção pelo HPV.
Quadro Clínico: O Desafio do Silêncio
O grande obstáculo no manejo do câncer de esôfago é a ausência de sintomas precoces. A distensibilidade da parede esofágica permite que o tumor cresça significativamente antes de causar obstrução. Quando sintomático, o paciente tipicamente apresenta:
- Disfagia Progressiva: Inicialmente para sólidos, evoluindo para pastosos e líquidos.
- Perda Ponderal: Frequentemente severa (>10% do peso corporal), devido à disfagia e ao catabolismo tumoral.
- Odinofagia e Dor Retroesternal: Indicativos de invasão local ou ulceração.
Propedêutica e Diagnóstico
O padrão-ouro para o diagnóstico é a Endoscopia Digestiva Alta (EDA) com biópsia.
Para o cirurgião e endoscopista, o uso de cromoscopia é vital. O Lugol é utilizado para corar o epitélio escamoso normal (rico em glicogênio), deixando áreas neoplásicas ou displásicas “não coradas” (amarelo-claras), facilitando a biópsia dirigida no Carcinoma Epidermoide. Já o Azul de Toluidina ou métodos digitais (NBI/FICE) auxiliam na detecção do Barrett e Adenocarcinoma precoces. O estadiamento deve ser rigoroso, utilizando Tomografia Computadorizada (tórax e abdome superior) e, idealmente, a Ecoendoscopia (Ultrassom Endoscópico) para avaliar a invasão da parede (T) e linfonodos regionais (N), além do PET-CT para exclusão de metástases à distância.
Abordagem Terapêutica: Multimodalidade
O tratamento depende estritamente do estadiamento e da localização tumoral (Cervical, Torácico ou Junção Esôfago-Gástrica).
- Doença Precoce (Tis/T1a): Pode ser passível de Ressecção Endoscópica (Mucosectomia ou ESD), preservando o órgão com taxas de cura elevadas (98%).
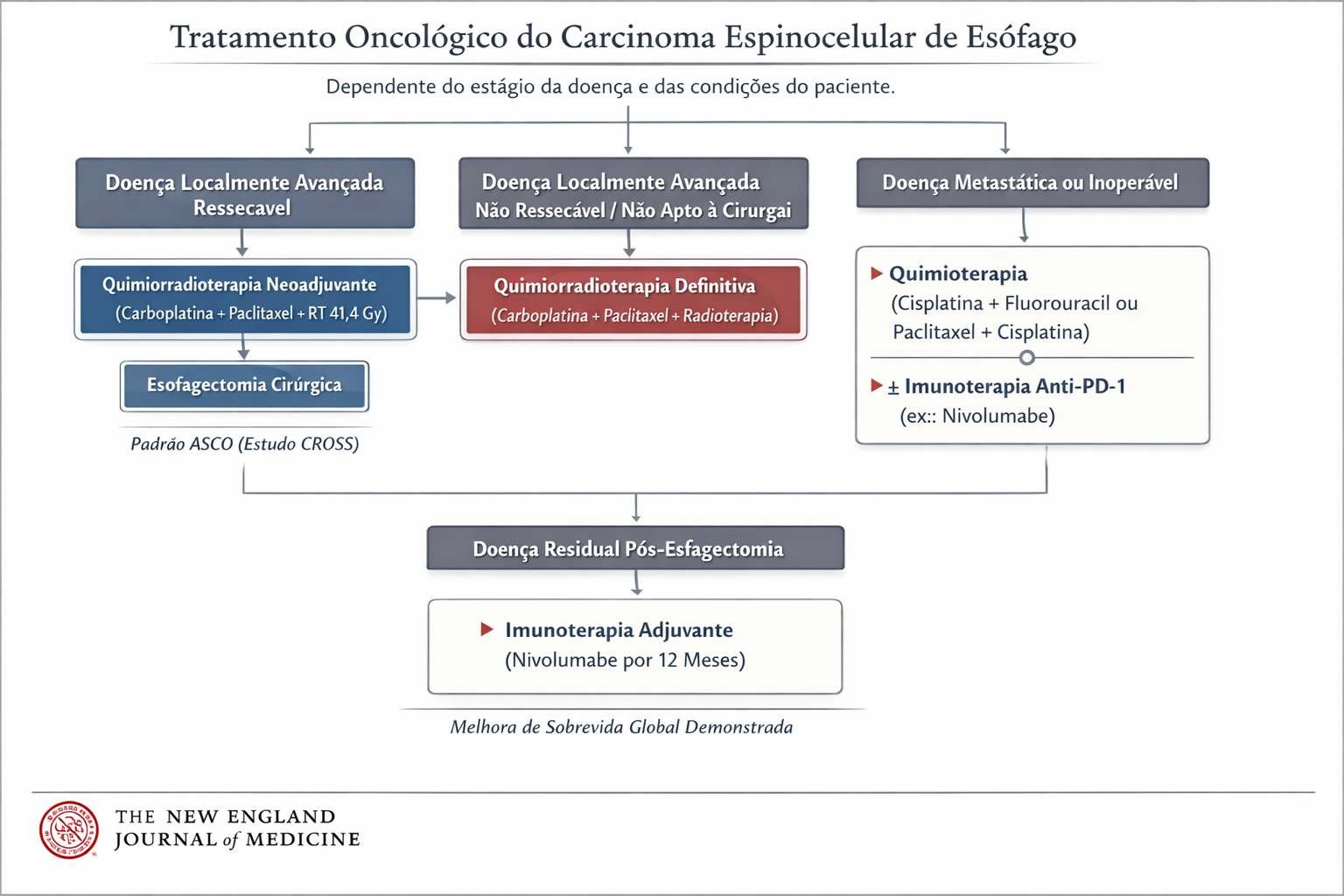
- Doença Localmente Avançada: A cirurgia isolada raramente é suficiente. O padrão atual envolve Terapia Neoadjuvante (Quimioterapia + Radioterapia pré-operatória) seguida de Esofagectomia com Linfadenectomia. A cirurgia é de alta complexidade, podendo ser realizada por via aberta, laparoscópica ou robótica (técnicas de Ivor Lewis ou McKeown).
- Doença Metastática ou Irressecável: O foco torna-se paliativo. A inserção de próteses autoexpansíveis (stents) endoscópicos restaura a via oral e a dignidade do paciente. A radioterapia e braquiterapia também desempenham papel no controle local da disfagia e sangramento.
Pontos-Chave para a Prática Cirúrgica
- Rastreamento: Pacientes com DRGE crônico (há mais de 5-10 anos) ou sintomas de alarme devem ser submetidos a endoscopia para rastreio de Barrett.
- Anatomia: O esôfago não possui serosa, o que facilita a invasão precoce de estruturas mediastinais (traqueia, aorta, pericárdio).
- Diagnóstico: Disfagia em adulto deve ser investigada com EDA imediatamente; não assuma benignidade sem visualização direta.
Conclusão
O câncer de esôfago exemplifica a necessidade da medicina moderna ser multidisciplinar. O cirurgião do aparelho digestivo não atua isolado, mas em concerto com o oncologista clínico, o radio-oncologista e o endoscopista. O diagnóstico precoce continua sendo a arma mais poderosa; contudo, mesmo em estágios avançados, a evolução das técnicas cirúrgicas e das terapias adjuvantes tem oferecido novas perspectivas de sobrevida e qualidade de vida aos nossos pacientes.
“A abordagem cirúrgica do esôfago foi, até recentemente, uma história de frustração. (…) O esôfago é um órgão que tolera a cirurgia mal, exceto quando executada com precisão absoluta.” — Ivor Lewis (1946), cirurgião galês que revolucionou o tratamento do câncer de esôfago com a técnica de esofagectomia transtorácica.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CancerDeEsofago #CirurgiaDoAparelhoDigestivo #Oncologia #Esofagectomia #MedicinaBaseadaEmEvidencias
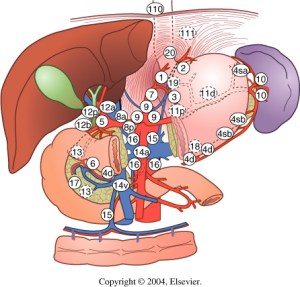
BILIARY-ENTERIC ANASTOMOSIS
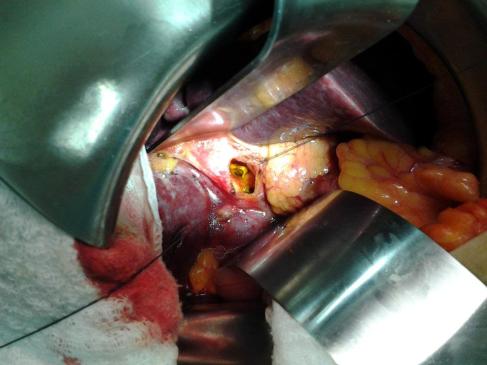 The operative conduct of the biliary-enteric anastomosis centers around three technical steps: 1) identification of healthy bile duct mucosa proximal to the site of obstruction; 2) preparation of a segment of alimentary tract, most often a Roux-en-Y jejunal limb; and 3) construction of a direct mucosa-to-mucosa anastomosis between these two. Selection of the proper anastomosis is dictated by the indication for biliary decompression and the anatomic location of the biliary obstruction. A right subcostal incision with or without an upper midline extension or left subcostal extension provides adequate exposure for construction of the biliary-enteric anastomosis. Use of retractors capable of upward elevation and cephalad retraction of the costal edges are quite valuable for optimizing visual exposure of the relevant hilar anatomy.
The operative conduct of the biliary-enteric anastomosis centers around three technical steps: 1) identification of healthy bile duct mucosa proximal to the site of obstruction; 2) preparation of a segment of alimentary tract, most often a Roux-en-Y jejunal limb; and 3) construction of a direct mucosa-to-mucosa anastomosis between these two. Selection of the proper anastomosis is dictated by the indication for biliary decompression and the anatomic location of the biliary obstruction. A right subcostal incision with or without an upper midline extension or left subcostal extension provides adequate exposure for construction of the biliary-enteric anastomosis. Use of retractors capable of upward elevation and cephalad retraction of the costal edges are quite valuable for optimizing visual exposure of the relevant hilar anatomy.

Division of the ligamentum teres and mobilization of the falciform ligament off the anterior surface of the liver also facilitate operative exposure; anterocephalad retraction of the ligamentum teres and division of the bridge of tissue overlying the umbilical fissure are critical for optimal visualization of the vascular inflow and biliary drainage of segments II, III, and IV. Cholecystectomy also exposes the cystic plate, which runs in continuity with the hilar plate. Lowering of the hilar plate permits exposure of the left hepatic duct as it courses along the base of segment IVb. In cases of unilateral hepatic atrophy as a result of long-standing biliary obstruction or preoperative portal vein embolization, it is critical to understand that the normal anatomic relationships of the portal structures are altered. In the more common circumstance of right-sided atrophy, the portal and hilar structures are rotated posteriorly and to the right; as a result, the portal vein, which is typically most posterior, is often encountered first; meticulous dissection is necessary to identify the common bile duct and hepatic duct deep within the porta hepatis.
BILIARY-ENTERIC ANASTOMOSIS_THECNICAL ASPECTS
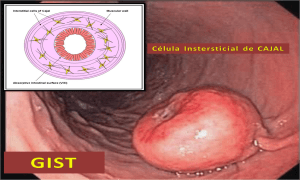
GASTROINTESTINAL STROMAL TUMORS (GIST)
INTRODUÇÃO
GIST, da sigla em inglês gastrointestinal stromal tumors, pertence a um grupo de tumores chamados sarcoma de partes moles. Essa neoplasia se diferencia dos outros tipos de tumores por iniciar-se na parede dos órgãos, junto às camadas musculares do trato gastrointestinal, mais especificamente, nas células do plexo mioenterico, chamadas células de Cajal. Tais células são responsáveis pela motilidade intestinal, sendo consideradas o marca-passo do trato gastrointestinal.
O tumor de GIST é relativamente raro, com estudos atuais mostrando uma prevalência anual em torno de 20 a 40 casos por milhão de habitantes. É mais comum entre pessoas de 50 a 60 anos de idade, sendo extremamente raros até os 20 anos. Por representar um tumor raro, recomenda-se que seja tratado por serviços especializados com cirurgiões do aparelho digestivo, que tenham experiência multidisciplinar na condução e no tratamento dos pacientes com este tumor.
O GIST pode se originar em qualquer local do trato gastrointestinal, do esôfago ao ânus. Em relação à distribuição, 50% a 60% das lesões são provenientes do estômago, 20% a 30% do intestino delgado, 10% do intestino grosso, 5% do esôfago e 5% de outros locais da cavidade abdominal.
DIAGNÓSTICO
A apresentação clínica dos pacientes portadores de GIST não é especifica e depende da localização e do tamanho do tumor. O GIST tem uma característica biológica que é uma mutação genética, com ativação do proto-oncogene Kit e a superexpressão do receptor tirosina quinase (c-Kit). Geralmente, o diagnóstico é feito por uma biópsia da lesão, que a depender da localização, pode ser feita por endoscopia, colonoscopia, ou ecoendoscopia. A tomografia computadorizada do abdômen é importante para avaliação da extensão do tumor e também pode ser utilizada em alguns casos para realização de biópsia do tumor. Não apresentam sinais e/ou sintomas específicos. Podem causar náuseas, vômitos, hemorragias intestinais (vômitos com sangue ou evacuações com sangue ou fezes enegrecidas), sensação de plenitude após alimentação, dor e distensão abdominal, ou presença de uma massa ou tumor palpável no abdômen.
TRATAMENTO
O tratamento padrão para pacientes com GIST não metastático, ou seja, não provenientes de outros órgãos, é a ressecção cirúrgica completa da lesão. Muitas vezes é necessária a cirurgia radical e de grande porte, com a retirada de estruturas e órgãos aderidos, oferecendo a maior chance de cura. O tratamento com imatinib, e mais atualmente ao sunitinib, é utilizado para doença metastática ou irressecável, com intuito de diminuir o tamanho da lesão para que a cirurgia possa ser realizada em melhores condições locais. Tais drogas também podem ser utilizadas após a cirurgia. Para o tratamento sistêmico pode ser necessário estudo genético específico para saber qual a mutação presente no tumor, com intuito de guiar a terapia em relação à dose e tipo de medicação utilizada.
FATORES DE RISCO
Não há fatores de risco diretamente relacionados a essa neoplasia. Manter hábitos de vida saudáveis, uma alimentação balanceada e a prática de exercícios físicos ajudam, de maneira geral, na prevenção do câncer.
PARA MAIS INFORMAÇÕES: http://www.gistsupport.org/
Avanços no tratamento cirúrgico das METÁSTASES HEPÁTICAS DE ORIGEM COLORRETAL
O câncer colorretal é o terceiro tumor mais frequente no ocidente. Cerca de 50% dos pacientes desenvolvem metástases hepáticas na evolução da doença, as quais são responsáveis por, no mínimo, dois terços das mortes. O avanço nas técnicas cirúrgicas e a melhora dos esquemas quimioterápicos têm permitido oferecer tratamento com intuito curativo a um número cada vez maior de pacientes. Os avanços recentes do tratamento das metástases hepáticas, incluindo estratégias para aumentar as ressecções (por exemplo: embolização da veia porta, ablação por radiofrequência, hepatectomia em dois tempos, quimioterapia de conversão e estratégia inversa de tratamento) e hepatectomias na presença de doença extra-hepática possibilitam uma melhor sobrevida dos pacientes.
Diagnóstico Diferencial dos Tumores do Mediastino
A existência de cistos e tumores primários do mediastino tem vindo a ser relatada com uma incidência crescente. Os avanços das técnicas radiológicas, incluindo a TC e a RM, aumentaram singularmente a capa-cidade de avaliar pré – operatoriamente a natureza e a extensão das lesões do mediastino. Por outro lado, os progressos terapêuticos têm sido relacionados com um diagnóstico mais precoce e com uma maior efetividade dos regimes de radioterapia e de quimioterapia.
ARTIGO DE REVISÃO_TUMORES DO MEDIASTINO
PREVENÇÃO DO TROMBOEMBOLISMO NA CIRURGIA DO CÂNCER DO APARELHO DIGESTIVO
ARTIGO DE REVISÃO_TVP_CÂNCER DO APARELHO DIGESTIVO
Tromboembolismo venoso é complicação frequente após tratamento cirúrgico em geral e, de um modo especial, na condução terapêutica do câncer. A cirurgia do aparelho digestivo tem sido referida como potencialmente indutora desta complicação. Ela tem maior representatividade em determinados segmentos anatômicos e nas condições em que se associam fatores de risco dos pacientes. A prevenção do tromboembolismo é tema de grande importância na prática diária dos cirurgiões. Várias são as formas físicas e medicamentosas que podem ser utilizadas. Nos últimos anos abordagens novas, tanto em relação às manobras físicas como em posologia medicamentosa, têm sido estudadas com boa metodologia. Estes novos enfoques ainda são pouco divulgados e talvez pouco conhecidos pela maioria dos cirurgiões. No câncer a importância desse tema é ainda maior que nas doenças benignas. A Medicina Baseada em Evidências incorpora dados obtidos com base nas mais recentes revisões sistemáticas disponíveis na literatura originando várias formas de contribuições científicas. BOM ESTUDO.