Princípios Fundamentais da Oncologia Cirúrgica Digestiva
Uma Abordagem Contemporânea e Baseada em Evidências
O Cenário Atual do Câncer Digestivo no Brasil
A Cirurgia do Aparelho Digestivo vive um momento de transformação sem precedentes. Não somos mais apenas “técnicos de ressecção”, mas parte integrante de uma complexa engrenagem multidisciplinar. A relevância deste tema é sublinhada pelos dados epidemiológicos alarmantes. Se no passado nos baseávamos em estimativas modestas, hoje a realidade é desafiadora: segundo a Estimativa 2023-2025 do Instituto Nacional de Câncer (INCA), esperam-se 704 mil casos novos de câncer por ano no Brasil.
Destaque-se que as neoplasias do trato gastrointestinal ocupam posições cimeiras. O câncer colorretal figura como o segundo mais incidente em mulheres e homens na maioria das regiões, com cerca de 45 mil novos casos anuais, seguido de perto pelo câncer de estômago (21 mil casos) e esôfago. Estes números não são apenas estatísticas; representam uma demanda crescente por cirurgiões oncológicos altamente qualificados, capazes de compreender não apenas a anatomia, mas a biologia tumoral.
A Biologia como Norte da Técnica Cirúrgica
Fisiopatologia e Disseminação
O entendimento clássico da cirurgia oncológica, herdado dos princípios de William Halsted no final do século XIX, baseava-se na premissa de que o câncer era uma doença puramente local que se disseminava centrifugamente. Embora a radicalidade (ressecção em bloco) permaneça um pilar, hoje compreendemos a doença como sistêmica desde fases precoces em muitos casos.
A disseminação ocorre por três vias principais que o cirurgião deve dominar:
- Linfática: Predominante em carcinomas (ex: adenocarcinoma gástrico e cólon).
- Hematogênica: Preferencial em sarcomas e carcinomas avançados (fígado e pulmões como sítios-alvo).
- Transcelômica (Peritoneal): Comum em neoplasias gástricas T3/T4, ovário e apêndice, exigindo estratégias específicas como a peritoniectomia.
O Princípio da Radicalidade e Margens (R0)
O objetivo primário da cirurgia oncológica curativa é a ressecção R0 (ausência de doença residual macroscópica e microscópica). A cirurgia R1 (doença microscópica residual) ou R2 (macroscópica) impacta drasticamente o prognóstico.
- Ressecção em Bloco: O tumor nunca deve ser violado. A peça deve ser removida envolta por tecido saudável, respeitando as fáscias anatômicas e os pedículos vasculares na sua origem.
- Linfadenectomia: Não serve apenas para estadiamento, mas tem papel terapêutico. No câncer gástrico, por exemplo, a linfadenectomia D2 é o padrão-ouro em centros especializados, associada a menor recidiva locorregional.
Neoadjuvância vs. Adjuvância
A decisão entre operar primeiro (upfront surgery) ou indicar terapia neoadjuvante é um dos grandes debates atuais.
- Vantagens da Neoadjuvância: Tratamento precoce de micrometástases, redução do tumor (downstaging) facilitando a ressecção R0 e teste in vivo da quimiossensibilidade. É o padrão atual para câncer de esôfago localmente avançado e câncer de reto médio/baixo.
- Vantagens da Adjuvância: Baseada no estadiamento patológico preciso (pTNM), evitando tratamento excessivo em estádios precoces.
Aplicação Prática na Cirurgia Digestiva
A prática moderna exige que o cirurgião diferencie dois conceitos cruciais frequentemente confundidos: Ressecabilidade e Operabilidade.
- Ressecabilidade: É uma característica do tumor (relação com estruturas vitais).
- Operabilidade: É uma característica do paciente (reserva funcional, comorbidades, status performance). Um tumor pode ser ressecável, mas o paciente inoperável.
O Papel da Citorredução e HIPEC
Para a carcinomatose peritoneal, historicamente considerada uma condição terminal, houve uma mudança de paradigma. Em neoplasias selecionadas (como pseudomixoma peritoneal, mesotelioma e alguns casos de câncer colorretal), a combinação de Cirurgia de Citorredução (Peritoniectomia) com Quimioterapia Intraperitoneal Hipertérmica (HIPEC) tem oferecido sobrevida em longo prazo, transformando uma doença fatal em uma condição crônica tratável.
Planejamento Multidisciplinar
O cirurgião oncológico não atua isolado. A discussão em Tumor Boards é mandatória. A indicação cirúrgica deve considerar a biologia molecular (ex: status do gene APC em colorretal, superexpressão de HER2 em gástrico) e a resposta a terapias sistêmicas.
Pontos-Chave para a Prática Cirúrgica
- Estadiamento Preciso: Nunca leve um paciente à sala sem um estadiamento completo. A laparoscopia diagnóstica é fundamental em tumores gástricos e pancreáticos para evitar laparotomias desnecessárias em casos de carcinomatose oculta.
- Margens Cirúrgicas: A margem circunferencial (radial) no câncer de reto e a margem proximal no câncer gástrico e esofágico são preditores independentes de sobrevida.
- Manuseio da Peça (“No-touch technique”): Evite a manipulação direta do tumor. A ligadura vascular prévia e a mobilização cuidadosa previnem a embolização tumoral intraoperatória.
- Documentação: O relatório cirúrgico deve detalhar as cadeias linfáticas dissecadas e as estruturas preservadas ou ressecadas, orientando o patologista e o oncologista clínico.
Perspectivas Futuras
A cirurgia digestiva na sua área de atuação oncológica evoluiu de amputações extensas para procedimentos de precisão, muitas vezes minimamente invasivos (laparoscópicos ou robóticos), sem perder a radicalidade oncológica. O futuro aponta para uma integração ainda maior com a biologia molecular e a imunoterapia. O cirurgião do futuro deverá ser, antes de tudo, um oncologista que opera: alguém que entende que o bisturi é apenas uma das armas, e que saber quando não operar é tão vital quanto a técnica operatória refinada.
Como nos ensinou o pai da cirurgia oncológica moderna:
“O cirurgião deve ser o médico do paciente oncológico, e não apenas o técnico que remove o tumor.” — William Stewart Halsted
Hashtags
#CirurgiaDigestiva #OncologiaCirurgica #EducaçãoMédica #ResidenciaCirurgia #CancerDigestivo
Gostou? ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat Online em nossa DM do Instagram.
Efeito Cascata do Transplante Hepático
Introdução
O transplante hepático é universalmente reconhecido como o “padrão-ouro” para o tratamento de doenças hepáticas terminais. No entanto, o impacto deste procedimento transcende a substituição de um órgão doente. O sucesso fenomenal do transplante nas últimas cinco décadas produziu o que chamamos de ripple effect (efeito cascata) sobre toda a cirurgia geral e, especificamente, sobre a cirurgia hepatobiliar. Muitos dos princípios anatômicos, refinamentos técnicos e bases científicas que hoje aplicamos rotineiramente em hepatectomias regradas e cirurgias de trauma foram desenvolvidos ou aperfeiçoados nas salas de transplante. O objetivo desta exposição é dissecar como essa “escola” transformou a nossa prática diária, convertendo procedimentos outrora considerados de risco proibitivo em operações seguras e eficazes.
Desenvolvimento: Anatomia e Fisiologia Aplicadas
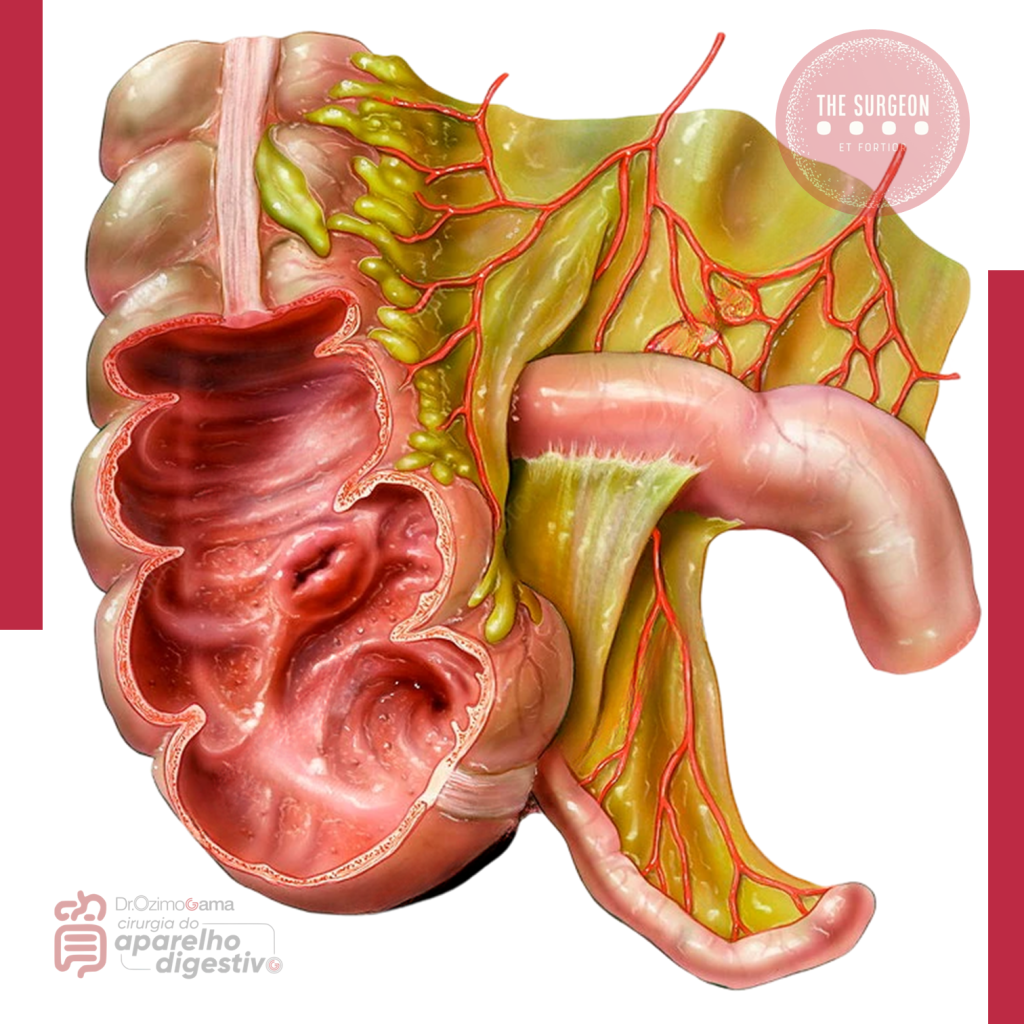
A base de qualquer cirurgia hepática segura é o domínio absoluto da anatomia e da fisiologia. O transplante nos forçou a olhar para o fígado não apenas como uma massa parenquimatosa, mas como uma estrutura segmentar com variações vasculares frequentes.
1. O Novo Mapa Anatômico
A experiência com doadores vivos e hepatectomias em cadáveres nos ensinou que a anatomia “de livro” é a exceção, não a regra.
- Variações Arteriais: Estudos clássicos de grandes centros transplantadores, como a série da UCLA, demonstram que aproximadamente 24% dos fígados possuem anomalias arteriais significativas. As mais comuns incluem a artéria hepática direita acessória ou substituída (originada da artéria mesentérica superior) e a esquerda (originada da artéria gástrica esquerda). O cirurgião que ignora essas variantes durante uma duodenopancreatectomia ou gastrectomia corre o risco de desvascularizar o fígado.
- Variações Biliares: A trifurcação do ducto hepático comum ocorre em cerca de 12% dos casos. O reconhecimento dessas nuances é vital para evitar estenoses e fístulas biliares, as complicações mais temidas no pós-operatório.
2. Regeneração e Isquemia
O transplante impulsionou a pesquisa sobre a capacidade regenerativa do fígado. O conceito de síndrome small-for-size (insuficiência hepática pós-resecção por remanescente pequeno) migrou do transplante intervivos para a oncologia. Hoje, calculamos com precisão o volume do fígado remanescente antes de grandes ressecções tumorais, utilizando estratégias como a embolização prévia da veia porta para hipertrofiar o lobo que ficará no paciente — uma aplicação direta do conhecimento de regeneração hepática. Além disso, o manuseio da lesão de isquemia-reperfusão evoluiu. Técnicas de precondicionamento isquêmico (clampeamento intermitente) permitem que realizemos ressecções complexas com menor perda sanguínea e menor dano hepatocelular.
Aplicação na Cirurgia Digestiva Geral e Oncológica
A transferência de tecnologia do transplante para a cirurgia digestiva geral é evidente em três pilares principais:
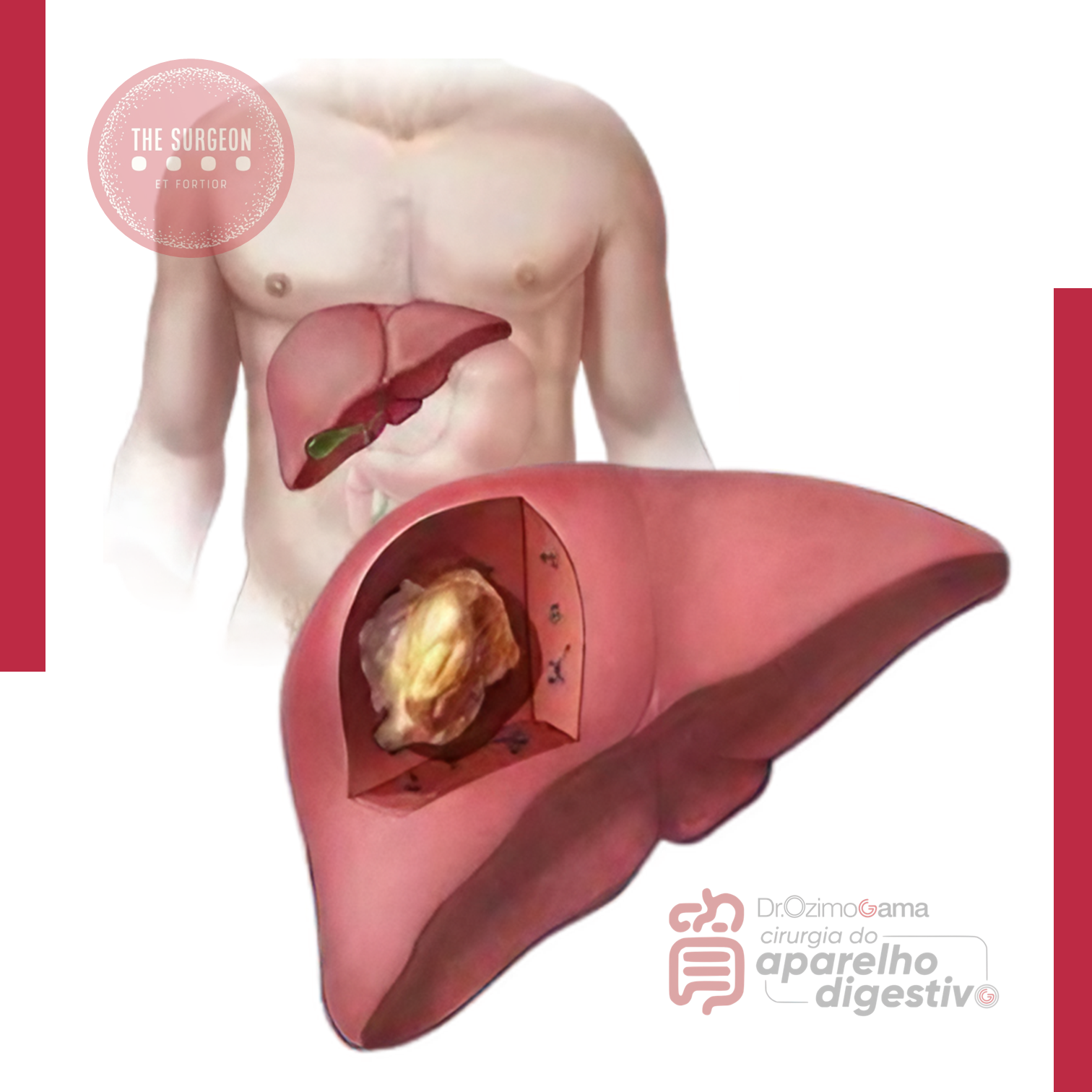
1. Ressecções Hepáticas Complexas e Preservação Caval
Antigamente, tumores no lobo caudado ou que envolviam a veia cava retro-hepática eram considerados irressecáveis. A técnica de “piggyback” (preservação da veia cava inferior do receptor durante o transplante) ensinou aos cirurgiões oncológicos como dissecar o fígado da veia cava com segurança, permitindo a ressecção de tumores centrais e posteriores com margens livres.
2. Controle Vascular no Trauma
O cirurgião de trauma moderno utiliza manobras de exclusão vascular total (clampeamento da porta e da veia cava supra e infra-hepática) para reparar lesões venosas complexas em fígados traumatizados. Esta é uma manobra derivada diretamente da hepatectomia do receptor no transplante. Em pacientes estáveis, isso permite reparos exangues; em instáveis, técnicas de damage control com shunts portocavais temporários podem ser salvadoras.
3. Cirurgia Ex Situ
Para casos extremos de tumores invadindo a confluência cavo-hepática, a técnica de hepatectomia total, seguida de perfusão fria do órgão na bancada (bench surgery), ressecção do tumor ex vivo e reimplante do fígado (autotransplante), é a fronteira final da cirurgia hepatobiliar, tornada possível apenas pelo domínio das técnicas de preservação de órgãos.
Cenário Brasileiro: Uma Potência Mundial 🇧🇷
É fundamental contextualizar nossa realidade. O Brasil possui o maior sistema público de transplantes do mundo.
- Segundo dados recentes da Associação Brasileira de Transplante de Órgãos (ABTO) e do Ministério da Saúde, o Brasil realiza mais de 2.000 transplantes hepáticos anualmente, posicionando-se consistentemente entre as três nações com maior número absoluto de procedimentos no mundo.
- Essa estatística não é apenas um número; ela representa um volume crítico de treinamento. Residentes brasileiros em centros de excelência têm uma exposição prática à anatomia hepática complexa superior à de muitos países desenvolvidos. O “Cirurgião SUS” é, por necessidade e oportunidade, um especialista em variações anatômicas e manuseio de situações complexas.
Pontos-Chave para o Cirurgião em Formação
- Identificação Pré-operatória: Sempre investigue variações arteriais (ex: artéria hepática direita vindo da mesentérica) em exames de imagem antes de qualquer cirurgia do andar supramesocólico.
- Manobras de Exclusão: Familiarize-se com a Manobra de Pringle e a exclusão vascular total; elas são suas ferramentas de segurança em sangramentos maciços.
- Dissecção Hilar: A técnica de baixar a placa hilar e dissecar as estruturas glissonianas extra-hepáticas é mais segura e oncológica do que a dissecção intraparenquimatosa cega.
- Interdisciplinaridade: A cirurgia moderna não é um ato solitário. Radiologia intervencionista, hepatologia e terapia intensiva são extensões do braço do cirurgião.
Conclusão
O transplante hepático não deve ser visto pelos estudantes e residentes apenas como uma subespecialidade de nicho, mas como a “Universidade da Cirurgia Abdominal”. As lições aprendidas com a preservação de órgãos, a dissecção meticulosa de vasos de calibre milimétrico e o manejo fisiológico do paciente hepatopata elevaram o padrão técnico de toda a cirurgia digestiva. Dominar esses conceitos é o que diferencia o operador técnico do verdadeiro cirurgião cientista.
“A história da medicina é que o que era inconcebível ontem, e apenas alcançável hoje, muitas vezes torna-se rotina amanhã.” — Thomas Starzl (Pioneiro do Transplante Hepático)
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaHepatobiliar #TransplanteHepatico #EducacaoMedica #ResidenciaCirurgia #CirurgiaDigestiva
ASPECTOS MÉDICO-LEGAIS DA LESÃO INADVERTIDA DA VIA BILIAR
- Membro Titular do Colégio Brasileiro de Cirurgiões
- Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
1. Introdução
A lesão inadvertida da via biliar (LVB) é a complicação com maior impacto clínico, emocional e jurídico da colecistectomia. Em muitos países, é uma das principais causas de processos por erro médico em cirurgia geral. Do ponto de vista médico-legal, o ponto central não é a existência da lesão em si, mas a forma como o cirurgião:
- Indicou a cirurgia;
- Conduziu o procedimento (técnica, CVS, bailouts);
- Reconheceu e tratou a lesão;
- Documentou e comunicou o evento ao paciente e à família.
Este texto aborda, em linguagem direta, os principais aspectos médico-legais que o cirurgião geral | cirurgião do aparelho digestivo precisa dominar frente a uma suspeita de lesão iatrogênica da via biliar principal.

2. Lesão de via biliar ≠ erro médico automático
Juridicamente, lesão de via biliar é, em princípio, um evento de risco inerente ao procedimento, sobretudo na colecistectomia laparoscópica, reconhecido em diretrizes nacionais e internacionais.
Em termos de responsabilidade profissional, o que será avaliado é se houve:
- Indicação adequada da cirurgia;
- Técnica compatível com o padrão atual (CVS, uso de bailouts, conversão quando necessário);
- Diligência no reconhecimento precoce da lesão;
- Conduta correta após o dano (referência, reconstrução, suporte);
- Transparência na comunicação.
Ou seja: não é a complicação que gera responsabilidade, e sim a condução inadequada antes, durante ou depois do evento.
3. Consentimento informado
Do ponto de vista pericial, o consentimento é peça-chave:
- A colecistectomia deve ser apresentada como procedimento com:
- Risco de sangramento, infecção, fístula biliar, lesão de via biliar e necessidade de reoperação.
- O termo deve ser:
- Claro, objetivo, datado, assinado pelo paciente (ou responsável) e pela equipe.
- Ideal:
- Anotação no prontuário reforçando que os riscos foram explicados verbalmente.
Em muitos litígios, a ausência de menção à possibilidade de lesão de via biliar no consentimento é usada como argumento de falha na informação, mesmo quando a técnica foi correta.
4. Padrão técnico esperado (CVS, bailouts e conversão)
Peritos costumam avaliar:
- Se houve tentativa documentada de obter o Critical View of Safety;
- Se o cirurgião reconheceu a “vesícula difícil” e utilizou manobras de bailout (subtotal, fundo–primeiro, conversão, abandono);
- Se a insistência em dissecar um triângulo de Calot obliterado foi temerária.
Alguns pontos práticos com peso médico-legal:
- Não obter CVS e mesmo assim clipar e seccionar estruturas é quase sempre visto como conduta imprudente.
- Não converter ou não chamar ajuda em cirurgias claramente difíceis pode ser interpretado como negligência.
- O uso de colangiografia intraoperatória em caso de dúvida anatômica é bem visto pericialmente, mesmo que não obrigatório.
5. Reconhecimento e manejo da lesão intraoperatória
Do ponto de vista jurídico, lesão reconhecida e tratada intraoperatória gera cenário muito mais favorável ao cirurgião do que lesão ignorada e diagnosticada tardiamente com peritonite biliar ou sepse.
Boas práticas com impacto médico-legal:
- Se houver suspeita de lesão maior:
- Registrar no ato operatório que houve dificuldade anatômica e suspeita de dano.
- Se a equipe não tiver expertise em reconstrução, não improvisar; encaminhar para centro de referência.
- Drenos adequados e exames de imagem precoces (TC, colangioRM, CPRE) em pós-operatório duvidoso demonstram diligência.
A omissão em investigar icterícia, febre ou saída de bile por dreno no pós-operatório é frequentemente qualificada como negligência em perícias.
6. Documentação operatória
O relatório cirúrgico é uma das peças centrais em processos médico-legais. Deve conter:
- Indicação da cirurgia (cólica biliar, colecistite aguda, etc.);
- Achados intraoperatórios (inflamação, fibrose, “vesícula difícil”);
- Descrição da técnica:
- Tentativa de obter CVS;
- Uso de colangiografia intraoperatória, quando feita;
- Manobras de bailout, conversão, subtotal, etc.;
- Quaisquer intercorrências (sangramento, suspeita de lesão, necessidade de sutura em via biliar, etc.).
A ausência de descrição detalhada geralmente é interpretada contra o cirurgião, pois abre espaço para a presunção de que padrões técnicos não foram seguidos.
7. Comunicação com o paciente e a família
A forma como o cirurgião comunica a complicação é relevante:
- Negar ou minimizar o evento, ou culpar exclusivamente “o organismo do paciente”, costuma agravar o conflito.
- O recomendado é:
- Explicar com clareza o que ocorreu;
- Deixar claro que a complicação está sendo manejada com todos os recursos disponíveis;
- Documentar o conteúdo da conversa no prontuário.
Transparência e empatia costumam reduzir a judicialização. O oposto também é verdadeiro.
8. Encaminhamento a centros de referência
Outra questão avaliada em perícia é quando e para onde o paciente foi encaminhado:
- Lesões complexas (Strasberg E, perda de segmento biliar, comprometimento vascular) não devem ser reparadas por equipes sem experiência em reconstrução biliodigestiva.
- Reconstruções malsucedidas em série, feitas em hospitais sem expertise, frequentemente são interpretadas como imprudência e imperícia.
O encaminhamento precoce para centro com cirurgião HPB experiente demonstra boa prática e costuma ter peso favorável em eventual demanda judicial.
9. Papel das diretrizes e literatura
Em perícia, é comum a comparação da conduta com:
- Diretrizes societárias (CBCD, WSES, SAGES, EAES etc.);
- Protocolos hospitalares;
- “Estado da arte” à época do procedimento (por exemplo, reconhecimento do CVS como padrão-ouro).
Se o cirurgião seguiu recomendações amplamente aceitas, é difícil sustentar que houve erro grosseiro, mesmo diante de complicação grave.
10. Dano, nexo causal e responsabilidade
Em termos médico-legais, três elementos precisam estar presentes para configurar responsabilidade civil:
- Ato ou omissão culposa (técnica inadequada, falta de diligência, ausência de informação).
- Dano (lesão de via biliar, perda de parte do fígado, invalidez, óbito).
- Nexo causal entre a conduta e o dano.
Exemplo:
– Lesão biliar reconhecida, adequadamente reparada em centro de referência, com boa evolução → pode ser entendida como complicação aceitável.
– Lesão ignorada, sem investigação, evoluindo para sepse e transplante → há forte argumento de falha na assistência.
11. Estratégias de prevenção médico-legal
Em linhas simples:
- Indique bem (indicação precisa e registrada).
- Faça CVS sempre que possível e saiba abandonar a dissecção perigosa.
- Use bailouts (subtotal, fundo–primeiro, conversão) quando necessário; não insista em anatomia impossível.
- Documente tudo (relatório detalhado, fotos/vídeos, evolução diária).
- Investigue sinais de complicação sem demora.
- Encaminhe cedo lesões complexas a centros de referência.
- Comunique com clareza e registre a conversa.
Essas medidas não apenas reduzem o risco de processo, mas principalmente melhoram o cuidado ao paciente, que é o objetivo central.
“O objetivo técnico principal na Colecistectomia, não é a retirada da vesícula biliar, mas proteger a via biliar principal.” Prof. Dr. Ozimo Gama
Hashtags (SEO)
#LesãoDeViaBiliar #ResponsabilidadeMédica #CirurgiaDigestiva #MedicinaLegal #CriticalViewOfSafety
Litíase Biliar Após Cirurgia Bariátrica: Quando e Como Abordar?
Introdução
A litíase biliar é uma complicação frequente após a cirurgia bariátrica, especialmente em procedimentos que resultam em perda ponderal rápida, como o bypass gástrico em Y-de-Roux (RYGB) e a gastrectomia vertical (sleeve). A incidência de formação de cálculos pode atingir 30–40% nos primeiros 12 a 18 meses, com até 15% dos pacientes evoluindo com sintomas ou complicações como colecistite aguda, pancreatite biliar ou coledocolitíase. O manejo adequado depende do tipo de procedimento bariátrico, da anatomia reconstruída e da apresentação clínica.
Mecanismos Fisiopatológicos
A rápida perda de peso induz:
- Supersaturação biliar por colesterol,
- Diminuição da motilidade da vesícula biliar,
- Aumento de mucinas e nucleação,
- Redução da ingesta lipídica estimuladora de contração biliar.
Tais fatores explicam por que a litíase se desenvolve principalmente nos primeiros 6–12 meses pós-operatórios.
Quando Suspeitar e Quando Intervir
1. Paciente assintomático com cálculos
Não há indicação de colecistectomia profilática na maioria dos centros. A conduta é expectante, exceto em casos especiais:
- Cálculos > 1 cm,
- Vesícula completamente preenchida,
- História prévia de pancreatite biliar,
- Paciente com acesso cirúrgico futuro dificultado.
Alguns grupos utilizam ursofalk (ácido ursodesoxicólico) 300–600 mg/dia por 6 meses, capaz de reduzir a incidência de litíase sintomática, sobretudo em RYGB.
2. Paciente sintomático (cólica biliar ou colecistite leve)
A conduta é colecistectomia laparoscópica, idealmente realizada por cirurgião com experiência em pacientes pós-bariátricos, que apresentam:
- Adhesões frequentes,
- Alterações anatômicas de troca de porta,
- Maior fragilidade tecidual.
3. Colecistite aguda moderada/grave
Seguir o protocolo de Tokyo Guidelines:
- Antibióticos,
- Colecistectomia de urgência se possível,
- Drenagem percutânea em casos selecionados.
4. Pancreatite biliar
Após estabilização clínica, realizar colecistectomia.
O timing depende do tipo de bariátrica:
- Sleeve: anatomia normal → colecistectomia na mesma internação.
- Bypass gástrico: alta chance de coledocolitíase → investigar colédoco antes de operar.
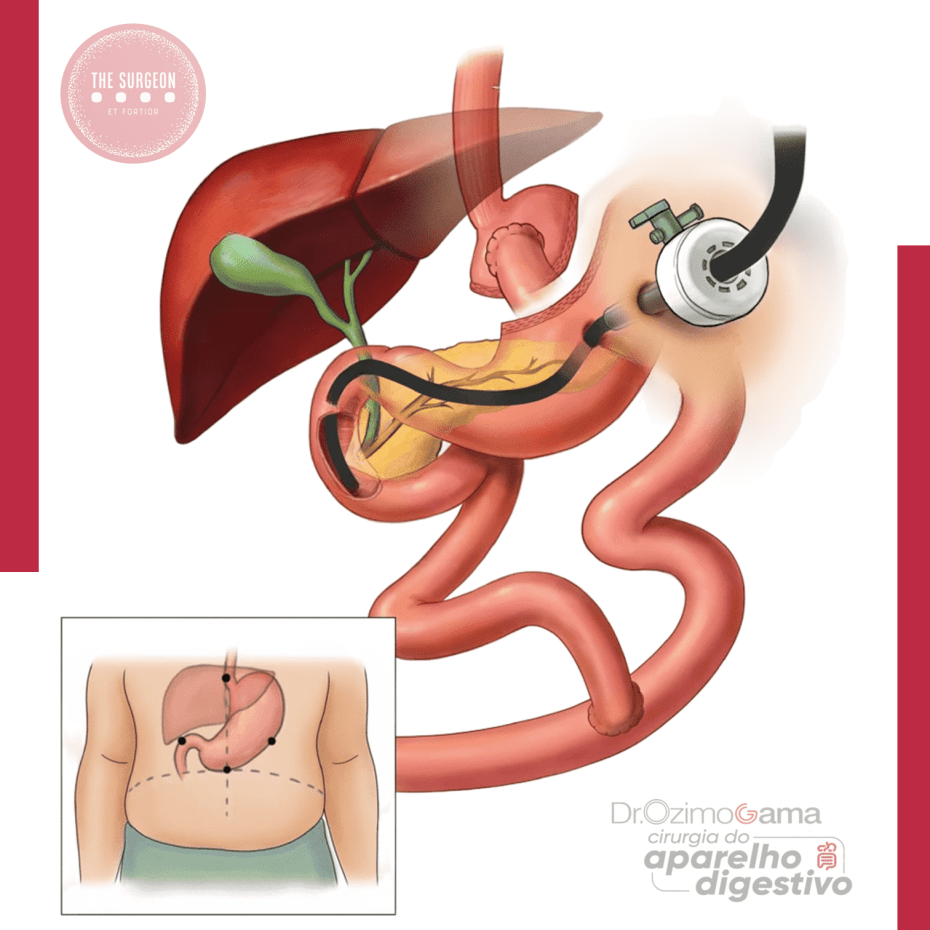
Coledocolitíase no Paciente Bariátrico: Como Abordar?
A abordagem depende profundamente da anatomia pós-cirúrgica:
A. Gastrectomia Vertical (Sleeve)
Anatomia do duodeno e papila mantida.
→ CPRE convencional possível.
Tratamento padrão:
- CPRE diagnóstica + terapêutica,
- Esfincterotomia,
- Balão/ Basket,
- Colecistectomia subsequente.
B. Bypass Gástrico em Y-de-Roux (RYGB)
É o cenário mais desafiador. O acesso à papila é bloqueado pela alça alimentar.
Opções:
- CPRE por enteroscopia de duplo balão
- Técnica exigente, limitada a centros avançados.
- Sucesso ~70%.
- CPRE transgástrica laparoscópica
- A via mais resolutiva em muitos centros.
- Procedimento combinado: laparoscopia cria gastrotomia no estômago excluído → endoscopista acessa a papila.
- Alta taxa de sucesso > 95%.
- CPRE guiada por EUS (EDGE)
- Criação de uma fístula temporária entre o pouch e o estômago excluído usando LAMS.
- Opção moderna e altamente eficaz.
- Exige endoscopista avançado.
- Exploração cirúrgica da via biliar
- Via transcística ou coledocotomia laparoscópica, quando experiência disponível.
Quando Operar Antes da Bariátrica?
Indicações de colecistectomia prévia:
- Cálculos sintomáticos,
- Cálculos > 1,5 cm,
- Vesícula em porcelana,
- Pólipos > 1 cm,
- Suspeita de malignidade,
- História prévia de pancreatite biliar.
Para pacientes assintomáticos, a tendência atual é não operar previamente, exceto quando o acesso futuro pode ser especialmente difícil (superobesidade com grande parede abdominal ou barreira logística).
Pontos-Chave
- A litíase biliar é comum após cirurgia bariátrica (30–40%).
- Colecistectomia profilática não é indicada rotineiramente.
- A abordagem depende do tipo de cirurgia:
- Sleeve → CPRE convencional possível.
- Bypass → técnicas avançadas (enteroscopia, EDGE, CPRE transgástrica).
- O tratamento deve ser individualizado e multidisciplinar.
- A cirurgia bariátrica exige planejamento prévio quanto ao risco de litíase.
Conclusão
A litíase biliar no pós-operatório de cirurgia bariátrica não é apenas frequente, mas também clinicamente relevante, podendo gerar quadros graves como pancreatite e colangite. O sucesso do manejo está em reconhecer o tipo de reconstrução do trato gastrointestinal, antecipar dificuldades técnicas e atuar com abordagem multidisciplinar envolvendo cirurgião bariátrico, cirurgião hepatobiliar e endoscopista avançado.
“A cirurgia moderna exige não apenas técnica, mas estratégia.” — Adaptado de Halsted
Transplante Hepático na Insuficiência Hepática Aguda
Critérios, Sobrevida e Complicações
Introdução
A insuficiência hepática aguda (IHA) é uma condição rara, mas potencialmente fatal, caracterizada pela instalação rápida de disfunção hepática em pacientes previamente hígidos, acompanhada de coagulopatia e encefalopatia. Sem tratamento definitivo, a mortalidade ultrapassa 80% em muitos cenários. O transplante hepático é a única terapia curativa em casos graves, sendo fundamental identificar precocemente quais pacientes se beneficiam da cirurgia. Para isso, critérios clínicos e laboratoriais foram desenvolvidos e validados, destacando-se os de King’s College e Clichy, além de ferramentas modernas como o MELD score.
Critérios Prognósticos
- King’s College Criteria: o mais utilizado mundialmente, com alta especificidade. Diferencia critérios para intoxicação por paracetamol e demais etiologias.
- Critérios de Clichy: aplicados sobretudo em hepatite fulminante viral, baseados na dosagem do fator V associado à encefalopatia.
- MELD score: escore inicialmente criado para hepatopatia crônica, mas útil também em IHA; valores ≥ 30 associam-se a prognóstico ruim.
Sobrevida e Complicações Pós-Transplante
- Sobrevida:
- 1 ano: 65–80%
- 5 anos: 55–70%
- Melhor prognóstico em intoxicação por paracetamol, pior em hepatite fulminante viral e drogas idiossincráticas.
- Complicações:
- Infecções (até 40%)
- Disfunção primária do enxerto (10–15%)
- Trombose da artéria hepática (~5%)
- Complicações biliares (10–20%)
Apesar da maior mortalidade precoce, pacientes que superam o período inicial apresentam sobrevida comparável aos transplantados por doença crônica.
Tabela Comparativa dos Principais Critérios e Resultados
| Critério / Indicador | Definição / Parâmetro | Aplicação | Sobrevida Pós-TH (1 ano / 5 anos) | Principais Complicações |
|---|---|---|---|---|
| King’s College (Paracetamol) | pH < 7,30 OU INR > 6,5 + Cr > 3,4 + encefalopatia III–IV | Mais utilizado mundialmente | 65–80% / 55–70% | Infecção, disfunção precoce do enxerto |
| King’s College (Outras causas) | INR > 6,5 OU ≥ 3 critérios (idade, etiologia, intervalo, INR, bilirrubina) | Prognóstico em IHA não-paracetamol | 65–75% / 55–65% | Infecção, complicações biliares |
| Clichy | Encefalopatia + Fator V < 20% (<30 anos) ou < 30% (>30 anos) | Mais usado em hepatite fulminante viral | 60–70% / 50–60% | Disfunção primária do enxerto |
| MELD ≥ 30 | Escore baseado em INR, bilirrubina e creatinina | Complementar à decisão | Variável conforme etiologia | Complicações infecciosas e vasculares |
Conclusão
O transplante hepático é a única alternativa eficaz para pacientes com IHA sem perspectiva de regeneração espontânea. A aplicação correta dos critérios de King’s College e Clichy, associada ao uso de escores como o MELD, permite identificar precocemente os candidatos ideais. Apesar da maior taxa de complicações infecciosas e disfunção do enxerto no pós-operatório imediato, os resultados a longo prazo são satisfatórios, com sobrevida em 5 anos alcançando 70% em centros especializados. A decisão deve sempre ser multidisciplinar, precoce e baseada em critérios clínico-laboratoriais, maximizando as chances de sucesso.
“A oportunidade de indicar o transplante não se repete: reconhecer o momento certo é o maior desafio do hepatologista e do cirurgião.” — Adaptado de Roger Williams
Gostou ❔ Deixe seu comentário ✍️, compartilhe em suas redes sociais ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#TransplanteHepático #InsuficiênciaHepáticaAguda #Hepatologia #CirurgiaHepatobiliar #EducaçãoMédicaContinuada
Colecistostomia: Indicações e Resultados na Prática Cirúrgica
Introdução
A colecistostomia é um procedimento fundamental no arsenal terapêutico para o manejo da colecistite aguda em pacientes de alto risco cirúrgico. Enquanto a colecistectomia laparoscópica permanece como tratamento definitivo, a colecistostomia surge como uma alternativa segura, minimamente invasiva e eficaz, especialmente em pacientes com comorbidades significativas ou contraindicações à anestesia geral.
No Brasil, onde o acesso à saúde ainda enfrenta desafios estruturais, a colecistostomia percutânea tem ganhado espaço como opção terapêutica em hospitais públicos e privados. Estudos locais destacam sua aplicação em pacientes idosos, portadores de doenças cardiovasculares avançadas ou em uso de anticoagulantes, perfis frequentes em nossa população.
Este artigo abordará as indicações, técnicas, complicações e resultados da colecistostomia, com foco na prática do cirurgião do aparelho digestivo.
Indicações da Colecistostomia
A colecistostomia é indicada principalmente em:
- Colecistite aguda refratária ao tratamento clínico em pacientes com alto risco cirúrgico (ASA ≥ III).
- Pacientes com distúrbios de coagulação (em uso de anticoagulantes ou com cirrose hepática).
- Colecistite acalculosa em pacientes críticos (ex.: internados em UTI).
- Gestantes no terceiro trimestre com colecistite aguda.
- Obstrução biliar em pacientes inaptos para CPRE.
Segundo as Diretrizes de Tóquio (TG13), a colecistostomia é recomendada para colecistite moderada (grau II) ou grave (grau III) não responsiva a antibioticoterapia. No Brasil, dados do Colégio Brasileiro de Cirurgiões apontam que até cerca de 5% dos casos de colecistite aguda podem ser tratados inicialmente com colecistostomia, especialmente em hospitais de referência.
Técnicas de Colecistostomia
- Percutânea (Guiada por US/TC):
- Via transhepática (preferencial para reduzir vazamento biliar).
- Via transperitoneal (menos utilizada devido a maior risco de complicações).
- Técnica de Seldinger ou trocarte direto.
- Laparoscópica:
- Opção quando a colecistectomia é inicialmente planejada, mas abortada devido a inflamação intensa.
- Cirúrgica Aberta:
- Reservada para falha das técnicas minimamente invasivas.
Aplicação na Cirurgia Digestiva
A colecistostomia tem papel crucial no manejo escalonado da colecistite aguda:
- Fase aguda: Alívio da sepse biliar.
- Fase definitiva: Decisão entre remoção do cateter ou colecistectomia tardia.
Estudos brasileiros demonstram que 30-40% dos pacientes submetidos à colecistostomia evoluem para colecistectomia eletiva, enquanto os demais mantêm o cateter como tratamento definitivo, principalmente idosos e pacientes com comorbidades graves.
Pontos-Chave para o Cirurgião Digestivo
- Seleção adequada do paciente é fundamental para evitar complicações.
- Via transhepática reduz vazamento biliar e deslocamento do cateter.
- Antibioticoterapia pré e pós-procedimento é essencial para evitar sepse.
- Remoção do cateter após 4-6 semanas (avaliar maturação do trajeto fistuloso).
- Monitorar complicações:
- Deslocamento do cateter (27%).
- Vazamento biliar (3-6%).
- Abscesso peri-hepático (9%).
Conclusões Aplicadas à Prática
A colecistostomia é uma ferramenta valiosa no tratamento da colecistite aguda em pacientes de alto risco. No cenário brasileiro, onde a população envelhecida e as comorbidades cardiovasculares são prevalentes, seu uso deve ser considerado de forma individualizada.
Embora a colecistectomia laparoscópica permaneça como padrão-ouro, a colecistostomia oferece uma alternativa segura e eficaz, reduzindo mortalidade e tempo de internação. Futuros estudos prospectivos, como o CHOCOLATE trial, trouxeram mais evidências sobre seu papel definitivo.
“A cirurgia é a arte de salvar vidas, mas também de saber quando não operar.” — William Stewart Halsted
Gostou? ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Colecistostomia #CirurgiaDigestiva #ColecistiteAguda #MedicinaCirúrgica #ResidênciaMédica
Câncer Incidental da Vesícula Biliar após Colecistectomia Laparoscópica: Diagnóstico e Conduta Cirúrgica
Introdução
O câncer de vesícula biliar é a neoplasia maligna mais comum do trato biliar e o quinto tumor mais frequente do trato gastrointestinal. Apesar disso, apresenta baixa incidência global — cerca de 3 casos por 100.000 habitantes/ano nos EUA — e geralmente é diagnosticado em estágios avançados, com taxa de ressecabilidade de apenas 25% e sobrevida média de 3 a 11 meses. O cenário muda quando a doença é detectada precocemente, especialmente nos casos de câncer incidental da vesícula biliar (IGBC), diagnosticado após colecistectomia laparoscópica (LC) realizada por outra indicação. O IGBC ocorre em 0,3–2% das LC e representa cerca de dois terços dos casos potencialmente curáveis.
Epidemiologia e Relevância Clínica
- Incidência: 0,3–2% das colecistectomias laparoscópicas.
- Impacto prognóstico: sobrevida de 5 anos pode atingir 92–100% nos estágios iniciais (T1a).
- Risco de disseminação: perfuração vesicular e derrame biliar intraoperatório elevam o risco de recidiva peritoneal e em portais (até 40%).
Diagnóstico Pós-Operatório
Quando o câncer é detectado no exame histopatológico após a colecistectomia, o primeiro passo é:
- Revisar o laudo histológico — confirmando profundidade de invasão (T) e status da margem do ducto cístico.
- Estadiamento por imagem — geralmente com tomografia computadorizada (TC) de tórax, abdome e pelve, podendo ser complementada por ressonância magnética (RM/MRCP).
- Avaliar presença de doença irressecável — até 20% dos pacientes candidatos à reoperação apresentam doença avançada na reexploração.
Conduta por Estadiamento T
- Tis / T1a
- LC isolada é curativa se não houve perfuração vesicular nem extravasamento biliar.
- Metástases linfonodais ocorrem em apenas 2% dos casos.
- T1b / T2
- Indicam re-resecção radical, incluindo:
- Reseção não anatômica de segmentos hepáticos 4b e 5 (margem ≥ 2–3 cm).
- Linfadenectomia do ligamento hepatoduodenal.
- Avaliação da margem do ducto cístico; se positiva, ampliar ressecção.
- Sobrevida de 5 anos: 60–100% (T1b) e 54–100% (T2).
- Indicam re-resecção radical, incluindo:
- T3 / T4
- Ressecção curativa apenas se R0 possível.
- Sobrevida de 5 anos em doença nodal negativa: até 77%.
- Em linfonodos positivos além do hepatoduodenal: prognóstico extremamente reservado (<1%).
Suspeita Intraoperatória
Fatores que devem acender o alerta:
- Vesícula endurecida e espessada.
- Infiltração hepática.
- Paciente com mais de 60 anos, especialmente com quadro de empiêma vesicular.
- Achados de imagem pré-operatória: espessamento focal ou difuso da parede, linfonodomegalias, vesícula pouco distendida.
Conduta recomendada:
- Se possível, interromper a cirurgia e encaminhar para estadiamento completo antes de definir tratamento definitivo.
- Evitar biópsia intraoperatória devido a risco de erro amostral e disseminação.
- Em casos de alta suspeita e condições clínicas favoráveis, realizar colecistectomia radical imediata.
Técnica da Re-Ressecção Radical
- Abordagem convencionalmente aberta (há relatos laparoscópicos e robóticos).
- Ressecção hepática (segmentos 4b e 5).
- Linfadenectomia hepatoduodenal.
- Ressecção do ducto cístico ± hepático comum se margem comprometida.
- Não há benefício comprovado na ressecção sistemática dos portais de entrada da laparoscopia.
Pontos-Chave para o Cirurgião Digestivo
- Sempre encaminhar espécimes de colecistectomia para exame histopatológico.
- Documentar integridade da vesícula e ausência de extravasamento biliar.
- Em IGBC T1b ou superior, a re-resecção precoce oferece ganho substancial de sobrevida.
- Envolver equipe de cirurgia hepatobiliar e oncologia desde o início.
- RO (ressecção com margem livre) é o fator mais importante para prognóstico.
Conclusão Aplicada
O IGBC representa uma oportunidade única de diagnóstico precoce de um tumor tipicamente letal. A conduta correta, baseada no estadiamento, pode transformar um achado acidental em um caso curável. A chave está em:
- Reconhecimento imediato do risco.
- Estadiamento preciso.
- Tratamento radical oportuno.
“O cirurgião deve ter a coragem de parar quando é cedo demais e a ousadia de agir quando ainda é tempo.” — Halsted
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CâncerDeVesícula #Colecistectomia #CirurgiaHepatobiliar #OncologiaCirúrgica #EducaçãoMédicaContinuada
Colecistectomia Laparoscópica em Pacientes Cirróticos: Estratégias, Truques e Cuidados Especiais
Introdução
A prevalência de colelitíase em pacientes com cirrose é significativamente maior que na população geral, atingindo quase um terço desses indivíduos. Em cerca de 80% dos casos, os cálculos são assintomáticos; no restante, manifestam-se como cólica biliar, colecistite ou icterícia obstrutiva. Apesar de a colecistectomia laparoscópica ser considerada padrão-ouro no tratamento da colelitíase sintomática, a presença de cirrose impõe desafios técnicos e riscos adicionais, como maior propensão a sangramento, infecção e insuficiência hepática pós-operatória. Em pacientes com Child-Pugh A ou B, a laparoscopia é segura quando realizada por equipes experientes e em centros com suporte especializado. Já na classe C, o risco é proibitivo, sendo preferível manejo não cirúrgico ou encaminhamento para avaliação de transplante hepático.
Avaliação Pré-Operatória e Estratificação de Risco
A decisão cirúrgica deve considerar:
- Classificação de Child-Pugh: risco de mortalidade de 10% (A), 30% (B) e até 80% (C) em cirurgias não hepáticas.
- MELD score: preditor acurado de mortalidade; acima de 25, a mortalidade em 90 dias pode chegar a 90%.
- Presença de hipertensão portal: aumenta risco de sangramento e dificulta a dissecção.
- Comorbidades associadas: insuficiência renal, cardiopatia e doença pulmonar podem agravar prognóstico.
Exames complementares recomendados incluem doppler hepático para avaliação vascular, tomografia ou ressonância contrastada para análise anatômica e rastreio de neoplasias associadas.
Indicações e Momentos da Cirurgia
- Colelitíase sintomática em Child A ou B, sem colecistite aguda grave, é indicação para colecistectomia laparoscópica.
- Colecistite aguda: pode-se optar por tratamento inicial não operatório (antibioticoterapia, drenagem percutânea ou stent transpapilar) e cirurgia eletiva tardia.
- Achado incidental de cirrose durante colecistectomia: considerar abortar procedimento e encaminhar para avaliação multidisciplinar, exceto se quadro for emergencial.
Truques e Estratégias Intraoperatórias
1. Acesso e posicionamento
- Uso preferencial da técnica aberta (Hasson) para o primeiro trocárter, evitando lesão da veia umbilical recanalizada.
- Colocação do porto de trabalho no quadrante superior esquerdo, para reduzir risco de sangramento da parede abdominal.
- Documentar grau de cirrose e hipertensão portal com fotos intraoperatórias.
2. Dissecção e controle vascular
- Expectativa de aderências neovascularizadas; dissecção com Harmonic® ou Ligasure™ reduz sangramento.
- No Calot difícil devido a colaterais, considerar colecistectomia parcial: deixar parte da parede vesicular aderida ao fígado, com cauterização da mucosa para prevenir mucocele.
- Em situações críticas, usar clipes Hem-o-lok®, Endoloop® ou sutura intracorpórea no coto cístico, preferindo ligadura segura antes da secção.
3. Estratégias alternativas
- Abordagem fundus-first pode ser útil, mas requer atenção para não lesar ducto biliar.
- Conversão para cirurgia aberta deve ser encarada como decisão de segurança, e não falha técnica.
4. Controle de sangramento
- Ter à disposição argon beam coagulator, hemostáticos tópicos e instrumentos de cirurgia aberta.
- Monitorar constantemente o campo cirúrgico; portos devem ser removidos sob visão direta.
Cuidados Pós-Operatórios
- Evitar sobrecarga hídrica para prevenir ascite e complicações respiratórias.
- Monitorar função renal e eletrólitos; hiponatremia é frequente.
- Utilizar albumina e dieta hipossódica conforme orientação hepatológica.
- Vigilância para complicações como sangramento, vazamento biliar e encefalopatia hepática.
Conclusão
A colecistectomia laparoscópica em pacientes cirróticos não é uma contraindicação absoluta, mas exige seleção criteriosa, preparo pré-operatório rigoroso e técnica cirúrgica refinada. Pacientes Child-Pugh A ou B, operados por equipes experientes em centros terciários, apresentam resultados seguros e comparáveis à população geral em termos de mortalidade. O conhecimento de truques técnicos, manejo de complicações e decisão sobre momento ideal da cirurgia são determinantes para o sucesso.
“O bom cirurgião sabe o que pode fazer; o excelente sabe o que deve fazer.” — Halsted
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#ColecistectomiaLaparoscopica #CirroseHepatica #CirurgiaHepatobiliar #LaparoscopiaAvançada #EducaçãoMédicaContinuada
Apendicectomia Laparoscópica: Truques e Dicas para uma Execução Segura e Eficiente
Introdução
A apendicectomia laparoscópica consolidou-se como o padrão-ouro no tratamento da apendicite aguda, sobretudo em centros com acesso à tecnologia minimamente invasiva. Com benefícios amplamente documentados — como menor dor pós-operatória, redução do tempo de internação e menor incidência de infecção de ferida —, a técnica exige, contudo, treinamento e atenção a detalhes técnicos. Este artigo oferece truques e dicas práticas que podem otimizar a performance do cirurgião, reduzir complicações e melhorar a curva de aprendizado da equipe assistente.
1. Posicionamento do Paciente e da Equipe
- Decúbito dorsal com leve Trendelenburg e rotação à esquerda facilita a exposição do quadrante inferior direito.
- Fixe o braço direito do paciente ao corpo para permitir amplo espaço de movimentação do cirurgião.
- Cirurgião à esquerda do paciente, assistente ao lado da perna esquerda, monitor preferencialmente à direita ou à cabeceira, na linha dos ombros.
Dica: Ajuste fino da inclinação da mesa pode ser decisivo para deslocar alças e expor o ceco sem necessidade de manobras agressivas.
2. Posicionamento dos Trocárteres
- Um padrão eficiente inclui:
- Trocárter de 10 mm umbilical (ótica).
- Trocárter de 5 mm em hipogástrio (instrumentação dominante).
- Trocárter de 5 mm em flanco esquerdo (tração e dissecção).
Truque: Em pacientes obesos, insira o trocárter ótico com cuidado em ângulo oblíquo para evitar desinserção do pneumoperitônio e garantir estabilidade.
3. Estratégias de Exposição
- Identifique o teniae coli do ceco e siga até a base do apêndice.
- Use pinça atraumática para tração superior do apêndice, expondo sua base.
- Em casos de aderências, libere-as com energia monopolar delicada ou tesoura, evitando avulsões inadvertidas.
Dica de ouro: Evite “lutar” contra aderências retrocecais. Mude o plano, reposicione a câmera, varie o ângulo de dissecção. Tempo gasto com exposição segura evita complicações graves.
4. Controle do Pedículo e Secção Apendicular
- O método mais utilizado é o uso de duas ligaduras com endoloop ou clips poliméricos (Hem-o-lok®), seguido de secção entre eles.
- Alternativamente, grampeadores laparoscópicos podem ser usados, especialmente em apêndices friáveis ou bases espessadas.
Truque técnico: Em apêndices muito inflamados, realize a ligadura mais distal antes da proximal, para reduzir o risco de ruptura ou vazamento ao manipular a base.
5. Retirada e Proteção da Cavidade
- Retire o apêndice com saco cirúrgico sempre que possível, evitando contaminação do trajeto do trocárter.
- Irrigue abundantemente a loja apendicular se houver peritonite localizada ou pus livre.
- Se necessário, coloque dreno tubular por 24 a 48 horas.
Dica prática: Em caso de dúvida quanto à integridade da base, deixe um fragmento do ceco visível e documente o aspecto final com imagem.
6. Situações Especiais
- Apêndice retrocecal: requer liberação ampla da reflexão lateral direita do cólon.
- Apendicite perfurada com abscesso: considere drenagem inicial guiada por imagem e apendicectomia em intervalo.
- Apendicite gestacional: ideal até o segundo trimestre. Atenção ao deslocamento anatômico do apêndice.
Truque anatômico: Em gestantes ou crianças, a mobilidade intestinal pode mascarar a localização clássica. Reforce a busca sistemática do apêndice pela convergência das teníases do ceco.
Conclusão
A apendicectomia laparoscópica é uma cirurgia segura, eficaz e que continua evoluindo com a incorporação de técnicas assistidas por imagem, navegação e inteligência artificial. No entanto, sua execução requer atenção a detalhes aparentemente simples, que fazem toda a diferença nos desfechos clínicos. O domínio dos truques e dicas técnicas aqui apresentados contribui significativamente para uma prática cirúrgica mais segura, eficiente e baseada em excelência técnica.
“A simplicidade técnica não dispensa o rigor; é justamente na cirurgia simples que se exige a perfeição.” — René Leriche
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Íleo Adinâmico e Íleo Pós-Operatório: Compreensão Atual e Aplicações na Cirurgia Digestiva
Introdução
A motilidade intestinal no pós-operatório abdominal é uma área frequentemente mal compreendida, apesar de sua importância clínica. Termos como íleo pós-operatório (POI, do inglês postoperative ileus) e íleo adinâmico são frequentemente utilizados de forma intercambiável, mas representam entidades fisiopatológicas distintas. Compreender suas diferenças é crucial para a conduta apropriada e para evitar intervenções desnecessárias. Neste artigo, abordamos as bases fisiológicas e clínicas dessas condições, diferenciando-as de forma clara, com foco na prática da cirurgia digestiva.
Íleo Pós-Operatório (POI)
O POI é uma resposta fisiológica previsível que acomete predominantemente o estômago e o cólon nas primeiras 24 a 96 horas após uma laparotomia. Ao contrário da crença comum, o íleo verdadeiro do intestino delgado é raro nesse contexto. Estudos intraoperatórios demonstram que o intestino delgado mantém atividade contrátil mesmo durante o procedimento, enquanto o estômago e o cólon mostram inatividade motora, mesmo com estímulos.
A ausência de ruídos hidroaéreos típicos do POI deve-se, sobretudo, à falta de progressão do gás deglutido, não a uma ausência de motilidade intestinal. O mito de que a manipulação extensa do intestino delgado prolonga o POI foi desmentido por estudos experimentais, sugerindo que o trauma da parede abdominal e o uso de opioides são os principais fatores desencadeantes.
Com o avanço das técnicas minimamente invasivas e dos protocolos de recuperação precoce (ERAS), o impacto clínico do POI tornou-se cada vez menos relevante, sobretudo após cirurgias laparoscópicas, como a colectomia laparoscópica ou a gastrectomia subtotal com reconstrução em Y-de-Roux.
Íleo Adinâmico
O íleo adinâmico verdadeiro é uma condição patológica e generalizada, com bloqueio da motilidade em todo o trato gastrointestinal: estômago, intestino delgado e cólon. Trata-se de uma disfunção neuromuscular reflexa secundária, frequentemente associada a quadros sistêmicos como sepse, trauma retroperitoneal, hematomas ou cirurgias retroperitoneais (ex: transplante renal). Essas condições interferem na inervação autonômica visceral, levando à inatividade motora intestinal completa.
Clinicamente, manifesta-se com distensão abdominal, náuseas, vômitos, obstipação completa (fezes e flatos) e achados radiológicos de distensão gástrica, de delgado e cólon. Diferente da obstrução mecânica, a dor cólica é incomum. O diagnóstico é clínico e radiológico, sendo essencial excluir causas obstrutivas distais, como neoplasias retais (por proctoscopia ou enema opaco).
O tratamento é conservador e de suporte, com correção do fator causal subjacente (geralmente sepse). A introdução de pró-cinéticos ou intervenções cirúrgicas raramente se justifica e pode ser prejudicial.
Aplicação na Cirurgia Digestiva
Na cirurgia digestiva, o conhecimento detalhado desses fenômenos tem implicações práticas relevantes:
- A retomada precoce da dieta por sonda jejunal ou via oral, mesmo após grandes ressecções, é segura e desejável, uma vez que o intestino delgado se mantém funcional no pós-operatório imediato.
- O uso criterioso de opioides deve ser avaliado, já que retarda a motilidade gástrica e colônica e prolonga o POI.
- Cirurgias minimamente invasivas devem ser priorizadas sempre que possível, devido à menor resposta inflamatória e menor impacto na motilidade intestinal.
- Reconhecer o íleo adinâmico é essencial para evitar reoperações desnecessárias, já que o problema é sistêmico e autolimitado com a resolução da causa de base.
Pontos-Chave
- POI é uma resposta fisiológica transitória que acomete estômago e cólon, e não o intestino delgado.
- O íleo adinâmico é uma condição patológica que afeta todo o tubo digestivo, geralmente por causas sistêmicas ou retroperitoneais.
- Manipulação do intestino delgado não prolonga o POI — o trauma parietal e o uso de opioides são mais determinantes.
- A abordagem laparoscópica e os protocolos ERAS diminuem drasticamente a incidência e a gravidade do POI.
- O tratamento do íleo adinâmico é conservador e depende da resolução da causa sistêmica subjacente.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
Para o cirurgião do aparelho digestivo, distinguir entre POI e íleo adinâmico é essencial para um manejo racional e eficaz. A compreensão das bases fisiológicas permite evitar exames desnecessários, intervenções precipitadas e retardos no cuidado. Além disso, reforça a importância das estratégias modernas de recuperação precoce, da analgesia multimodal sem opioides, e da valorização das vias de acesso minimamente invasivas. Saber esperar e não intervir é, por vezes, o ato mais sofisticado da prática cirúrgica.
“Conhecer o tempo certo de não operar é tão vital quanto saber quando operar.” — William Stewart Halsted
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#IleoPosOperatorio #CirurgiaDigestiva #IleoAdinamico #ERASprotocol #Laparoscopia
KYOTO IPMN GUIDELINES 2024
Introdução
A neoplasia mucinoso papilar intraductal do pâncreas (IPMN) representa um dos principais desafios no diagnóstico e manejo das lesões císticas pancreáticas. Com o avanço das técnicas diagnósticas e uma compreensão mais profunda da progressão dessas lesões, o Protocolo de Kyoto 2024 trouxe diretrizes atualizadas e baseadas em evidências para orientar a conduta cirúrgica. Este artigo tem como objetivo esclarecer os principais pontos das novas recomendações, abordando sua aplicação na prática do cirurgião do aparelho digestivo.
Classificação e Critérios de Risco
Os IPMNs são classificados em tipo ducto principal (MD-IPMN), tipo ducto secundário (BD-IPMN) e tipo misto (MT-IPMN). Os novos critérios de risco do Protocolo de Kyoto 2024 incluem:
- Estigmas de alto risco (HRS): icterícia obstrutiva, nódulo mural ≥5 mm, dilatação do ducto pancreático principal ≥10 mm e citologia suspeita ou positiva.
- Características preocupantes (WF): crescimento acelerado (>2,5 mm/ano), cistos >30 mm, nódulos murais <5 mm, espessamento da parede cística, entre outros.
O reconhecimento desses fatores é essencial para a decisão cirúrgica, diferenciando lesões de baixo risco daquelas que podem evoluir para displasia de alto grau ou carcinoma invasivo.
Indicação Cirúrgica
O Protocolo de Kyoto 2024 reforça a necessidade de uma abordagem personalizada, considerando o estado clínico do paciente, as condições anatômicas e a presença de comorbidades. As principais indicações cirúrgicas incluem:
- IPMNs do ducto principal devido ao alto risco de malignização.
- IPMNs do ducto secundário com estigmas de alto risco.
- IPMNs mistos com crescimento progressivo ou sintomatologia associada.
A decisão entre pancreatectomia parcial ou total depende da extensão da lesão e da histologia intraoperatória.
Aplicação na Cirurgia Digestiva
O manejo cirúrgico do IPMN deve seguir princípios oncológicos rigorosos, evitando pancreatectomias excessivas e preservando a função endócrina e exócrina do órgão. Algumas das principais estratégias incluem:
- Ressecção com margens negativas: intraoperatório, a análise histológica por congelação é essencial para guiar a extensão da ressecção.
- Pancreatectomia minimamente invasiva: avanços na laparoscopia e cirurgia robótica permitiram ressecções mais seguras e menos invasivas.
- Monitoramento pós-operatório: mesmo após a ressecção completa, a vigilância é recomendada devido ao risco de neoplasia residual ou carcinoma concomitante.
Estatísticas Relevantes
No Brasil, o câncer de pâncreas representa cerca de 2% de todos os tumores malignos, mas com alta letalidade. Estima-se que cerca de 10-15% dos casos de adenocarcinoma pancreático estejam associados a IPMNs. O aprimoramento das diretrizes pode impactar diretamente na detecção precoce e na sobrevida dos pacientes.
Pontos-chave
- O Protocolo de Kyoto 2024 reformulou a abordagem ao IPMN, priorizando critérios objetivos para indicação cirúrgica.
- O uso de nomogramas e avanços em EUS-FNA ampliaram a precisão diagnóstica.
- Critérios de descontinuidade de vigilância foram estabelecidos para pacientes com IPMNs pequenos e estáveis.
- O risco de PDAC concomitante exige monitoramento a longo prazo mesmo em lesões consideradas indolentes.
Conclusão
O manejo do IPMN requer uma abordagem multidisciplinar e individualizada. As novas diretrizes do Protocolo de Kyoto 2024 promovem um melhor refinamento na seleção de pacientes para cirurgia, minimizando riscos e otimizando resultados. Para o cirurgião digestivo, a compreensão detalhada dessas recomendações é essencial para um tratamento eficaz e baseado em evidências.
Citação Final
“A cirurgia pancreática não é apenas uma questão de técnica, mas de planejamento preciso, trabalho em equipe e respeito à biologia do tumor.” – Markus W. Büchler
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #IPMN #Pancreatologia #ProtocoloKyoto2024 #EducaçãoMédica
Qual a função do Apêndice Vermiforme?
Aspectos Morfofuncionais para a Prática Cirúrgica no Tratamento das Doenças do Aparelho Digestivo
Introdução
O apêndice vermiforme, um pequeno órgão tubular que se projeta da porção inicial do cólon, é frequentemente considerado um vestígio evolutivo de nossa anatomia. Por muitos anos, o apêndice foi visto como uma estrutura funcionalmente irrelevante, com muitos cientistas acreditando que ele não desempenhava papel significativo no organismo humano. No entanto, pesquisas recentes sugerem que o apêndice pode ter funções morfofuncionais importantes, especialmente relacionadas ao microbioma intestinal, à imunidade e à proteção contra infecções intestinais. Este texto visa revisar os aspectos morfofuncionais do apêndice vermiforme, abordando sua relevância clínica e as implicações para a cirurgia do aparelho digestivo, com ênfase nas considerações cirúrgicas que impactam a saúde intestinal dos pacientes.
Desenvolvimento
Estrutura Morfológica do Apêndice
O apêndice vermiforme é uma pequena projeção tubular que se conecta ao ceco, parte inicial do cólon. Em termos de estrutura, é caracterizado por uma extremidade distal fechada e uma mucosa rica em tecido linfático. A morfologia do apêndice pode variar consideravelmente entre as espécies, o que reflete uma adaptação evolutiva. Embora sua forma e tamanho sejam semelhantes nos humanos, a função dessa estrutura evoluiu de maneira distinta em diferentes mamíferos, sugerindo que o apêndice tem um papel importante na sobrevivência de várias espécies. Em humanos, o apêndice contém uma rica rede de células do sistema imune, como as células M, responsáveis por capturar patógenos e apresentar antígenos às células T. Essa função imunológica sugere que o apêndice pode atuar como um “campo de treinamento” para o sistema imunológico, fortalecendo a defesa contra agentes patogênicos.
Funções Funcionais: Microbioma e Imunidade
Recentes estudos indicam que o apêndice tem um papel essencial na manutenção da saúde intestinal e na proteção contra doenças. Uma das principais funções atribuídas ao apêndice é seu envolvimento na preservação da flora bacteriana intestinal benéfica. O apêndice serve como um “refúgio” para essas bactérias, permitindo que elas sobrevivam durante episódios de diarreia ou outras condições que comprometem o microbioma intestinal. Acredita-se que, após uma infecção gastrointestinal, as bactérias benéficas podem repovoar o cólon a partir do apêndice, ajudando a restaurar o equilíbrio microbiano.
Em estudos realizados com primatas, observou-se que os animais com apêndice intacto apresentavam menor incidência de diarreia grave em comparação com os que haviam passado por apendicectomia. Além disso, a remoção do apêndice foi associada a um aumento no risco de infecções graves, como infecções por Salmonella não tifoide, o que reforça a ideia de que o apêndice tem um papel imunológico crucial.
Outro aspecto importante do apêndice é sua contribuição para a resposta imune. As células M, encontradas em grande número na mucosa do apêndice, desempenham papel fundamental na detecção e eliminação de patógenos, funcionando como uma linha de defesa inicial no intestino. Além disso, o apêndice parece atuar como um centro de amadurecimento para células imunes, o que contribui para a vigilância contra infecções.
Apendicectomia e suas Implicações Clínicas
A apendicectomia, apesar de ser uma das cirurgias mais comuns no mundo, tem implicações de longo prazo que ainda são motivo de debate. A remoção do apêndice pode afetar o microbioma intestinal e a resposta imune do paciente, aumentando o risco de doenças como a síndrome do intestino irritável (SII), diabetes tipo 2, e até mesmo doenças autoimunes, como o lúpus eritematoso sistêmico. Estudos epidemiológicos demonstraram que indivíduos que passaram por apendicectomia possuem maior risco de desenvolver SII, uma condição associada a um desequilíbrio no microbioma intestinal, particularmente com a diminuição de bactérias benéficas como Butyricicoccus.
Além disso, a remoção do apêndice tem sido associada a um risco elevado de câncer colorretal, embora os dados ainda sejam inconclusivos. Em algumas populações, a apendicectomia foi relacionada a uma redução no número de células imunes, como as células T CD3+ e CD8+, que são fundamentais na detecção e eliminação de células tumorais. Essa diminuição da vigilância imunológica pode permitir que células malignas escapem da detecção.
Aspectos Cirúrgicos: Abordagem no Tratamento de Apendicite
A apendicectomia continua sendo a principal abordagem no tratamento da apendicite, especialmente em casos agudos com risco iminente de ruptura e peritonite. No entanto, a crescente evidência sobre os benefícios do apêndice para a saúde gastrointestinal tem levado à consideração de abordagens alternativas, como o uso de antibióticos para tratar a apendicite não complicada. Um estudo publicado no New England Journal of Medicine em 2020 mostrou que o tratamento com antibióticos pode ser tão eficaz quanto a cirurgia em alguns casos de apendicite, o que levanta a questão de que a remoção do apêndice nem sempre é necessária. Além disso, os cirurgiões devem estar cientes das implicações de longo prazo da apendicectomia. Pacientes que passaram por essa cirurgia podem precisar de monitoramento adicional para doenças intestinais, como a síndrome do intestino irritável e o câncer colorretal. A atenção ao microbioma intestinal e à saúde imunológica desses pacientes é fundamental.
Pontos-chave
- O apêndice não é um órgão vestigial, mas desempenha funções importantes, como proteção imunológica e preservação do microbioma intestinal.
- A apendicectomia pode ter efeitos a longo prazo, incluindo aumento do risco de doenças como síndrome do intestino irritável, diabetes tipo 2 e câncer colorretal.
- Estudos sugerem que o apêndice serve como “refúgio” para bactérias benéficas, ajudando na recuperação do microbioma após infecções intestinais.
- A remoção do apêndice pode afetar a resposta imune, diminuindo a vigilância contra patógenos e células tumorais.
- O tratamento da apendicite com antibióticos pode ser uma alternativa viável em alguns casos, evitando a remoção do apêndice.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A apendicectomia permanece uma intervenção essencial em casos de apendicite aguda, porém, com as evidências crescentes sobre as funções do apêndice, os cirurgiões devem considerar alternativas terapêuticas, como o uso de antibióticos, em casos de apendicite não complicada. Além disso, é fundamental que os cirurgiões considerem as implicações de longo prazo da remoção do apêndice, monitorando os pacientes para doenças intestinais, autoimunes e até mesmo câncer colorretal. O estudo aprofundado dos aspectos morfofuncionais do apêndice é crucial para otimizar a prática clínica e garantir um tratamento adequado e individualizado para os pacientes.
Estudo Anatômico do Apêndice Vermiforme
O apêndice vermiforme é uma estrutura anatômica localizada no intestino grosso, mais especificamente na junção do ceco. Embora seja considerado historicamente um órgão vestigial em termos de evolução, o apêndice desempenha funções relacionadas ao sistema imunológico e à preservação do microbioma intestinal. A seguir, descreveremos suas principais características anatômicas: tamanho, localização, vascularização, inervação, anatomia de superfície e relações anatômicas.
1. Tamanho e Forma
O apêndice vermiforme é um órgão tubular de tamanho variável, com comprimento que pode variar entre 5 e 25 cm, sendo que a média é de aproximadamente 10 cm. Sua forma é geralmente cilíndrica, embora possa apresentar variações em sua espessura e curvatura. Em algumas pessoas, o apêndice pode ser mais longo ou mais curto, e pode ter uma configuração mais espiralada, dependendo das características individuais.
2. Localização
O apêndice vermiforme está localizado na região inferior direita do abdômen, na junção entre o ceco e o cólon ascendente. Sua posição exata pode variar entre os indivíduos, mas, em geral, encontra-se na fossa ilíaca direita. A localização do apêndice pode ser classificada em quatro tipos principais, de acordo com a posição anatômica em relação ao ceco:
- Retrocecal: A posição mais comum, em que o apêndice fica atrás do ceco.
- Pélvico: Quando o apêndice se estende para a pelve.
- Subcecal: Abaixo do ceco.
- Mesocólica: Quando o apêndice está posicionado em direção à parede posterior do abdômen.
Em alguns casos raros, o apêndice pode se estender para o lado esquerdo do abdômen (apêndice esquerdo), o que é conhecido como situs inversus.
3. Vascularização
A vascularização do apêndice é fornecida pela artéria apendicular, um ramo da artéria ileocolica, que por sua vez é um ramo da artéria mesentérica superior. A artéria apendicular penetra no apêndice através de sua base, fornecendo sangue para a parede do órgão.
- Veias: As veias que drenam o apêndice seguem o trajeto das artérias e se unem para formar a veia ileocolica, que, por sua vez, drena na veia mesentérica superior, e esta se conecta com a veia porta.
A vascularização do apêndice é vital para a sua função e pode ser um fator importante em condições patológicas, como a apendicite, onde a obstrução da artéria apendicular pode levar a isquemia e necrose do tecido.
4. Inervação
A inervação do apêndice provém do plexo mesentérico superior, que é derivado da divisão autonômica do sistema nervoso. A inervação sensitiva e motora é mediada pelos nervos que seguem o trajeto da artéria apendicular.
- Nervos simpáticos: A inervação simpática do apêndice provém dos nervos esplâncnicos, que transportam fibras que contribuem para a motilidade e secreção do apêndice.
- Nervos parassimpáticos: As fibras parassimpáticas são originadas dos nervos vago e sacrais, sendo responsáveis pela regulação da motilidade intestinal.
A dor associada à apendicite, por exemplo, pode se originar da inervação visceral do apêndice, que pode ser sentida inicialmente na região periumbilical e depois se localizar no quadrante inferior direito do abdômen, à medida que a inflamação se torna mais pronunciada.
5. Anatomia de Superfície
Na anatomia de superfície, o apêndice vermiforme pode ser localizado por meio de alguns pontos anatômicos de referência no abdômen. A maneira mais comum de localizar o apêndice é pelo ponto de McBurney, que é o ponto médio entre a espinha ilíaca ântero-superior direita (EIAS) e o umbigo. Esse ponto geralmente corresponde à projeção da base do apêndice. O ponto de McBurney é utilizado como um guia durante a avaliação clínica de pacientes com suspeita de apendicite. Além disso, o apêndice pode ser visualizado durante exames de imagem, como a tomografia computadorizada (TC) e a ultrassonografia abdominal, que são métodos importantes para confirmar diagnósticos de apendicite e outras condições associadas.
6. Relações Anatômicas
O apêndice vermiforme apresenta várias relações anatômicas importantes, que podem influenciar a manifestação clínica de doenças associadas a ele, como a apendicite. As principais relações são:
- Ceco: O apêndice é uma extensão do ceco, a primeira porção do cólon. Ele se localiza na junção entre o ceco e o cólon ascendente.
- Íleo: O apêndice está localizado logo acima da válvula ileocecal, que separa o íleo do ceco.
- Paredes do Abdômen: O apêndice pode estar em contato com a parede posterior do abdômen, as alças intestinais, o cólon ascendente, a vesícula biliar (em algumas variações anatômicas) e até mesmo o fígado, dependendo da sua posição.
- Vasos Sanguíneos: A artéria apendicular e suas veias acompanham as estruturas mesentéricas do intestino grosso e se localizam nas camadas do mesoapêndice, uma dobra do mesentério que sustenta o apêndice.
Em casos de apendicite, essas relações anatômicas podem influenciar o padrão de dor e a evolução da doença. A dor inicial pode ser difusa devido à inervação visceral, mas conforme a inflamação se intensifica, a dor torna-se localizada no quadrante inferior direito, devido à peritonite parietal.
Considerações Finais
A anatomia do apêndice vermiforme é complexa e varia entre os indivíduos. Compreender a localização, vascularização, inervação e as relações anatômicas do apêndice é fundamental para a prática clínica, especialmente no contexto da apendicite e das decisões cirúrgicas, portanto como afirmou o renomado médico William Osler: “A medicina é uma arte, não uma ciência exata”. A compreensão contínua das funções do apêndice e a evolução das abordagens terapêuticas refletem a natureza dinâmica da prática médica, onde novas evidências moldam as decisões clínicas e cirúrgicas. O apêndice, longe de ser um órgão sem importância, revela-se cada vez mais como uma estrutura vital para a saúde intestinal e imunológica.
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#apendicectomia #saúdeintestinal #cirurgiadigestiva #microbiomaintestinal #medicinacontinuada
Fundamentos do Transplante Hepático
O transplante hepático é uma das intervenções mais complexas e, ao mesmo tempo, revolucionárias no tratamento de doenças hepáticas terminais. Este procedimento, que substitui o fígado doente por um fígado saudável, é crucial para muitos pacientes que sofrem de doenças hepáticas graves e progressivas, além de algumas condições metabólicas e neoplásicas. Para os estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, compreender os fundamentos do transplante hepático é essencial para atuar na linha de frente do tratamento avançado de doenças hepáticas. Neste artigo, abordaremos as principais indicações, critérios de seleção, técnicas cirúrgicas, imunologia, complicações, prognóstico e perspectivas futuras do transplante hepático.
Introdução
O transplante hepático tornou-se a única opção viável para pacientes com falência hepática irreversível, proporcionando uma sobrevida significativamente prolongada e melhor qualidade de vida. Desde a sua primeira realização em humanos, ele se consolidou como o tratamento padrão para diversas doenças hepáticas. No entanto, as limitações relacionadas à disponibilidade de doadores e as complexidades inerentes ao procedimento tornam-no um desafio tanto para médicos quanto para a sociedade.
Evolução Histórica
A história do transplante hepático iniciou-se nos anos 1960, quando o Dr. Thomas Starzl realizou o primeiro transplante bem-sucedido de fígado. Desde então, avanços significativos na imunossupressão e na técnica cirúrgica melhoraram dramaticamente os resultados. O desenvolvimento de drogas imunossupressoras, como a ciclosporina, foi crucial para reduzir a rejeição e aumentar a sobrevida dos pacientes. Hoje, o transplante hepático é realizado globalmente com taxas de sucesso que eram inimagináveis no início da prática.
Indicações de Transplante Hepático
O transplante de fígado é indicado principalmente para pacientes com falência hepática crônica ou aguda que apresentam risco de morte em curto prazo. As principais indicações incluem:
- Cirrose hepática avançada, incluindo cirrose hepática por hepatite viral crônica, cirrose biliar primária e doença hepática alcoólica;
- Hepatocarcinoma em fase inicial, que pode ter cura através do transplante em pacientes selecionados;
- Doenças metabólicas hereditárias, como a doença de Wilson e deficiência de alfa-1 antitripsina;
- Insuficiência hepática aguda, geralmente causada por hepatite fulminante.
Critérios de Seleção dos Receptores
A seleção de candidatos é orientada principalmente pelo MELD (Model for End-Stage Liver Disease) para adultos e o PELD (Pediatric End-Stage Liver Disease) para crianças, ambos sistemas de pontuação que avaliam a gravidade da doença hepática. Pacientes com MELD ≥ 15 geralmente são considerados elegíveis, enquanto aqueles com hepatocarcinoma devem atender aos critérios de Milão para serem listados. Além dos critérios médicos, os candidatos são avaliados em relação ao apoio familiar, aderência ao tratamento e estabilidade psicológica, pois esses fatores influenciam significativamente o sucesso pós-transplante.
Critérios de Seleção dos Doadores
Os doadores de fígado podem ser falecidos ou vivos. Os critérios para doadores falecidos incluem idade adequada, ausência de doença hepática e compatibilidade sanguínea com o receptor. Nos doadores vivos, além desses critérios, a saúde física e mental do doador é minuciosamente avaliada. A utilização de doadores vivos tornou-se comum em alguns países, sendo especialmente importante em regiões com baixa disponibilidade de doadores falecidos.
Contraindicações Relativas e Absolutas
Certas condições médicas são consideradas contraindicativas para o transplante hepático. Contraindicações absolutas incluem:
- Neoplasias extra-hepáticas não controladas;
- Insuficiência cardíaca ou pulmonar grave;
- Uso ativo de substâncias ilícitas. As contraindicações relativas, por outro lado, são avaliadas caso a caso, incluindo infecções controladas pelo HIV, cânceres tratados e comorbidades cardiovasculares que podem ser manejadas clinicamente.
Tipos de Transplante Hepático e Fundamentos Técnicos
Os transplantes hepáticos podem ser classificados como transplante de fígado total, reduzido, split-liver (dividido entre dois receptores), ou de doadores vivos. Nos transplantes de doadores vivos, segmentos específicos do fígado, geralmente o lobo esquerdo para crianças e o lobo direito para adultos, são removidos do doador e transplantados para o receptor. Cada tipo requer preparo técnico especializado e apresenta desafios próprios, especialmente em relação à preservação do fluxo sanguíneo e à minimização de complicações vasculares.
Principais Complicações
As complicações podem ocorrer tanto no pós-operatório imediato quanto no longo prazo. As principais incluem:
- Rejeição aguda e crônica do enxerto;
- Complicações vasculares, como trombose da artéria hepática e obstrução da veia porta;
- Complicações biliares, incluindo estenoses e fístulas;
- Infecções devido à imunossupressão prolongada.
Imunologia dos Transplantes: Tipos de Rejeição e Imunossupressão
A rejeição é um dos maiores desafios no transplante hepático e pode ser classificada em rejeição celular aguda, geralmente controlada por imunossupressão, e rejeição crônica, que leva à perda do enxerto. Os principais medicamentos imunossupressores incluem ciclosporina, tacrolimus e micofenolato de mofetila. A terapia é cuidadosamente ajustada para minimizar a rejeição e evitar efeitos adversos, como infecções oportunistas e cânceres secundários.
Prognóstico do Transplante: Sobrevida Global e do Enxerto
A sobrevida após o transplante hepático continua a melhorar, com taxas de 1 ano superiores a 90% e sobrevida média de 20 anos para pacientes transplantados na década de 1990. O prognóstico depende de múltiplos fatores, incluindo a gravidade da doença original, a idade do receptor e as complicações pós-operatórias. O acompanhamento vitalício é necessário para monitorar a função do enxerto e ajustar a imunossupressão.
Perspectivas Futuras
As inovações no transplante hepático incluem avanços na perfusão de órgãos, que permite avaliar e condicionar o fígado doado antes do transplante, e o potencial uso de xenotransplantes e engenharia de tecidos. Esses avanços visam aumentar a disponibilidade de órgãos e melhorar a longevidade dos enxertos. O desenvolvimento de técnicas para induzir tolerância imunológica também promete reduzir a necessidade de imunossupressão a longo prazo, melhorando a qualidade de vida dos transplantados.
Conclusão
O transplante hepático é um procedimento altamente complexo, mas fundamental para pacientes com doenças hepáticas terminais. Para estudantes e residentes, entender os critérios de seleção, o manejo das complicações e os fundamentos técnicos é essencial para a prática em gastroenterologia e cirurgia hepática. À medida que a medicina avança, a capacidade de tratar pacientes com insuficiência hepática melhora continuamente, levando a novos horizontes na área de transplantes.
“Liver transplantation provides an opportunity for these patients to reclaim a healthy life, free from the shadow of chronic liver disease.” – Thomas Starzl
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#TransplanteHepático #Medicina #CirurgiaDigestiva #SaúdeHepática #Imunossupressão
Manejo das Afecções Biliares nos Pacientes Bariátricos
A cirurgia bariátrica é uma das principais intervenções no manejo da obesidade mórbida, proporcionando perda ponderal significativa e melhora nas comorbidades associadas, como diabetes tipo 2, hipertensão arterial e dislipidemia. Contudo, essa intervenção acarreta alterações fisiológicas importantes no trato gastrointestinal, que podem favorecer o surgimento de afecções biliares, como a colelitíase. Este artigo tem como objetivo discutir as afecções biliares em pacientes bariátricos, abrangendo desde a relação entre a obesidade e a doença biliar até o manejo das complicações biliares antes e após a cirurgia bariátrica, além de abordar a propedêutica diagnóstica e terapêutica no acesso às vias biliares em pacientes submetidos ao bypass gástrico.
Introdução
A obesidade é uma condição de saúde pública crescente no Brasil. De acordo com o IBGE, mais de 20% da população brasileira é considerada obesa, o que coloca esses indivíduos em maior risco de desenvolver doenças biliares, entre outras comorbidades. A colelitíase (formação de cálculos biliares) é particularmente prevalente nesta população, sendo exacerbada pela rápida perda de peso que segue a cirurgia bariátrica. Dada a relevância do tema, é fundamental que cirurgiões e residentes compreendam as implicações das afecções biliares nos pacientes bariátricos e as abordagens terapêuticas adequadas.
Doença Biliar e Obesidade
A colelitíase afeta de 2% a 15% da população geral, mas em pacientes obesos esse número é substancialmente maior. A obesidade é um fator de risco importante para a formação de cálculos biliares devido à supersaturação da bile com colesterol, hipomotilidade da vesícula biliar e fatores dietéticos. Estudos indicam que pacientes com Índice de Massa Corporal (IMC) superior a 40 têm um risco 8 vezes maior de desenvolver colelitíase em comparação com indivíduos de peso normal.
Nos pacientes bariátricos, a rápida perda de peso após a cirurgia é um dos maiores contribuintes para o surgimento de cálculos biliares. A prevalência de colelitíase em pacientes pós-cirurgia bariátrica varia entre 6,7% a 52,8%, sendo os cálculos de colesterol os mais comuns. Além disso, a hipomotilidade da vesícula biliar após o bypass gástrico favorece o acúmulo de bile e a formação de “sludge” biliar, o que pode evoluir para cálculos e suas complicações.
Manejo da Colelitíase e Suas Complicações Antes e Após a Cirurgia Bariátrica
O manejo da vesícula biliar no contexto da cirurgia bariátrica é um tema controverso. Alguns cirurgiões optam por realizar colecistectomia profilática durante a cirurgia bariátrica em pacientes com cálculos assintomáticos documentados. Essa abordagem visa prevenir complicações futuras, como a colecistite aguda ou pancreatite biliar, que podem ser mais difíceis de tratar após o bypass gástrico, devido às alterações anatômicas.
Entretanto, muitos cirurgiões adotam uma abordagem seletiva, realizando a colecistectomia apenas em pacientes com sintomas ou doenças biliares comprovadas por exames de imagem. Essa prática é sustentada pelo fato de que não há consenso claro sobre a necessidade de remover a vesícula biliar em todos os pacientes durante a cirurgia bariátrica. Estima-se que cerca de 4% dos pacientes necessitarão de colecistectomia após o bypass gástrico, um número que pode ser considerado aceitável para evitar a remoção profilática da vesícula em todos os casos.
As complicações da colelitíase, como a colecistite, pancreatite biliar e a coledocolitíase, podem ocorrer tanto no pré quanto no pós-operatório bariátrico. Nessas situações, o manejo segue as diretrizes usuais, com colecistectomia laparoscópica sendo a primeira linha de tratamento. No entanto, em pacientes submetidos ao bypass gástrico, a abordagem endoscópica para remover cálculos biliares pode ser mais desafiadora.
Propedêutica Radiológica e Endoscópica nos Pacientes Bariátricos
O diagnóstico das afecções biliares em pacientes bariátricos pode ser dificultado pela anatomia alterada após a cirurgia. A ultrassonografia abdominal, o exame de escolha para diagnosticar colelitíase na população geral, pode ter sensibilidade reduzida em pacientes obesos devido à presença de gordura abdominal. Além disso, após o bypass gástrico, o acesso ao trato gastrointestinal superior é limitado, o que dificulta exames como a colangiopancreatografia retrógrada endoscópica (CPRE).
A ressonância magnética com colangiopancreatografia (RMCP) e a colangiografia transhepática percutânea são métodos alternativos valiosos no diagnóstico de coledocolitíase e outras afecções das vias biliares em pacientes bariátricos. Em casos mais complexos, o uso de ultrassom intraoperatório durante a colecistectomia pode auxiliar no diagnóstico e manejo.
Prevenção da Colelitíase Após Cirurgia Bariátrica
A formação de cálculos biliares é especialmente comum durante a fase de perda rápida de peso que se segue à cirurgia bariátrica. Para mitigar esse risco, muitos especialistas recomendam o uso de ursodiol (ácido ursodesoxicólico), que atua na dissolução de colesterol e reduz a formação de cálculos biliares. Estudos indicam que a administração de 600 mg de ursodiol por dia durante os primeiros 6 meses após a cirurgia reduz significativamente a incidência de colelitíase, especialmente na fase de perda ponderal acelerada.
Acesso Endoscópico das Vias Biliares Após Bypass Gástrico
A alteração anatômica após o bypass gástrico de Roux-en-Y torna o acesso endoscópico convencional ao trato biliar, como a CPRE, extremamente difícil. Nesse cenário, uma abordagem bem-sucedida envolve a CPRE transgástrica percutânea assistida por laparoscopia, que permite acessar a árvore biliar via o estômago remanescente. Este procedimento, realizado em conjunto com especialistas em endoscopia, mostrou-se altamente eficaz, com taxas de sucesso superiores a 95% na canulação do ducto biliar comum.
Conclusão
As afecções biliares são um desafio comum e relevante em pacientes bariátricos, principalmente devido às alterações fisiológicas e anatômicas decorrentes da cirurgia e da rápida perda de peso. O manejo adequado envolve uma abordagem multidisciplinar, utilizando técnicas radiológicas avançadas e estratégias preventivas como o uso de ursodiol. O cirurgião digestivo deve estar apto a manejar as complicações biliares tanto no pré quanto no pós-operatório, considerando as particularidades anatômicas e fisiológicas desses pacientes.
“O entendimento das alterações morfofuncionais pós-bariátrica e sua relação com o sistema biliar é crucial para a condução segura e eficaz do paciente obeso no pós-operatório” Prof. Dr. Ozimo Gama
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Cuidados Perioperatórios nos Pacientes Cirróticos
Desafios e Estratégias para Otimização dos Resultados
A cirurgia em pacientes com cirrose hepática apresenta desafios únicos e um risco significativamente elevado de complicações. O manejo perioperatório adequado é essencial para minimizar complicações como sangramento, falência hepática e ascite, garantindo melhores desfechos. Este post visa abordar os cuidados perioperatórios em pacientes cirróticos, com foco em pré-avaliação, estratégias intraoperatórias e o manejo de complicações pós-operatórias, oferecendo orientações práticas para estudantes de medicina, residentes e cirurgiões digestivos.
A Importância do Manejo Perioperatório em Pacientes Cirróticos
Os pacientes com cirrose são particularmente vulneráveis durante procedimentos cirúrgicos devido à disfunção hepática subjacente e suas complicações associadas, como hipertensão portal, ascite e coagulopatia. A taxa de mortalidade desses pacientes pode ser até três vezes maior que a dos pacientes sem cirrose. A avaliação cuidadosa e o planejamento pré-operatório são cruciais para evitar falência hepática pós-operatória e outras complicações graves.
Avaliação Pré-Operatória: Estratificação de Riscos
A adequada estratificação de risco no pré-operatório é um dos pilares para o sucesso em cirurgias de pacientes cirróticos. Os seguintes aspectos são críticos:
- Estado geral do paciente: Comorbidades como insuficiência cardíaca e renal, além de diabetes mellitus, aumentam os riscos.
- Função hepática: Avaliações quantitativas, como a classificação Child-Pugh e o MELD, são essenciais para prever o risco de falência hepática. Cirurgias maiores devem ser evitadas em pacientes Child B ou C, exceto em casos extremamente selecionados.
- Hipertensão portal: A presença de hipertensão portal, frequentemente acompanhada de trombocitopenia e varizes esofágicas, é um fator importante que aumenta o risco de complicações pós-operatórias.
Além disso, a avaliação do volume do fígado remanescente é fundamental. Em pacientes com cirrose, é necessário um remanescente de pelo menos 50% do volume hepático funcional para evitar falência hepática.
Estratégias Intraoperatórias para Minimizar Complicações
Durante a cirurgia, o manejo adequado é essencial para minimizar complicações em pacientes cirróticos. As seguintes estratégias são recomendadas:
- Abordagem Anterior: Para pacientes com tumores hepáticos grandes, essa técnica evita a manipulação excessiva do fígado, reduzindo o risco de sangramento e disseminação tumoral.
- Ultrassonografia Intraoperatória: A ultrassonografia com Doppler é essencial para mapear o padrão vascular do fígado e orientar as ressecções hepáticas, maximizando a preservação de parênquima funcional.
- Occlusão Vascular e Controle de Sangramento: A técnica de clampagem intermitente do fluxo hepático é uma estratégia eficaz para reduzir a perda sanguínea sem comprometer a função hepática. Manter uma pressão venosa central baixa (<5 mmHg) também reduz o sangramento durante a transecção hepática.
- Uso de Dispositivos para Transecção Hepática: Técnicas como o uso do Cavitron Ultrasonic Surgical Aspirator (CUSA) e o uso de bisturis harmônicos são recomendadas para a dissecção cuidadosa do parênquima cirrótico, minimizando o risco de sangramento.
Complicações Pós-Operatórias e Manejo
Após a cirurgia, os pacientes cirróticos estão sujeitos a complicações específicas que exigem manejo adequado:
- Ascite Pós-Operatória: É uma complicação comum, ocorrendo em cerca de um terço dos pacientes cirróticos. O tratamento envolve reposição volêmica cuidadosa e, em alguns casos, o uso de diuréticos. A ascite pode causar dor, limitação respiratória e infecções, exigindo vigilância contínua.
- Falência Hepática: A falência hepática pós-operatória ainda é uma das principais causas de mortalidade hospitalar após ressecções hepáticas em cirróticos, com uma taxa de mortalidade de até 50% nos casos mais graves. O monitoramento de indicadores como o tempo de protrombina (TP) e bilirrubina sérica no pós-operatório imediato é essencial para detectar precocemente essa complicação.
- Fístulas Biliares: As fístulas biliares, com taxa de ocorrência em torno de 6%, podem levar a coleções abdominais e infecções graves. O tratamento envolve drenagem percutânea e, em alguns casos, cirurgia de revisão.
- Trombose Portal: A trombose da veia porta é uma complicação perigosa, especialmente em pacientes com hipertensão portal. O diagnóstico precoce através de ultrassonografia e tratamento com anticoagulantes são essenciais para evitar desfechos fatais.
- Infecções: Cirurgias prolongadas e a presença de ascite aumentam o risco de complicações sépticas. A profilaxia com antibióticos de amplo espectro é recomendada, e a infecção deve ser prontamente diagnosticada e tratada.
Pontos-Chave para a Prática do Cirurgião Digestivo
- Seleção do Paciente: A correta seleção dos pacientes, baseada na avaliação da função hepática, estado geral e hipertensão portal, é o principal determinante de bons resultados cirúrgicos.
- Técnicas Cirúrgicas Avançadas: O uso de estratégias como a ultrassonografia intraoperatória e a abordagem anterior melhora os resultados ao minimizar o trauma tecidual e a perda sanguínea.
- Manejo de Complicações: O reconhecimento precoce e o tratamento das complicações pós-operatórias, como ascite, fístulas biliares e trombose portal, são essenciais para a recuperação dos pacientes.
- Importância da Equipe Multidisciplinar: O sucesso na abordagem cirúrgica de pacientes cirróticos depende da colaboração entre cirurgiões, hepatologistas, anestesistas e intensivistas.
Conclusão
O manejo perioperatório de pacientes cirróticos requer uma abordagem cuidadosa e individualizada para reduzir complicações e otimizar os resultados cirúrgicos. A avaliação pré-operatória detalhada, o uso de técnicas intraoperatórias avançadas e o manejo adequado das complicações são fundamentais para o sucesso. Como Jacques Belghiti, renomado cirurgião hepático, destacou: “A cirurgia no paciente cirrótico não é apenas uma técnica, mas uma tarefa criteriosa de selecionar e manejar com precisão cada etapa do tratamento”.
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#cirurgia #cirroses #cuidadosperioperatórios #cirurgiahepática #saúde
Protocolo ERAS na Cirurgia Pancreática
Otimizando a Recuperação Pós-Operatória
A cirurgia pancreática, em especial a pancreatoduodenectomia (PD), é um procedimento de alta complexidade e associado a complicações significativas. Para melhorar os desfechos pós-operatórios e reduzir o tempo de internação, foi implementado o protocolo ERAS (Enhanced Recovery After Surgery), que visa otimizar a recuperação dos pacientes cirúrgicos. Este artigo explora como o ERAS impacta a morbimortalidade, seu custo-efetividade e as principais medidas assistenciais envolvidas, oferecendo pontos-chave para a prática cirúrgica no aparelho digestivo.
O que é o Protocolo ERAS?
O protocolo ERAS é uma abordagem multimodal que visa reduzir o estresse cirúrgico, acelerar a recuperação e diminuir as complicações no período pós-operatório. Originalmente desenvolvido para cirurgias colorretais, o ERAS foi adaptado para outras especialidades, incluindo a cirurgia pancreática. O primeiro conjunto de diretrizes para a pancreatoduodenectomia foi publicado em 2012, sendo atualizado em 2019 com 27 recomendações baseadas em evidências científicas. Entre os principais objetivos do ERAS estão a redução do tempo de internação hospitalar, a menor incidência de complicações como a fístula pancreática e o retardo no esvaziamento gástrico (DGE, na sigla em inglês).
Na cirurgia pancreática, a mortalidade tem sido reduzida para menos de 5% em centros de grande volume no Brasil, entretanto, a morbidade ainda é alta, variando de 30% a 60%. O protocolo ERAS surge como uma alternativa eficiente para padronizar o manejo perioperatório, reduzir complicações e encurtar a permanência hospitalar.
Impacto do ERAS na Morbimortalidade
Um dos principais benefícios do protocolo ERAS é a redução das complicações pós-operatórias, incluindo infecções de sítio cirúrgico, DGE e fístula pancreática. Estudos internacionais e revisões sistemáticas mostraram que pacientes submetidos ao ERAS apresentaram menor tempo de internação e menor incidência de complicações sem aumento nas taxas de readmissão ou mortalidade.
No Brasil, onde a pancreatoduodenectomia também é uma cirurgia de alto risco, a implementação do ERAS traz ganhos substanciais. Em centros que adotaram o protocolo, houve uma redução expressiva do tempo médio de internação, que pode superar 14 dias nos cuidados convencionais. Além disso, as taxas de complicações severas são minimizadas, o que impacta diretamente a recuperação global do paciente e a sua qualidade de vida pós-operatória.
Custo-Efetividade do ERAS
A implementação do protocolo ERAS tem demonstrado ser financeiramente vantajosa. A redução das complicações e do tempo de hospitalização leva a uma economia significativa de recursos, especialmente em procedimentos de grande porte, como as cirurgias pancreáticas. Estima-se que, em hospitais que seguem o ERAS, os custos totais com o tratamento de pacientes submetidos à pancreatoduodenectomia sejam reduzidos em até 20%, principalmente devido à diminuição do tempo de internação e ao uso racional de exames laboratoriais e diagnósticos.
Um estudo norte-americano relatou que a economia total foi de aproximadamente USD 5.300 por paciente após a adoção do ERAS, enquanto no Brasil, uma análise preliminar mostrou uma economia que pode atingir R$ 15.000 por paciente em algumas instituições de referência. Esses números refletem a importância da padronização dos cuidados e a utilização eficiente de recursos hospitalares.
Principais Medidas Assistenciais do ERAS
O protocolo ERAS engloba diversas intervenções que visam otimizar o cuidado perioperatório. Entre as principais medidas adotadas no contexto da cirurgia pancreática, destacam-se:
- Pré-Operatório:
- Pré-habilitação: Início de um programa de reabilitação com exercícios físicos e suporte nutricional de 3 a 6 semanas antes da cirurgia, especialmente em pacientes com perda de peso superior a 15% ou IMC abaixo de 18,5.
- Jejum: Limitação do jejum pré-operatório para 6 horas para sólidos e 2 horas para líquidos, além de carga de carboidratos até 2 horas antes da cirurgia.
- Drenagem biliar: Indicada apenas em casos específicos, como níveis de bilirrubina acima de 250 μmol/L ou colangite.
- Pós-Operatório:
- Remoção precoce de drenos: Drenos são removidos após 72 horas em pacientes de baixo risco.
- Alimentação precoce: Início de alimentação oral assim que o paciente tolerar, com a utilização de chicletes e medicamentos como alvimopan para acelerar a recuperação intestinal.
- Mobilização precoce: Incentivo à deambulação a partir do primeiro dia pós-operatório.
Principais Recomendações do Protocolo ERAS sobre Técnica Operatória
- Minimização do Trauma Cirúrgico:
- O protocolo ERAS recomenda que as técnicas operatórias minimizem o trauma tecidual, uma prática que inclui o uso de abordagens menos invasivas quando viável. Embora o PD laparoscópico ou robótico tenha sido considerado, o ERAS alerta que esses métodos devem ser realizados apenas em centros de alto volume e com experiência, pois ainda há preocupações sobre sua segurança em larga escala.
- A PD robótica não é recomendada pelo ERAS devido à falta de evidências robustas que garantam segurança e eficácia comparável à cirurgia aberta.
- Drenagem Profilática:
- A drenagem abdominal profilática continua a ser um ponto controverso no manejo de cirurgias pancreáticas. O ERAS sugere que a decisão sobre o uso de drenos profiláticos deve ser individualizada. Para pacientes considerados de baixo risco (com níveis de amilase abaixo de 5000 U/L no primeiro dia pós-operatório), a drenagem pode ser removida precocemente, geralmente em 72 horas, o que pode reduzir o risco de infecções e acelerar a recuperação.
- Prevenção de Hipotermia:
- O ERAS recomenda a manutenção da normotermia intraoperatória através de técnicas como o uso de cobertores aquecidos e o controle da temperatura de fluidos intravenosos. Isso é crucial para evitar complicações relacionadas à hipotermia, como o aumento do risco de infecções e atraso na cicatrização.
- Controle de Fluidos:
- O controle rigoroso de fluidos durante a operação é uma diretriz fundamental no protocolo ERAS. A sobrecarga de fluidos pode levar a edemas nos tecidos e complicações, como o retardo no esvaziamento gástrico. Assim, o uso de um algoritmo de fluidoterapia dirigida por metas é recomendado para evitar o excesso de fluidos.
- Uso de Analgesia Regional:
- Para o controle da dor, o protocolo ERAS favorece o uso de analgesia epidural torácica em cirurgias abertas, como a pancreatoduodenectomia. Essa abordagem reduz a necessidade de opioides, que podem estar associados a efeitos colaterais como íleo paralítico. Caso a analgesia epidural seja contraindicada, são sugeridas alternativas como o uso de cateteres de ferida preperitoneais.
- Prevenção de Fístulas Pancreáticas:
- Embora não seja uma recomendação direta sobre a técnica operatória, o protocolo ERAS menciona que o uso de análogos de somatostatina (como octreotida) não é recomendado de forma sistemática para prevenir fístulas pancreáticas, devido à falta de evidências conclusivas. A gestão de fístulas pancreáticas, portanto, deve ser cuidadosa e individualizada.
Considerações sobre Cirurgia Minimamente Invasiva:
O ERAS reconhece o potencial da cirurgia minimamente invasiva (como laparoscopia e cirurgia robótica) para reduzir o trauma cirúrgico e acelerar a recuperação. No entanto, essas técnicas exigem habilidades especializadas e devem ser realizadas apenas em centros com alto volume e vasta experiência nesses procedimentos. A segurança e eficácia dessas abordagens ainda estão sendo avaliadas em estudos, e o ERAS não as recomenda como padrão para todos os pacientes.
Pontos-Chave e Conclusões para a Prática do Cirurgião Digestivo
A implementação do ERAS na cirurgia pancreática oferece uma abordagem sólida e baseada em evidências para reduzir a morbimortalidade e melhorar os resultados cirúrgicos. O sucesso do protocolo depende do comprometimento de toda a equipe multidisciplinar e do acompanhamento rigoroso das diretrizes estabelecidas. Alguns pontos-chave que devem ser ressaltados incluem:
- Aderência às diretrizes: O nível de adesão ao protocolo está diretamente relacionado à redução de complicações. Estudos mostraram que pacientes com uma adesão superior a 70% ao protocolo ERAS apresentam menos complicações e menor tempo de internação.
- Educação contínua da equipe: Reuniões regulares para discutir a implementação e as barreiras encontradas são essenciais para o sucesso a longo prazo.
- Foco no paciente: A educação do paciente quanto às expectativas do tratamento e a importância da adesão ao plano cirúrgico também desempenha um papel fundamental na implementação bem-sucedida do ERAS.
Para o cirurgião digestivo, o ERAS representa uma mudança de paradigma, não apenas na forma de realizar cirurgias de alta complexidade, mas também na maneira de lidar com o cuidado pós-operatório. A adesão ao protocolo requer coordenação e disciplina, mas os resultados são claros: pacientes com recuperação mais rápida, menos complicações e melhor qualidade de vida após a cirurgia.
Considerações Finais
O protocolo ERAS veio para transformar a forma como abordamos a recuperação cirúrgica, especialmente em procedimentos complexos como a pancreatoduodenectomia. Ele não só melhora os desfechos clínicos, mas também otimiza a utilização de recursos hospitalares, beneficiando tanto os pacientes quanto o sistema de saúde. Para a prática do cirurgião do aparelho digestivo, o ERAS é uma ferramenta indispensável para garantir um tratamento mais seguro, eficaz e econômico.
Como disse Allen Oldfather Whipple, renomado cirurgião norte-americano: “O conhecimento sobre a operação não é o suficiente, é necessário também uma compreensão profunda do que ocorre depois dela para alcançar a cura.”
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#cirurgiaplástica #ERAS #cirurgiapancreática #recuperaçãoacelerada #saúde
Anatomia Cirúrgica das Vias Biliares Aplicada para Colecistectomia Segura
Por Prof. Dr. Ozimo Gama
- Membro Titular do Colégio Brasileiro de Cirurgiões
- Membro Titular do Colégio Brasileiro de Cirurgia Digestiva
A colecistectomia é um dos procedimentos cirúrgicos mais comuns para o tratamento de doenças da vesícula biliar, como colelitíase sintomática e colecistite aguda. A correta compreensão da anatomia cirúrgica das vias biliares é fundamental para garantir uma colecistectomia laparoscópica segura, evitando complicações graves, como lesões ao ducto biliar. Este texto é voltado para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, abordando aspectos essenciais da anatomia cirúrgica das vias biliares com foco na segurança cirúrgica.
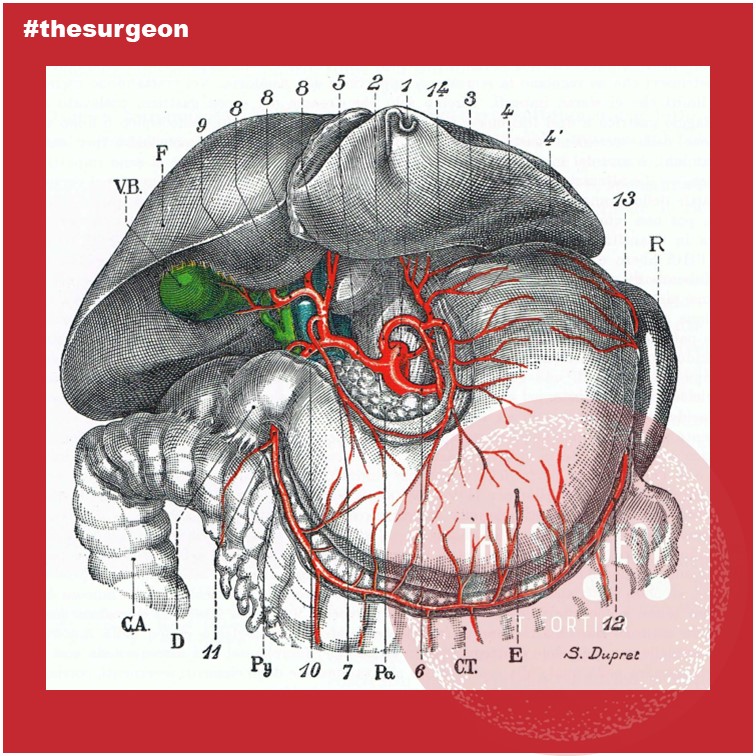

Introdução
A colecistectomia, seja ela aberta ou laparoscópica, envolve a retirada da vesícula biliar, um órgão pequeno, mas de grande importância no armazenamento e liberação de bile. As complicações durante a colecistectomia são frequentemente relacionadas ao desconhecimento ou à falta de reconhecimento das variações anatômicas das vias biliares. Estudos indicam que entre 0,3% a 1,5% dos pacientes podem apresentar lesões das vias biliares durante esse procedimento, o que pode resultar em morbidade significativa.
Anatomia Descritiva
As vias biliares consistem no sistema de ductos que transportam a bile do fígado para o duodeno. Esse sistema é composto pelos ductos biliares intra-hepáticos, que se unem para formar o ducto hepático comum. As vias biliares extra-hepática é formada pelo ducto cístico, que conecta a vesícula biliar ao ducto hepático, formando assim o ducto colédoco, que desemboca na ampola duodenal maior (Vater) no duodeno. A vesícula biliar é localizada na fossa cística da superfície visceral do fígado, e sua drenagem ocorre através do ducto cístico.
Dimensões Normais
O ducto hepático comum mede, em média, 4 a 5 cm de comprimento e tem um diâmetro aproximado de 4 a 6 mm. O ducto cístico, por sua vez, mede cerca de 2 a 4 cm de comprimento, com um diâmetro de 3 mm. Já o ducto colédoco tem, em média, 6 a 8 cm de comprimento e um diâmetro que varia de 6 a 8 mm.
Anatomia Topográfica e Relações Anatômicas
A vesícula biliar está situada entre o lobo direito e o lobo quadrado do fígado, na fossa vesicular. Suas relações anatômicas incluem o duodeno, a cabeça do pâncreas e o fígado. Na cirurgia, o triângulo Hepatocístico é uma das principais referências anatômicas. Esse triângulo é formado pelo ducto cístico, ducto hepático comum e a borda inferior do fígado, contendo a artéria cística, que é uma importante estrutura a ser identificada e preservada durante a colecistectomia.

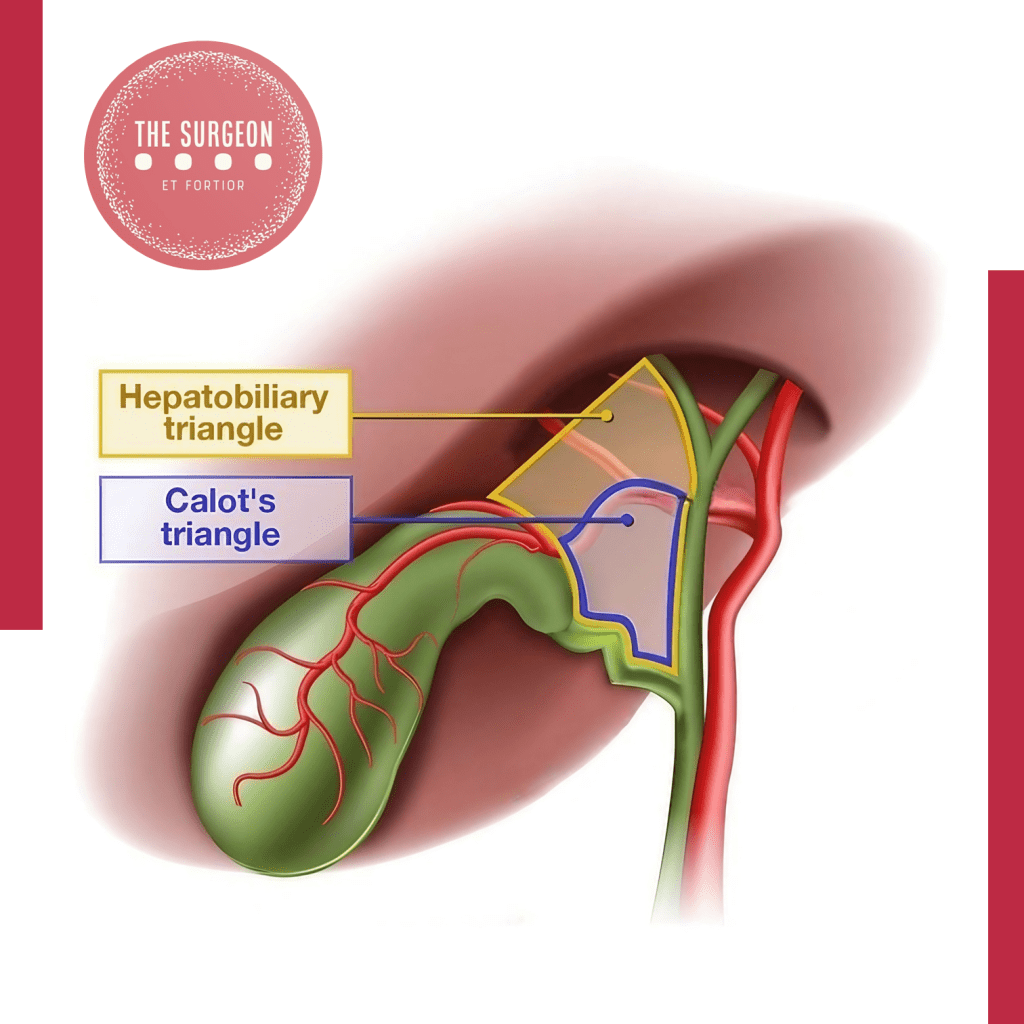
Variações Anatômicas Mais Relevantes
As variações anatômicas das vias biliares são comuns e podem estar presentes em até 25% da população. Entre as mais frequentes estão:
- Ducto cístico curto ou com inserção alta no ducto hepático.
- Ducto cístico espiralado, o que dificulta sua dissecção.
- Trifurcação dos ductos biliares, onde o ducto hepático direito se divide antes de formar o ducto hepático comum.
- Artéria cística de origem anômala, como proveniente da artéria hepática direita ou, em raros casos, da artéria hepática comum.
Essas variações anatômicas são importantes, pois lesões inadvertidas durante a dissecção podem causar complicações como fístulas biliares, estenoses e lesões vasculares.
Vascularização da Via Biliar
A vascularização das vias biliares é fornecida principalmente pela artéria cística, que se origina da artéria hepática direita. Adicionalmente, a artéria hepática direita e a artéria gastroduodenal fornecem ramos que contribuem para a irrigação do ducto hepático comum e colédoco. No entanto, a parte supraduodenal do colédoco é mais suscetível a isquemia, especialmente em casos de manipulação excessiva durante a cirurgia. A compreensão da rede arterial é vital para evitar lesões vasculares e garantir o sucesso da anastomose biliar, quando necessário.
Pontos de Reparo Anatômico para uma Colecistectomia Laparoscópica Segura
Para evitar lesões inadvertidas, os cirurgiões devem seguir alguns princípios básicos de segurança:
- Identificação do Triângulo de Calot: A correta visualização das estruturas no triângulo de Calot é essencial. A artéria cística deve ser cuidadosamente dissecada e clipada antes da secção.
- Dissecção crítica de segurança: O conceito de “visão crítica de segurança” implica a dissecção completa da vesícula do leito hepático, de forma que as únicas duas estruturas conectadas à vesícula sejam o ducto cístico e a artéria cística. Isso reduz significativamente o risco de lesões às vias biliares principais.
- Variações Anatômicas: O cirurgião deve estar ciente das possíveis variações anatômicas e, em caso de dúvida, deve recorrer a exames de imagem intraoperatórios, como a colangiografia.
Pontos-Chave e Conclusões Aplicadas à Prática do Cirurgião Digestivo
Para garantir uma colecistectomia segura, o conhecimento profundo da anatomia cirúrgica das vias biliares é indispensável. A incidência de lesões biliares pode ser minimizada seguindo protocolos rigorosos, como a dissecção anatômica cuidadosa, a utilização de exames complementares intraoperatórios e o respeito pelas variações anatômicas individuais. No Brasil, a colecistectomia laparoscópica é o padrão ouro, sendo realizada em aproximadamente 95% dos casos, com uma taxa de complicação de menos de 1%. No entanto, lesões das vias biliares ainda são uma causa significativa de morbidade pós-operatória, destacando a importância de uma educação anatômica continuada.
Em última análise, a chave para uma colecistectomia laparoscópica segura está na visualização precisa das estruturas anatômicas e na aplicação de técnicas cirúrgicas comprovadas. Seguindo esses princípios, é possível reduzir significativamente o risco de complicações graves e melhorar os resultados para os pacientes.
Como já afirmado por Lahey: “O reconhecimento e a compreensão das variações anatômicas nas vias biliares são fundamentais para evitar complicações nas cirurgias biliares.”
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#AnatomiaBiliar #ColecistectomiaSegura #CirurgiaDigestiva #ViasBiliares #SegurançaCirúrgica
Incidentaloma Hepático
Estratégia Diagnóstica e Manejo Cirúrgico
A crescente utilização de exames de imagem na prática médica resultou no aumento da detecção de lesões hepáticas assintomáticas, conhecidas como incidentalomas hepáticos. Estes achados radiológicos, identificados incidentalmente em até 15% dos exames de imagem, levantam desafios diagnósticos e terapêuticos significativos para os cirurgiões do aparelho digestivo. Embora a maioria dessas lesões seja benigna, cerca de 10% podem ser malignas, exigindo uma avaliação detalhada para evitar procedimentos desnecessários e potencialmente arriscados. Este post aborda as estratégias diagnósticas e o manejo cirúrgico apropriado para o incidentaloma hepático, com foco na prática diária do cirurgião digestivo.
Introdução
O incidentaloma hepático é definido como uma lesão hepática assintomática detectada incidentalmente durante investigações radiológicas realizadas por outras razões. A maioria dessas lesões é benigna, como os hemangiomas e as hiperplasias nodulares focais (HNF), mas há casos em que o achado pode indicar uma lesão maligna, como o carcinoma hepatocelular ou metástases hepáticas. A identificação adequada e o manejo correto desses incidentalomas são essenciais para garantir que pacientes com lesões potencialmente graves sejam tratados precocemente, enquanto aqueles com lesões benignas possam evitar intervenções desnecessárias.
Diagnóstico Radiológico Diferencial
A principal ferramenta para a avaliação de incidentalomas hepáticos é a imagem, com a ultrassonografia (US), a tomografia computadorizada (TC) e a ressonância magnética (RM) sendo as modalidades mais comumente utilizadas. Cada exame possui características específicas que ajudam na classificação e distinção das lesões hepáticas.
- Ultrassonografia (US): Frequentemente o primeiro exame realizado, a ultrassonografia pode distinguir lesões císticas de sólidas. Lesões císticas simples geralmente não requerem tratamento, enquanto lesões císticas complexas podem demandar avaliação adicional com TC ou RM. Hemangiomas e hiperplasia nodular focal também podem ser identificados com precisão por ultrassom.
- Tomografia Computadorizada (TC): A TC com contraste é frequentemente utilizada para caracterizar lesões indeterminadas vistas em ultrassonografia. Lesões benignas, como hemangiomas, apresentam padrões típicos de realce nodular periférico com enchimento centrípeto nas fases tardias do contraste. Já as metástases hepáticas, comuns em pacientes com câncer gastrointestinal ou de mama, aparecem como lesões hipovasculares com margens mal definidas e heterogeneidade interna.
- Ressonância Magnética (RM): A RM, especialmente quando realizada com contraste específico para hepatócitos, oferece alta acurácia para a caracterização de lesões hepáticas. Ela é superior à TC na diferenciação entre lesões benignas, como hiperplasia nodular focal, e lesões malignas. Incidentalomas que mostram padrões típicos de hiperintensidade em T2, como os hemangiomas, podem ser facilmente identificados com a RM.
A relevância de cada modalidade de imagem varia de acordo com a característica da lesão e o risco do paciente. Lesões menores que 1 cm, também conhecidas como too small to characterize (TSTC), representam um desafio, pois não é possível determinar com segurança sua natureza com base em imagens iniciais. Nestes casos, o seguimento por imagem a curto prazo é recomendado.
Indicação de Manejo Cirúrgico
A decisão de realizar intervenção cirúrgica em um paciente com incidentaloma hepático deve ser cuidadosamente avaliada. O manejo cirúrgico é geralmente indicado em três situações principais:
- Lesões malignas ou com suspeita de malignidade: Incidentalomas em pacientes com histórico de câncer ou em casos onde as características radiológicas sugerem malignidade (margens irregulares, crescimento rápido ou captação anômala de contraste) devem ser tratados com ressecção cirúrgica. Carcinoma hepatocelular, metástases hepáticas e colangiocarcinoma estão entre as principais malignidades a serem excluídas.
- Lesões benignas com potencial de complicação: Hemangiomas de grande volume ou adenomas hepáticos, por exemplo, podem causar complicações, como sangramento ou transformação maligna, especialmente em lesões maiores que 5 cm. Nesses casos, a ressecção pode ser indicada para prevenir eventos adversos.
- Lesões sintomáticas: Embora a maioria dos incidentalomas seja assintomática, algumas lesões benignas, como angiomiolipomas grandes, podem causar desconforto abdominal ou hepatomegalia, justificando uma intervenção cirúrgica.
Além disso, é importante considerar o risco cirúrgico do paciente. Pacientes com cirrose avançada ou outras comorbidades significativas podem não ser candidatos adequados para ressecção hepática, sendo necessário um manejo mais conservador.
Pontos-Chave para a Prática Cirúrgica
- Risco de malignidade: Cerca de 10% dos incidentalomas hepáticos são malignos. A detecção precoce e a caracterização correta da lesão são fundamentais para otimizar o tratamento.
- Segurança do paciente: O excesso de investigação pode resultar em procedimentos desnecessários, aumentando o custo e o risco para o paciente. A avaliação criteriosa das imagens e a classificação do paciente em grupos de risco podem auxiliar na tomada de decisão clínica.
- Uso adequado de imagem: A ressonância magnética com contraste específico para hepatócitos é o exame de escolha em lesões indeterminadas e proporciona alta sensibilidade e especificidade para o diagnóstico de lesões benignas e malignas.
- Indicação cirúrgica: A cirurgia está indicada em lesões malignas, lesões benignas com risco de complicação e incidentalomas sintomáticos. Nos casos de lesões muito pequenas e indeterminadas, o seguimento clínico com exames seriados é uma alternativa válida.
Conclusão
O incidentaloma hepático representa um desafio comum na prática cirúrgica, especialmente com o aumento da utilização de exames de imagem. O manejo adequado dessas lesões requer uma abordagem balanceada entre evitar procedimentos desnecessários e tratar com eficácia os casos de malignidade ou complicação potencial. O cirurgião digestivo deve basear suas decisões em uma análise detalhada das características radiológicas, história clínica do paciente e potencial de complicações. Em última análise, o manejo desses incidentalomas deve ser individualizado para otimizar os resultados para o paciente.
Como sabiamente afirmou Henri Bismuth, um dos pioneiros da cirurgia hepática: “A arte de manejar o fígado vai além da técnica operatória; ela envolve a compreensão detalhada da fisiopatologia hepática e uma estratégia bem calculada de tratamento.”
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Surgical Treatment of Pyogenic Liver Abscess
Current Approach for Digestive Surgeons
Pyogenic liver abscess (PLA) is a severe infectious condition requiring rapid diagnosis and precise management. While antibiotics may suffice for small abscesses, larger or complicated cases often necessitate surgical intervention. This post aims to discuss surgical approaches in treating PLA, highlighting intervention criteria and best practices for digestive surgeons.
Introduction
Pyogenic liver abscess is an encapsulated collection of purulent material in the liver, frequently caused by bacterial infections originating from the biliary tract or intra-abdominal sources, such as diverticulitis. Management of this condition has evolved significantly, with surgery playing a key role when antibiotic treatment alone is insufficient. Global mortality from PLA ranges from 10% to 20%, and in Brazil, this rate may be higher depending on healthcare access.
Diagnosis and Classification
PLA diagnosis relies on imaging exams such as ultrasound (US) and computed tomography (CT), essential for identifying the extent of the lesion and determining therapeutic approaches. Small abscesses, typically less than 3-4 cm, can be treated with antibiotics, while larger lesions over 5 cm often require percutaneous or surgical drainage. In Brazil, Escherichia coli and Klebsiella pneumoniae are the most common causative agents. Immunocompromised patients, such as diabetics, have a higher risk of developing PLA, and aggressive management is crucial in this population.
Surgical Approach
Surgical intervention is indicated in cases of failed percutaneous drainage or when multiloculated abscesses are present, as well as in abscess rupture cases. Image-guided percutaneous drainage has a high success rate, around 90%, in unilocular abscesses. However, large, multiloculated, or highly viscous abscesses may require more aggressive surgical intervention.
Open surgery, though less frequent due to the advent of minimally invasive techniques, remains necessary for complex multiloculated abscesses or unstable patients. Studies show that surgical management may be more effective for large abscesses (over 10 cm), especially in reducing hospital stay and ensuring complete infection resolution.
Application in Digestive Surgery
Digestive surgeons play a critical role in managing hepatic complications, such as pyogenic abscesses. In addition to mastering percutaneous drainage techniques, surgeons must be prepared to intervene surgically when necessary. Laparotomy or laparoscopy may be indicated in cases of drainage failure, multiloculated abscesses, or when extensive necrotic tissue debridement is required. In Brazil, data from the Ministry of Health show that complicated intra-abdominal infections are one of the leading causes of emergency hospital admissions. The growing prevalence of chronic diseases, such as diabetes and cirrhosis, increases the number of PLA cases, demanding that surgeons stay updated on the most effective therapeutic approaches.
Key Points
- Early Diagnosis: Imaging, especially contrast-enhanced CT, is crucial for identifying the size and location of liver abscesses.
- Surgical Intervention: Multiloculated or abscesses larger than 5 cm often require surgical intervention, especially if percutaneous drainage fails.
- Minimally Invasive Approach: Laparoscopy offers a less invasive alternative to open surgery, leading to faster recovery in specific cases.
- Comprehensive Digestive Surgeon Role: Surgical expertise is vital in managing large, multiloculated, or complicated abscesses, ensuring an effective and personalized approach.
Conclusion
The treatment of pyogenic liver abscess requires a multidisciplinary approach, with the digestive surgeon playing a crucial role in managing complex cases. The decision between percutaneous drainage and surgery depends on multiple factors, including abscess size, clinical response, and the patient’s overall condition. Technical expertise and precise surgical judgment are key to ensuring successful treatment outcomes.
As Henri Bismuth wisely stated: “Le traitement chirurgical n’est pas seulement une question de technique, mais de jugement. Le moment de l’intervention est aussi important que l’intervention elle-même.”
Liked it? Leave us a comment ✍️, share on social media, or send your question through 💬 Chat Online in our Instagram DM.
#LiverAbscess #DigestiveSurgery #AbscessTreatment #PercutaneousDrainage #HepaticAbscess
Tratamento da Colecistite Gangrenosa
Abordagem Cirúrgica e Opções Técnicos
A colecistite gangrenosa (CG) é uma complicação grave e rara da colecistite aguda, resultando em necrose da parede da vesícula biliar. Pacientes com múltiplas comorbidades, como diabetes e doenças cardiovasculares, são particularmente suscetíveis, com uma prevalência maior em idosos e homens. Este artigo explora o tratamento da colecistite gangrenosa, com ênfase na abordagem cirúrgica e nos desafios intraoperatórios.
Introdução
A colecistite gangrenosa ocorre devido à hipoperfusão da vesícula biliar, seja por obstrução aguda do ducto cístico ou por doenças arteriais, como a ateromatose da artéria cística. Essa obstrução leva a isquemia e posterior necrose da parede vesicular, culminando em complicações sérias, como perfuração e sepse. A rápida evolução para choque séptico exige diagnóstico e tratamento precoce. No Brasil, os casos de colecistite aguda são frequentes, mas as formas gangrenosas representam uma minoria, embora com alta mortalidade, especialmente em pacientes idosos e com doenças associadas. Em muitos centros, a mortalidade associada à CG pode chegar a 15%, sendo crucial que os cirurgiões digestivos estejam preparados para manejar essa condição.
Propedêutica Cirúrgica
O diagnóstico da colecistite gangrenosa é desafiador, uma vez que os sintomas muitas vezes se sobrepõem aos da colecistite aguda. Os pacientes apresentam dor no quadrante superior direito, febre e leucocitose significativa. A ultrassonografia frequentemente revela espessamento da parede vesicular e fluido pericolecístico, mas não consegue distinguir de forma confiável a forma gangrenosa da colecistite comum. Sinais clínicos de piora rápida e a evolução para síndrome de resposta inflamatória sistêmica (SIRS) indicam a necessidade de intervenção urgente. A resposta ao tratamento inicial, incluindo reposição volêmica e antibioticoterapia de amplo espectro, deve ser monitorada de perto. Quando a condição do paciente não melhora rapidamente, a intervenção cirúrgica é indicada.
Aplicação na Cirurgia Digestiva
A cirurgia de escolha para colecistite gangrenosa é a colecistectomia, sendo a laparoscopia o método preferido em centros com experiência em cirurgia minimamente invasiva. No entanto, a taxa de conversão para cirurgia aberta pode chegar a 75% em casos de CG, devido à presença de aderências densas, necrose ou dificuldade em visualizar as estruturas anatômicas cruciais, como o ducto biliar comum e a artéria cística.
Técnicas Cirúrgicas
- Abordagem convencional: A colecistectomia começa com a dissecção cuidadosa do triângulo de Calot, usando tração e contra-tração para melhor visualização. Deve-se evitar a dissecção agressiva da vesícula, especialmente quando há risco de perfuração, para minimizar a contaminação da cavidade abdominal com bile purulenta.
- Abordagem top-down: Em casos de inflamação severa, uma abordagem “fundus-first” pode ser adotada, dissecando a vesícula do fundo até a placa cística, o que pode reduzir o risco de lesões aos ductos biliares principais.
- Colecistectomia subtotal: Quando a inflamação ou necrose impede a dissecção segura, uma colecistectomia subtotal pode ser realizada. Embora essa abordagem evite lesões vasculares e biliares, ela pode estar associada a complicações tardias, como retenção de cálculos no coto cístico e necessidade de reintervenção.
Pontos-chave
- Risco aumentado: Pacientes com colecistite gangrenosa têm risco significativamente maior de morbidade e mortalidade, com taxas de conversão para cirurgia aberta superiores a 50%.
- Preferência pela colecistectomia: Embora a drenagem percutânea da vesícula possa ser uma opção temporária para pacientes com alto risco cirúrgico, a colecistectomia continua sendo o tratamento definitivo para CG, pois remove a fonte de infecção.
- Técnica laparoscópica: A laparoscopia é preferida quando viável, mas a conversão para laparotomia deve ser considerada precocemente quando houver dificuldades técnicas ou risco de lesão aos ductos biliares.
- Importância da colangiografia: Em casos de anatomia duvidosa ou inflamação grave, a colangiografia intraoperatória pode ajudar a definir as estruturas anatômicas e prevenir lesões aos ductos biliares.
Conclusão Aplicada à Prática do Cirurgião Digestivo
A colecistite gangrenosa representa um desafio considerável para cirurgiões digestivos, especialmente em pacientes idosos e com múltiplas comorbidades. A identificação precoce e a intervenção cirúrgica apropriada são cruciais para melhorar os resultados clínicos. Embora a colecistectomia laparoscópica seja ideal, a alta taxa de conversão para a técnica aberta demonstra a complexidade do procedimento. O manejo adequado da CG exige uma equipe cirúrgica experiente e a capacidade de tomar decisões intraoperatórias rápidas para minimizar as complicações.
“Não existe cálculo biliar inocente.”
– Charles Mayo (1865-1939)
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#colecistitegangrenosa
#cirurgiadigestiva
#colecistectomiaminimamenteinvasiva
#urgenciascirurgicas
#saudedigestiva
Tratamento da Coledocolitíase no Paciente com Bypass Gástrico
Abordagens Cirúrgicas e Opções Técnicas
A coledocolitíase, caracterizada pela presença de cálculos no ducto biliar comum (CBD), é uma complicação potencialmente grave que pode causar icterícia obstrutiva, pancreatite e colangite. Em pacientes que realizaram o bypass gástrico em Y-de-Roux, o tratamento dessa condição se torna mais complexo devido às alterações anatômicas decorrentes da cirurgia bariátrica, tornando o acesso ao ducto biliar pelo método endoscópico tradicional (CPRE) um desafio significativo.
Introdução
O bypass gástrico em Y-de-Roux é um dos procedimentos mais realizados no tratamento da obesidade mórbida, resultando em perda de peso significativa e, consequentemente, em uma maior prevalência de cálculos biliares. No entanto, as alterações anatômicas criadas por esse procedimento, como a separação do estômago proximal do restante do trato gastrointestinal, impedem o acesso ao ducto biliar pelo estômago convencional. Nesse contexto, o manejo da coledocolitíase, que afeta até 18% dos pacientes submetidos à colecistectomia, exige uma abordagem multidisciplinar e técnicas cirúrgicas e endoscópicas inovadoras.
Propedêutica Cirúrgica
O diagnóstico e o manejo da coledocolitíase em pacientes com bypass gástrico podem ser desafiadores, pois o acesso ao ducto biliar comum por vias endoscópicas tradicionais é inviável. Nestes casos, a apresentação clínica pode variar de sintomas leves de icterícia a quadros graves de colangite ascendente.
Para a avaliação inicial, a ultrassonografia abdominal continua sendo o exame de escolha para identificar dilatação do ducto biliar e a presença de cálculos. No entanto, devido à complexidade anatômica, exames como a colangiopancreatografia por ressonância magnética (MRCP) são frequentemente necessários para fornecer uma visão mais detalhada da anatomia do trato biliar.
Uma vez confirmado o diagnóstico de coledocolitíase, o tratamento deve ser instituído rapidamente, a fim de evitar complicações como abscessos hepáticos ou pancreatite biliar. As opções terapêuticas variam dependendo da gravidade da apresentação clínica e da disponibilidade de recursos no centro de tratamento. Para pacientes com colangite ascendente, por exemplo, a descompressão urgente do ducto biliar é necessária. Nestes casos, o uso de técnicas minimamente invasivas, como a colangiografia trans-hepática percutânea (PTC), pode ser a melhor alternativa quando a CPRE não é viável.
Em pacientes estáveis, várias abordagens cirúrgicas são possíveis. Uma técnica amplamente utilizada é a colecistectomia laparoscópica assistida por CPRE transgástrica. Nesse procedimento, um acesso cirúrgico é feito no estômago excluído do paciente, permitindo que o endoscópio seja inserido diretamente na papila duodenal, facilitando a remoção dos cálculos e a descompressão do ducto biliar.
Aplicação na Cirurgia Digestiva
A cirurgia digestiva avançada em pacientes com bypass gástrico exige um planejamento cuidadoso e uma abordagem técnica que considere as alterações anatômicas decorrentes da cirurgia bariátrica. As seguintes estratégias têm sido eficazes no manejo da coledocolitíase nesses pacientes:
- ERCP assistida por laparoscopia: Esse procedimento permite o acesso ao trato biliar usando técnicas combinadas de laparoscopia e endoscopia. A transposição do endoscópio pelo estômago excluído oferece uma alternativa eficiente para a remoção dos cálculos, com baixa taxa de complicações.
- Colangiografia trans-hepática percutânea (PTC): Em pacientes instáveis ou com contraindicações para procedimentos invasivos, a PTC é uma alternativa valiosa para a descompressão biliar emergente. Essa técnica minimamente invasiva pode ser associada à dilatação do esfíncter de Oddi para expulsar os cálculos.
- Exploração cirúrgica do ducto biliar comum: Em casos complexos, onde as técnicas minimamente invasivas falham, a exploração laparoscópica ou aberta do ducto biliar pode ser necessária. A abordagem transcística ou a coledocotomia são opções viáveis, dependendo da localização e do tamanho dos cálculos. A utilização de cateteres tipo Fogarty ou cestas de Dormia pode ser útil para a remoção dos cálculos.
- Técnicas reconstrutivas: Para pacientes com múltiplos cálculos biliares ou complicações, a realização de anastomoses biliodigestivas, como a coledocoduodenostomia ou a hepaticojejunostomia em Y-de-Roux, pode ser considerada. Essas abordagens proporcionam um alívio duradouro, evitando futuros episódios de obstrução.
Pontos-chave
- Pacientes com bypass gástrico em Y-de-Roux apresentam desafios únicos no tratamento da coledocolitíase devido à anatomia alterada do trato digestivo.
- A ERCP tradicional é inviável nesses pacientes, sendo substituída por abordagens combinadas, como a ERCP transgástrica assistida por laparoscopia ou a PTC.
- A ultrassonografia e a MRCP são ferramentas essenciais para o diagnóstico, enquanto a intervenção cirúrgica deve ser cuidadosamente planejada, considerando as condições clínicas e anatômicas do paciente.
- Em centros especializados, as taxas de sucesso com essas abordagens minimamente invasivas são altas, com complicações graves ocorrendo em menos de 10% dos casos.
Conclusão Aplicada à Prática do Cirurgião Digestivo
O tratamento da coledocolitíase em pacientes submetidos ao bypass gástrico representa um desafio técnico significativo, exigindo conhecimento especializado em cirurgia digestiva avançada e endoscopia. A abordagem ideal deve ser individualizada, considerando a condição clínica do paciente e as habilidades da equipe cirúrgica. As técnicas minimamente invasivas, como a ERCP assistida por laparoscopia, são as preferidas quando viáveis, mas o cirurgião deve estar preparado para realizar intervenções mais complexas, como a coledocotomia ou anastomoses biliodigestivas, quando necessário.
Nas palavras do cirurgião Steven Strasberg, “O sucesso na cirurgia hepato-biliar depende não apenas da habilidade técnica, mas também da capacidade de adaptar-se às circunstâncias anatômicas e clínicas únicas de cada paciente.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#coledocolitiase
#bypassgastrico
#cirurgiabariatrica
#cirurgiadigestiva
#cprefalha
Tratamento da Colelitíase no Paciente Cirrótico
Desafios e Abordagens Cirúrgicas
A colelitíase, ou presença de cálculos na vesícula biliar, é uma condição comum em cirróticos, mas seu manejo cirúrgico apresenta desafios únicos devido às complicações inerentes à cirrose e à hipertensão portal. A cirurgia, neste contexto, exige uma abordagem criteriosa para minimizar riscos e maximizar a segurança do paciente. Este artigo destina-se a estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, com o objetivo de fornecer uma visão abrangente sobre o tratamento da colelitíase no paciente cirrótico, destacando as melhores práticas, evidências científicas e diretrizes atuais.
Introdução
A cirrose é uma condição crônica que afeta severamente a função hepática e está associada a um aumento expressivo da morbidade e mortalidade perioperatória. No Brasil, a cirrose hepática é responsável por 10 mil óbitos anuais, segundo o Ministério da Saúde, o que reforça a importância do seu manejo adequado, sobretudo em contextos cirúrgicos. A prevalência de colelitíase em pacientes cirróticos pode chegar a 30%, sendo que esses pacientes estão sujeitos a complicações graves, como a hipertensão portal e a coagulopatia, que complicam a realização de uma colecistectomia.
Portanto, ao tratar a colelitíase em pacientes com cirrose, é fundamental um planejamento cirúrgico cuidadoso e uma consideração detalhada dos riscos associados. O objetivo deste artigo é discutir as opções de tratamento para colelitíase em cirróticos, com ênfase nas abordagens cirúrgicas e estratégias para otimizar a segurança e os resultados.
Colecistectomia x Cirrose Hepática
Pacientes com cirrose hepática apresentam risco aumentado de complicações cirúrgicas, em parte devido à hipertensão portal, varizes perivesiculares, coagulopatia e distorção anatômica do fígado. A avaliação pré-operatória inclui a classificação do paciente pelo escore Child-Pugh ou MELD (Model for End-stage Liver Disease), que ajudam a prever a mortalidade pós-operatória. Um escore MELD acima de 14, por exemplo, indica um risco significativo de mortalidade após procedimentos cirúrgicos.
A colecistectomia é a principal intervenção cirúrgica para o tratamento da colelitíase, e a via laparoscópica é preferida, sempre que possível, devido aos seus benefícios em comparação com a abordagem aberta. Estudos mostram que a colecistectomia laparoscópica (LC) em pacientes cirróticos está associada a menor perda de sangue, menos infecções de ferida e internação hospitalar mais curta. No entanto, o risco de complicações, como hemorragia, é cerca de 20% maior em comparação com pacientes sem cirrose.
Em pacientes cirróticos com colecistite aguda, a situação torna-se ainda mais delicada. Nestes casos, o manejo não operatório inicial é preferível, incluindo o uso de antibióticos e drenagem percutânea da vesícula biliar (colecistostomia), especialmente para pacientes com cirrose avançada (Child-Pugh C ou MELD elevado). Caso a condição clínica do paciente melhore com o manejo não cirúrgico, uma colecistectomia eletiva pode ser planejada após seis semanas, garantindo uma melhor estabilidade hemodinâmica e recuperação hepática.
Aplicação na Cirurgia Digestiva
No contexto da cirurgia digestiva, a principal abordagem para pacientes cirróticos com colelitíase é a colecistectomia laparoscópica. A técnica laparoscópica oferece vantagens significativas em comparação com a abordagem aberta, como menor trauma cirúrgico, recuperação mais rápida e menor taxa de infecção. Contudo, devido à complexidade anatômica causada pela cirrose e presença de varizes, a dissecção deve ser realizada com extremo cuidado, evitando a manipulação excessiva da área do triângulo de Calot, onde as varizes são comuns.
Em casos de inflamação severa ou varizes pericolecísticas, a abordagem de colecistectomia subtotal pode ser preferida. Esta técnica permite remover a maior parte da vesícula, minimizando o risco de sangramento catastrófico que pode ocorrer durante a dissecção em áreas com hipertensão portal. O uso de dispositivos de energia para selar vasos sanguíneos e técnicas de hemostasia avançadas, como o uso de cola de fibrina e selantes de celulose, são fundamentais para evitar sangramentos.
Outro ponto relevante é a necessidade de otimização médica pré-operatória. Cirróticos devem ter a coagulopatia corrigida antes da cirurgia, com a administração de vitamina K e, em alguns casos, plasma fresco congelado. A função renal e cardíaca também deve ser monitorada rigorosamente, e a presença de ascite deve ser manejada com diuréticos. Em centros de referência, o uso de octreotida intravenosa para reduzir a pressão portal pode ser considerado.
Pontos-chave
- Risco aumentado: A cirrose aumenta significativamente a mortalidade cirúrgica, com uma taxa de até 60% em pacientes com Child-Pugh C.
- Abordagem laparoscópica: A colecistectomia laparoscópica é a abordagem preferida, com menor morbidade em comparação com a cirurgia aberta.
- Manejo não cirúrgico inicial: Em pacientes com colecistite aguda e alto risco cirúrgico, drenagem percutânea deve ser considerada antes de uma intervenção cirúrgica definitiva.
- Técnicas hemostáticas avançadas: O uso de dispositivos de energia e hemostáticos auxiliares é crucial para minimizar o risco de sangramento intraoperatório.
- Avaliação pré-operatória cuidadosa: A classificação Child-Pugh e o escore MELD são essenciais para prever a mortalidade e determinar a melhor abordagem terapêutica.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
O tratamento da colelitíase no paciente cirrótico exige uma abordagem individualizada e multidisciplinar. A escolha da intervenção, seja ela cirúrgica ou não, deve considerar a gravidade da doença hepática, a presença de complicações associadas e as habilidades técnicas do cirurgião. No Brasil, onde a cirrose é uma causa frequente de morbidade, é crucial que cirurgiões e equipes médicas sejam bem treinados para manejar essas situações com a maior segurança possível.
A colecistectomia laparoscópica permanece o padrão-ouro no manejo da colelitíase, mas cirurgiões devem estar preparados para adaptar suas técnicas e, quando necessário, optar por abordagens alternativas, como a colecistectomia subtotal. Além disso, a otimização pré-operatória e a correção das disfunções fisiológicas são fundamentais para reduzir complicações e melhorar os desfechos cirúrgicos.
Como afirmou Steven Strasberg, “A dissecção cuidadosa do triângulo de Calot e o uso de abordagens alternativas em cirurgias de risco são elementos essenciais para o sucesso cirúrgico em pacientes com complicações hepáticas.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
O Papel da CPRE no Tratamento da Pancreatite Aguda Biliar
A colangiopancreatografia retrógrada endoscópica (CPRE) tem sido estudada como uma potencial intervenção para reduzir a gravidade da pancreatite aguda biliar (AP). Contudo, diversas pesquisas sugerem que seu benefício é limitado a cenários clínicos específicos. Este artigo tem como objetivo explorar o papel da CPRE na pancreatite biliar, com base nas evidências mais recentes.
CPRE na Pancreatite Biliar Leve
Para pacientes com pancreatite biliar leve, estudos demonstram que a CPRE não traz benefícios significativos na redução da gravidade ou complicações da doença. Um estudo multicêntrico randomizado não encontrou vantagens na realização de CPRE urgente com esfinterotomia em comparação ao manejo conservador nesses pacientes.88,101 Portanto, a intervenção precoce com CPRE não é recomendada para casos de pancreatite biliar leve, com a prática de manejo conservador prevalecendo como a mais indicada.
CPRE na Pancreatite Biliar Grave
A CPRE também foi avaliada em pacientes com pancreatite biliar grave, mas os resultados não sustentam seu uso de rotina. Em um ensaio clínico multicêntrico, pacientes com pancreatite biliar grave, sem sinais de colangite, foram submetidos a CPRE urgente com esfinterotomia versus manejo conservador. Os resultados mostraram que a CPRE urgente não reduziu significativamente as complicações principais ou a mortalidade (38% no grupo CPRE vs 44% no grupo conservador).102 Esses achados indicam que, em pacientes com pancreatite biliar grave, sem colangite, o manejo conservador deve ser preferido.
Em outro estudo, os pesquisadores avaliaram a CPRE em pacientes com pancreatite grave e confirmação de cálculos ou lama biliar no ducto biliar comum por ultrassonografia endoscópica (EUS). Os resultados, novamente, mostraram que a CPRE com esfinterotomia não reduziu a mortalidade ou as principais complicações em comparação ao tratamento conservador em seis meses.103
Indicações Atuais da CPRE na Pancreatite Biliar
Com base nas evidências disponíveis, as diretrizes atuais recomendam que a CPRE não seja realizada de forma rotineira em casos de pancreatite biliar, independentemente da gravidade, na ausência de colangite.23
Contudo, a CPRE tem um papel crucial em dois cenários específicos:
- Colangite associada à pancreatite: A CPRE deve ser realizada urgentemente quando há suspeita ou confirmação de colangite concomitante.
- Coledocolitíase sintomática ou persistente: Nos casos de cálculos biliares no ducto biliar comum (coledocolitíase) que causam sintomas persistentes ou em pacientes sem resolução espontânea da obstrução, a CPRE é indicada eletivamente.
Conclusões
A CPRE tem um papel limitado no manejo da pancreatite biliar, sendo indicada apenas em casos de colangite ou coledocolitíase sintomática. Nos demais casos, o manejo conservador é preferível, conforme demonstrado por estudos recentes e as diretrizes atuais. Com esses achados, a CPRE deve ser utilizada de forma seletiva e com base em critérios clínicos rigorosos, evitando o uso desnecessário dessa intervenção em pacientes que podem ser manejados de forma conservadora.
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CPRE #PancreatiteAguda #TratamentoPancreatite #Colangite #Coledocolitiase
Tratamento Cirúrgico da Pancreatite Aguda Biliar
Momento Ideal da Colecistectomia e Manejo da Necrose Pancreática Infectada
A pancreatite aguda biliar é uma condição inflamatória potencialmente grave, resultante da obstrução temporária ou permanente do ducto biliar por cálculos. A sua prevalência é significativa, sendo uma das causas mais comuns de pancreatite aguda em países como o Brasil, com uma incidência estimada de até 40% dos casos de pancreatite. O manejo cirúrgico desta doença, especialmente em casos complicados como a necrose pancreática infectada, é um desafio que requer decisões cuidadosas e multidisciplinares. Este artigo tem como objetivo educar estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo sobre os princípios fundamentais do tratamento cirúrgico da pancreatite aguda biliar, com ênfase na colecistectomia e no manejo da necrose pancreática infectada.
Momento da Colecistectomia
A colecistectomia é o tratamento definitivo para a pancreatite biliar, pois remove a causa subjacente: os cálculos biliares. O momento ideal para realizar a colecistectomia em pacientes com pancreatite biliar aguda é uma decisão crucial, com implicações significativas para o prognóstico e o risco de complicações.
Nos casos de pancreatite biliar leve, a literatura recomenda fortemente a realização da colecistectomia durante a mesma internação hospitalar. Estudos demonstram que esta abordagem reduz significativamente o risco de novos episódios de pancreatite ou outras complicações relacionadas aos cálculos biliares. Um ensaio clínico multicêntrico relatou que 17% dos pacientes que tiveram a colecistectomia adiada experimentaram complicações relacionadas à presença de cálculos, em comparação com apenas 5% dos pacientes que realizaram a cirurgia durante a mesma internação. Além disso, não houve aumento nas taxas de complicações cirúrgicas naqueles submetidos à colecistectomia precoce.
Em pacientes com pancreatite moderadamente grave ou grave, o manejo é mais complexo. Diretrizes internacionais e especialistas recomendam que a colecistectomia seja adiada até que o paciente tenha se recuperado completamente e eventuais coleções líquidas pancreáticas ou necrose tenham se resolvido. No Brasil, os dados mostram que aproximadamente 10% a 20% dos pacientes com pancreatite aguda evoluem para formas mais graves com necrose, exigindo uma abordagem mais conservadora e cuidadosa. Um estudo retrospectivo indicou que a realização da colecistectomia antes de 8 a 10 semanas pode reduzir o risco de recorrência de eventos biliares sem aumentar o risco de complicações.
Indicações do Manejo Cirúrgico da Necrose Pancreática Infectada
A necrose pancreática, que ocorre em cerca de 10% a 20% dos casos de pancreatite aguda, é uma complicação grave que pode levar à infecção em aproximadamente um terço dos pacientes. A presença de necrose infectada está associada a altas taxas de morbidade e mortalidade, com estudos demonstrando uma mortalidade de 36% a 49,5% em pacientes com falência orgânica primária e necrose sobreposta infectada.
O manejo da necrose pancreática infectada tem evoluído significativamente nas últimas décadas. A abordagem minimamente invasiva em etapas é atualmente considerada a via preferida de tratamento, em oposição à cirurgia aberta tradicional, devido a menores taxas de complicações e mortalidade. Esta abordagem começa com a drenagem percutânea direcionada, seguida por procedimentos como drenagem transmural endoscópica e necrosectomia endoscópica direta, se necessário. Nos casos mais complexos, onde essas medidas não são eficazes, pode-se recorrer a desbridamento cirúrgico minimamente invasivo, que inclui técnicas como a necrosectomia retroperitoneal videoassistida.
A escolha da técnica e o momento da intervenção dependem da extensão da necrose, da presença de infecção e das condições clínicas do paciente. Em geral, a intervenção invasiva deve ser adiada por pelo menos 4 semanas após o início da pancreatite para permitir que a necrose se delimite (necrose encapsulada). Em pacientes gravemente doentes, com infecção progressiva ou falência de múltiplos órgãos, intervenções precoces podem ser consideradas, embora estudos recentes sugiram que o adiamento da drenagem pode reduzir a necessidade de múltiplas intervenções.
Pontos-Chave e Conclusões Aplicadas à Prática do Cirurgião Digestivo
- Colecistectomia Precoce em Pancreatite Biliar Leve: A colecistectomia na mesma internação reduz a recorrência de eventos biliares e não aumenta as complicações cirúrgicas. Este é o manejo recomendado para pacientes com pancreatite biliar leve.
- Adiar a Colecistectomia em Casos Graves: Em pacientes com pancreatite moderadamente grave ou grave, o adiamento da colecistectomia até a resolução de coleções ou necrose é indicado, geralmente em um intervalo de 8 a 10 semanas.
- Manejo Minimamente Invasivo da Necrose Pancreática Infectada: A abordagem em etapas minimamente invasiva deve ser priorizada, começando com drenagem percutânea. A intervenção cirúrgica deve ser reservada para casos refratários ou com deterioração clínica, com preferências por técnicas menos invasivas.
- Intervenção Invasiva Oportuna: O momento da intervenção deve ser cuidadosamente avaliado, com um atraso de pelo menos 4 semanas sendo o ideal para permitir a formação de necrose encapsulada. No entanto, intervenções precoces podem ser necessárias em casos críticos.
O manejo da pancreatite aguda biliar exige uma equipe multidisciplinar experiente e a consideração cuidadosa das condições clínicas do paciente. Cirurgiões do aparelho digestivo devem estar cientes das evidências mais recentes para otimizar os resultados cirúrgicos e minimizar complicações. Como disse William Osler, um dos grandes médicos da história: “A prática da medicina é uma arte, baseada na ciência.” A tomada de decisões cirúrgicas no manejo da pancreatite biliar reflete esta delicada interação entre arte e ciência, onde a experiência clínica e o julgamento são essenciais para alcançar os melhores resultados.
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#PancreatiteAguda #TratamentoCirúrgico #Colecistectomia #NecrosePancreática #CirurgiaDigestiva
Cirurgia Bariátrica na Prevenção do Câncer de Mama
Impactos e Implicações para a Prática do Cirurgião Digestivo
A cirurgia bariátrica tem se destacado não apenas como uma opção eficaz no tratamento da obesidade mórbida, mas também na prevenção de diversas comorbidades associadas, incluindo o câncer de mama. Estudos recentes apontam que essa intervenção cirúrgica, amplamente realizada no Brasil, pode reduzir de forma significativa o risco de desenvolvimento do câncer de mama em mulheres obesas. Este texto tem como objetivo revisar as evidências científicas que relacionam a cirurgia bariátrica à prevenção do câncer de mama, destacando os mecanismos fisiológicos e os impactos práticos dessa abordagem para o cirurgião digestivo.
Introdução
A obesidade é um dos principais fatores de risco modificáveis para o câncer de mama, especialmente em mulheres pós-menopausa. No Brasil, o câncer de mama é o tipo mais comum entre as mulheres, representando cerca de 29,7% dos casos novos de câncer, segundo o Instituto Nacional de Câncer (INCA). A relação entre obesidade e câncer de mama ocorre por meio de múltiplos mecanismos, como o aumento da inflamação sistêmica, disfunção do tecido adiposo visceral e elevação dos níveis de insulina e estrógenos, que contribuem para o desenvolvimento e progressão tumoral. Nesse contexto, a cirurgia bariátrica emerge como uma intervenção preventiva, atuando na redução dos fatores de risco ao promover uma perda de peso sustentada e melhora das condições metabólicas.
Redução do Risco de Câncer de Mama
Estudos robustos indicam que a cirurgia bariátrica pode reduzir em até 49% o risco de câncer de mama em mulheres obesas. Uma meta-análise publicada na Surgery for Obesity and Related Diseases demonstrou que, em comparação com controles de peso semelhante, mulheres submetidas à cirurgia bariátrica apresentaram uma redução significativa na incidência de câncer de mama. A perda de peso substancial, aliada à melhora dos distúrbios metabólicos, reduz os níveis de inflamação sistêmica e limita a proliferação celular associada à carcinogênese.
Ademais, além de diminuir a incidência, há evidências que sugerem que a cirurgia bariátrica pode favorecer diagnósticos de câncer de mama em estágios mais precoces, o que tem implicações importantes para o prognóstico e a resposta ao tratamento oncológico. No Brasil, onde a obesidade afeta 25,9% da população adulta feminina, estratégias preventivas como a cirurgia bariátrica podem ter um impacto expressivo na saúde pública, reduzindo a carga de câncer de mama no país.
Mecanismos Fisiológicos
A cirurgia bariátrica promove a perda de peso significativa e melhora a síndrome metabólica, impactando diretamente nos mecanismos que ligam a obesidade ao câncer de mama. A diminuição da hiperinsulinemia, por exemplo, reduz a sinalização proliferativa mediada pela insulina, que favorece o crescimento de células tumorais. Outro fator importante é a redução da atividade da enzima aromatase, encontrada no tecido adiposo, que converte andrógenos em estrógenos e estimula o crescimento de tumores sensíveis a hormônios.
Além disso, a perda de tecido adiposo visceral após a cirurgia bariátrica diminui a liberação de citocinas pró-inflamatórias, como o fator de necrose tumoral-alfa (TNF-α) e a interleucina-6 (IL-6), que estão associadas à promoção do crescimento tumoral. A melhora no perfil inflamatório sistêmico pós-cirurgia contribui, portanto, para a redução do risco de desenvolvimento de câncer de mama.
Aplicação na Cirurgia Digestiva
Para o cirurgião do aparelho digestivo, entender a relação entre cirurgia bariátrica e prevenção do câncer de mama é fundamental na abordagem multidisciplinar de pacientes obesas. A decisão de indicar a cirurgia bariátrica deve levar em consideração não apenas os benefícios relacionados à perda de peso e controle de doenças metabólicas, mas também os potenciais ganhos em termos de prevenção oncológica. No Brasil, o número de cirurgias bariátricas cresceu significativamente, sendo realizadas mais de 100 mil cirurgias por ano, segundo a Sociedade Brasileira de Cirurgia Bariátrica e Metabólica (SBCBM). A utilização de procedimentos como o bypass gástrico e a gastrectomia vertical têm mostrado benefícios não apenas para a obesidade, mas também na redução do risco de câncer de mama, especialmente em pacientes com histórico familiar ou predisposição genética.
Pontos-chave para a Prática do Cirurgião Digestivo
- Seleção de Pacientes: A indicação de cirurgia bariátrica deve ser ponderada em mulheres obesas com fatores de risco adicionais para o câncer de mama, como histórico familiar e presença de síndrome metabólica.
- Acompanhamento Multidisciplinar: O cirurgião digestivo deve trabalhar em conjunto com oncologistas, endocrinologistas e ginecologistas para monitorar as pacientes pós-operatórias, otimizando a prevenção oncológica.
- Estudos Complementares: É essencial acompanhar as novas evidências que investigam o impacto da cirurgia bariátrica sobre o risco de diferentes tipos de câncer, incluindo o de mama, para uma prática baseada em evidências.
Conclusão
A cirurgia bariátrica apresenta benefícios amplamente documentados no tratamento da obesidade e suas complicações metabólicas. As evidências sugerem que essa intervenção também exerce um papel preventivo importante na redução do risco de câncer de mama, principalmente em mulheres com obesidade mórbida. Para o cirurgião digestivo, compreender essa relação pode ajudar na melhor indicação cirúrgica, oferecendo uma abordagem mais abrangente na promoção da saúde e na prevenção de doenças graves, como o câncer de mama.
Na prática diária, o cirurgião digestivo deve considerar a cirurgia bariátrica não apenas como uma ferramenta de controle de peso, mas também como uma intervenção com potenciais benefícios oncológicos, especialmente em pacientes obesas de alto risco. A vigilância contínua, o acompanhamento rigoroso e a atuação em equipes multidisciplinares são cruciais para garantir os melhores desfechos.
Como afirmou Halsted: “A cirurgia preventiva pode não apenas salvar vidas, mas também proporcionar uma qualidade de vida superior ao eliminar os riscos antes que eles se materializem.”
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #cirurgiabariátrica #câncerdemama #prevençãodecâncer #obesidadeemulheres #cirurgiãodigestivo
Como Eu Trato Colelitíase e Suas Complicações
Um Guia Prático para Estudantes de Medicina e Residentes de Cirurgia
A colelitíase, ou a formação de cálculos biliares na vesícula, é uma condição amplamente prevalente, especialmente no contexto do aumento da síndrome metabólica e do envelhecimento populacional. Cerca de 10% a 20% da população adulta pode desenvolver cálculos biliares, embora apenas 20% dessa população apresente sintomas ou complicações. Com mais de 1,2 milhões de colecistectomias realizadas anualmente nos Estados Unidos, a cirurgia continua sendo o tratamento padrão para colelitíase sintomática, com complicações potencialmente graves como a colecistite aguda, colangite e pancreatite biliar. No Brasil, estudos epidemiológicos indicam que a colelitíase afeta cerca de 15% da população adulta.
Introdução
A colelitíase se refere à formação de cálculos biliares no trato biliar, com maior prevalência na vesícula biliar. Esta condição pode ser assintomática ou associada a dor abdominal, chamada cólica biliar. A maioria dos pacientes permanece assintomática, mas, em alguns casos, podem surgir complicações graves, como colecistite aguda, colangite ou pancreatite. A escolha do tratamento depende da presença ou ausência de sintomas e complicações.
Diagnóstico e Classificação
O diagnóstico de colelitíase frequentemente é feito incidentalmente por ultrassonografia abdominal. Para pacientes com sintomas, a ultrassonografia tem uma acurácia de cerca de 95% na detecção de cálculos. Além disso, em casos mais complicados, exames como a colangiopancreatografia por ressonância magnética (CPRM) e a colangiopancreatografia retrógrada endoscópica (CPRE) podem ser usados para detectar cálculos no ducto biliar comum.
A classificação das complicações da colelitíase inclui:
- Colecistite aguda: Inflamação da vesícula biliar, geralmente causada por obstrução do ducto cístico por cálculos.
- Colangite: Infecção bacteriana da via biliar, associada à obstrução biliar.
- Pancreatite biliar: Inflamação do pâncreas causada por cálculos impactados no ducto biliar.
- Coledocolitíase: Presença de cálculos no ducto biliar comum.
Aplicação na prática da Cirurgia Digestiva
O manejo cirúrgico da colelitíase varia de acordo com a apresentação clínica do paciente. Para pacientes assintomáticos, a colecistectomia profilática não é indicada, exceto em casos de risco elevado, como na presença de vesícula em porcelana (associada ao câncer de vesícula biliar).
- Colelitíase sintomática: A abordagem cirúrgica padrão é a colecistectomia laparoscópica, preferencialmente realizada nas primeiras 72 horas após o início dos sintomas em casos de colecistite aguda. A colecistectomia tem uma taxa de mortalidade inferior a 1%, sendo extremamente eficaz na resolução dos sintomas.
- Coledocolitíase: Pacientes com coledocolitíase podem requerer uma abordagem multimodal, combinando a CPRE para remoção de cálculos no ducto biliar e colecistectomia subsequente. A laparoscopia também pode ser utilizada para explorar o ducto biliar comum, permitindo a retirada dos cálculos.
- Pancreatite biliar: A pancreatite causada por cálculos biliares requer estabilização inicial do paciente, com reposição volêmica e analgesia. A colecistectomia deve ser realizada na mesma internação para prevenir recorrências, exceto em casos de pancreatite grave com necrose pancreática, onde o cirurgião deve aguardar até a resolução do quadro inflamatório.
- Tratamento de emergência: Casos de colangite e pancreatite biliar requerem intervenção imediata, com drenagem biliar emergente via CPRE ou drenagem percutânea seguida de colecistectomia, dependendo do estado clínico do paciente.
Em casos mais raros, como a síndrome de Mirizzi ou o íleo biliar, intervenções complexas são necessárias. A síndrome de Mirizzi, caracterizada pela obstrução do ducto biliar comum por compressão extrínseca de um cálculo, pode requerer remoção cirúrgica e, às vezes, reconstrução da via biliar.
Pontos-Chave
- A ultrassonografia abdominal é o exame inicial mais adequado para o diagnóstico de colelitíase.
- A colecistectomia laparoscópica continua sendo o tratamento padrão para colelitíase sintomática e colecistite aguda.
- Pacientes com coledocolitíase e pancreatite biliar requerem uma abordagem multimodal, incluindo CPRE e colecistectomia.
- A colangite aguda é uma emergência médica e deve ser tratada com descompressão biliar urgente.
- No Brasil, estima-se que cerca de 15% dos adultos tenham colelitíase, com uma incidência crescente devido a fatores de risco como obesidade e diabetes.
Conclusão
O tratamento cirúrgico da colelitíase e suas complicações é bem estabelecido, com a colecistectomia laparoscópica sendo o padrão de tratamento para a maioria dos pacientes sintomáticos. Entretanto, é importante que os profissionais de saúde identifiquem as complicações precocemente e adaptem o tratamento à condição clínica do paciente. O uso da CPRE e da colecistectomia precoce reduzem significativamente as taxas de complicações graves, como pancreatite e colangite. Além disso, o manejo adequado da dor e o reconhecimento rápido das emergências, como a colangite, são essenciais para melhorar os desfechos clínicos.
Como o Dr. Steven Strasberg observou:
“A decisão cirúrgica em pacientes com doença do trato biliar deve ser orientada não apenas pelos achados de imagem, mas pela fisiopatologia subjacente e pelo quadro clínico individualizado.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
CirurgiaDigestiva #Colelitíase #TratamentoCirúrgico #PancreatiteBiliar #EducaçãoMédicaContinuada
Princípios Técnicos e Considerações Cirúrgicas no Tratamento do Câncer de Pâncreas
Introdução
O câncer de pâncreas representa um desafio significativo na cirurgia oncológica, com taxas de sobrevida em 5 anos de apenas 11% no Brasil, segundo dados do INCA. O tratamento cirúrgico de tumores pancreáticos borderline ressecáveis, em particular, exige habilidade técnica refinada e planejamento meticuloso. Este artigo abordará os princípios cirúrgicos e considerações técnicas essenciais para a realização bem-sucedida de pancreatectomias com ressecção e reconstrução venosa em casos de adenocarcinoma ductal pancreático (PDAC) borderline ressecável.
- O Espécime Deve Estar Cercado por Ar
Um princípio fundamental na cirurgia de PDAC borderline ressecável é garantir que o espécime esteja completamente mobilizado e “cercado por ar” antes de qualquer tentativa de ressecção venosa. Isso significa que o tecido pancreático envolvido deve estar livre de todas as estruturas adjacentes, exceto pelo envolvimento venoso. Para alcançar isso, técnicas de abordagem da artéria mesentérica superior (SMA) são cruciais. Duas abordagens comumente utilizadas são:
a) Abordagem retroperitoneal lateral: Envolve uma manobra de Kocher estendida para acessar a raiz da SMA.
b) Abordagem anterior supracólica: Acessa a porção pré-duodenal da SMA através de uma abordagem anterior.
A combinação dessas técnicas permite uma dissecção completa ao redor da SMA, isolando o espécime e facilitando uma ressecção segura.
- Isolamento Venoso Portal/Mesentérico Completo
O controle vascular é primordial para uma ressecção segura. O cirurgião deve obter controle de três áreas anatômicas principais:
a) Veia mesentérica superior (SMV) infrapancreática e seus ramos
b) Drenagem venosa do lado esquerdo (veia esplênica, veia coronária e veia mesentérica inferior)
c) Veia porta suprapancreática
O controle da SMV infrapancreática pode ser desafiador, especialmente quando o primeiro ramo jejunal está envolvido pelo tumor. Técnicas cuidadosas de dissecção e exposição são necessárias para evitar lesões vasculares significativas.
- Manutenção da Drenagem Venosa Mesentérica
A preservação do fluxo sanguíneo mesentérico é crucial para evitar complicações pós-operatórias graves. O cirurgião deve considerar a equação de Poiseuille ao planejar a reconstrução venosa, lembrando que pequenas reduções no raio do vaso podem aumentar significativamente a resistência ao fluxo. As opções de reconstrução incluem:
a) Venorrafia primária
b) Venorrafia com patch
c) Anastomose veno-venosa com ou sem enxerto de interposição
A escolha da técnica depende da extensão do envolvimento venoso e da anatomia individual do paciente.
- Manutenção da Drenagem Venosa do Lado Esquerdo
A preservação da drenagem venosa do baço e do estômago é essencial para evitar complicações como congestão gástrica ou ruptura esplênica. Se a veia esplênica precisar ser dividida, opções como shunt esplenorrenal podem ser consideradas para manter a drenagem adequada.
Aplicação na Cirurgia Digestiva:
Esses princípios técnicos são fundamentais não apenas para cirurgiões pancreáticos especializados, mas também para cirurgiões digestivos em geral. A compreensão dessas técnicas permite:
- Planejamento cirúrgico mais preciso
- Capacidade de lidar com situações inesperadas durante a cirurgia
- Melhoria nos resultados oncológicos e funcionais pós-operatórios
- Melhor avaliação pré-operatória de pacientes com PDAC borderline ressecável
Pontos-chave:
- O controle vascular meticuloso é essencial para uma cirurgia segura
- A mobilização completa do espécime antes da ressecção venosa é crucial
- A reconstrução venosa deve visar a manutenção do fluxo mesentérico fisiológico
- A preservação da drenagem venosa do lado esquerdo é importante para evitar complicações pós-operatórias
Conclusões:
A cirurgia para PDAC borderline ressecável é tecnicamente desafiadora, mas oferece a melhor chance de sobrevida para pacientes selecionados. No Brasil, onde o diagnóstico tardio ainda é comum, o domínio dessas técnicas avançadas é particularmente importante. Os cirurgiões digestivos devem buscar treinamento contínuo e experiência em centros de alto volume para aprimorar suas habilidades nessas cirurgias complexas. A colaboração multidisciplinar, incluindo radiologistas, oncologistas e cirurgiões vasculares, é fundamental para otimizar os resultados. À medida que avançamos no tratamento do câncer pancreático, a expertise técnica combinada com avanços em terapias neoadjuvantes e adjuvantes promete melhorar os resultados para pacientes com esta doença desafiadora.
CirurgiaPancreática #CâncerDePâncreas #TécnicaCirúrgica #CirurgiaOncológica #EducaçãoMédicaContinuada
“A cirurgia é como a vida: às vezes é necessário sacrificar um pouco para preservar o todo.” – William Stewart Halsted
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Acesso à Oncologia Cirúrgica no Brasil
Desafios e Oportunidades
Introdução
A oncologia cirúrgica desempenha um papel fundamental no tratamento de diversas neoplasias, especialmente no que diz respeito ao aparelho digestivo, onde tumores como os de esôfago, estômago e cólon são comuns. No Brasil, o acesso a serviços de oncologia cirúrgica varia significativamente entre as diferentes regiões do país, refletindo desigualdades socioeconômicas e estruturais. Este texto abordará a situação atual da oncologia cirúrgica no Brasil, analisando os desafios enfrentados e as oportunidades para melhorar o acesso e a qualidade do tratamento.
Contexto Atual da Oncologia Cirúrgica no Brasil
O Brasil enfrenta um cenário complexo em relação ao tratamento do câncer. De acordo com dados do Sistema de Informações sobre Mortalidade (SIM), entre 2002 e 2021, 82,3% das mortes por câncer ocorreram em hospitais, enquanto apenas 17,7% ocorreram em casa. Essa disparidade é alarmante, pois indica que muitos pacientes não estão recebendo o suporte necessário em suas últimas etapas de vida, refletindo a falta de um sistema robusto de cuidados paliativos e a dificuldade de acesso a tratamentos adequados. As regiões do Norte e Nordeste apresentam taxas significativamente mais altas de mortes em casa, com 30,2% e 24,8%, respectivamente, em comparação com 12,2% no Sudeste. Essa situação é agravada pela escassez de recursos e pela falta de equipes de saúde especializadas em cuidados paliativos, o que limita as opções de tratamento e suporte para os pacientes.
Desafios no Acesso à Oncologia Cirúrgica
Os principais desafios enfrentados na oncologia cirúrgica no Brasil incluem:
- Desigualdade Regional: As disparidades no acesso a serviços de saúde são evidentes, com as regiões mais pobres enfrentando dificuldades significativas em obter tratamento cirúrgico adequado. O Índice de Desenvolvimento Humano (IDH) das regiões está diretamente correlacionado com a taxa de mortes em casa, indicando que áreas com menor IDH tendem a ter menos acesso a cuidados de saúde adequados.
- Falta de Infraestrutura: Muitas unidades de saúde carecem de infraestrutura adequada para realizar procedimentos cirúrgicos complexos. Isso resulta em um número elevado de pacientes que não recebem tratamento cirúrgico oportuno, aumentando a mortalidade.
- Educação e Conscientização: A falta de informação sobre os sinais e sintomas do câncer e a importância do diagnóstico precoce contribui para que muitos pacientes busquem atendimento apenas em estágios avançados da doença.
Aplicação na Cirurgia Digestiva
Na cirurgia do aparelho digestivo, a intervenção precoce é crucial para melhorar os resultados e a sobrevida dos pacientes. A realização de cirurgias em estágios iniciais de câncer pode reduzir significativamente a mortalidade. Contudo, a realidade é que muitos pacientes chegam ao tratamento cirúrgico em estágios avançados, onde as opções são limitadas e os resultados são menos favoráveis. Estudos demonstram que a implementação de programas de triagem e educação em saúde pode aumentar a detecção precoce de cânceres digestivos, melhorando a taxa de sobrevivência e reduzindo as complicações associadas a intervenções tardias.
Pontos-Chave
- Desigualdade no Acesso: Há uma necessidade urgente de políticas públicas que abordem as disparidades regionais no acesso à oncologia cirúrgica.
- Educação em Saúde: Aumentar a conscientização sobre câncer e sua detecção precoce é vital para melhorar os resultados.
- Integração de Cuidados: A criação de uma rede de cuidados que inclua oncologia cirúrgica, cuidados paliativos e suporte psicológico pode melhorar a qualidade de vida dos pacientes.
Conclusões
O acesso à oncologia cirúrgica no Brasil é um desafio multifacetado que requer uma abordagem integrada e colaborativa. É fundamental que os cirurgiões digestivos, juntamente com outros profissionais de saúde, trabalhem para promover a conscientização, melhorar a infraestrutura e garantir que todos os pacientes tenham acesso a tratamentos adequados e oportunos. A implementação de políticas públicas focadas na equidade em saúde é essencial para transformar o cenário atual e garantir que todos os brasileiros tenham a oportunidade de receber cuidados de qualidade no tratamento do câncer. Como disse o renomado médico e filósofo Sir William Osler: “A medicina é uma ciência da incerteza e uma arte da probabilidade.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
oncologia #cirurgiadigestiva #acessoasaude #cancerdigestivo #saudepublica
Oncologia Cirúrgica
O que causa a Morte dos Pacientes com Câncer?
A mortalidade associada ao câncer é um tema complexo e multifacetado, que vai além da mera presença do tumor. Embora a frase “a metástase é responsável por 90% das mortes por câncer” seja frequentemente citada, essa afirmação simplifica uma realidade muito mais intrincada. Este texto visa explorar as causas de morte em pacientes com câncer, com foco nas implicações para a cirurgia do aparelho digestivo, proporcionando uma visão abrangente e educativa para estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Introdução
O câncer é uma das principais causas de mortalidade em todo o mundo, afetando milhões de pessoas anualmente. No Brasil, estima-se que as mortes por câncer representem cerca de 17% do total de óbitos, com a taxa de mortalidade aumentando à medida que a doença avança. A compreensão das causas de morte em pacientes oncológicos é essencial para o desenvolvimento de estratégias de tratamento mais eficazes e para a melhoria da qualidade de vida desses pacientes.
Causas Multifatoriais
As causas de morte em pacientes com câncer podem ser agrupadas em três categorias principais: eventos agudos, deterioração gradual e complicações associadas ao tratamento.
- Eventos Agudos: Muitas mortes ocorrem devido a eventos agudos, como tromboembolismo, que pode levar a falência respiratória ou cardíaca. A presença de metástases em órgãos vitais, como o cérebro e os pulmões, pode causar obstruções que resultam em morte súbita. Estudos mostram que até 50% das mortes por câncer podem ser atribuídas a essas causas agudas.
- Deterioração Gradual: A deterioração funcional de órgãos vitais é uma causa significativa de morte. Por exemplo, metástases no fígado podem levar à insuficiência hepática, enquanto a obstrução intestinal é comum em pacientes com câncer gastrointestinal. A deterioração do estado geral do paciente, frequentemente associada à caquexia, também contribui para o aumento da mortalidade.
- Complicações Associadas ao Tratamento: Os tratamentos oncológicos, embora essenciais, podem induzir complicações que afetam a saúde do paciente. A quimioterapia pode causar neutropenia, aumentando o risco de infecções graves. Dados indicam que infecções bacterianas, especialmente pneumonia, são causas comuns de morte em pacientes oncológicos, especialmente aqueles com câncer hematológico.
Aplicação na Cirurgia Digestiva
A cirurgia do aparelho digestivo desempenha um papel crucial no tratamento de muitos tipos de câncer, especialmente aqueles que afetam o trato gastrointestinal. No entanto, a compreensão das causas de morte associadas ao câncer é vital para os cirurgiões digestivos. Os cirurgiões devem estar cientes de que a mortalidade pode não resultar apenas da ressecção tumoral, mas também de complicações pós-operatórias, como infecções e falência de órgãos. A implementação de protocolos de cuidado pós-operatório e a monitorização rigorosa de sinais de complicações são essenciais para melhorar os resultados cirúrgicos.
Pontos-Chave
- Compreensão Multifatorial: A mortalidade em pacientes com câncer é influenciada por uma combinação de fatores, incluindo a localização do tumor, a presença de metástases e as condições de saúde pré-existentes.
- Intervenções Precoces: A identificação e o manejo precoce de complicações podem melhorar significativamente a qualidade de vida e a sobrevida dos pacientes.
- Importância da Pesquisa: A pesquisa contínua sobre as causas de morte em pacientes com câncer é fundamental para o desenvolvimento de novas estratégias terapêuticas e para a melhoria do cuidado ao paciente.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A análise das causas de morte em pacientes com câncer revela a complexidade do manejo oncológico e a necessidade de uma abordagem integrada. Cirurgiões do aparelho digestivo devem considerar não apenas a ressecção do tumor, mas também as complicações potenciais e as condições subjacentes que podem afetar a mortalidade. A educação contínua e a pesquisa são essenciais para aprimorar as práticas cirúrgicas e, assim, oferecer cuidados mais eficazes e humanizados aos pacientes com câncer.
A frase de Hipócrates, “A arte de curar vem da natureza, não do médico”, nos lembra da importância de compreender a biologia da doença e suas implicações no tratamento.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Câncer #CirurgiaDigestiva #TratamentoOncológico #Saúde #EducaçãoMédica
Desafios na Doação de Órgãos
Como a Recusa Familiar Afeta o Fila de Transplantes na Cirurgia Digestiva
A doação de órgãos é um dos pilares da medicina moderna, sendo essencial para salvar vidas e melhorar a qualidade de vida de pacientes com doenças terminais. No Brasil, o sistema de transplantes é robusto, ocupando o segundo lugar no mundo em número de transplantes realizados. No entanto, o processo de doação ainda enfrenta obstáculos significativos, principalmente no que diz respeito à aceitação familiar, que é um fator determinante para o sucesso dos programas de transplante. Este texto explora os principais desafios enfrentados na doação de órgãos, com foco nas implicações para a prática cirúrgica, particularmente na cirurgia do aparelho digestivo.
AVISE SEUS FAMILIARES!
A recusa familiar é um dos maiores desafios na doação de órgãos no Brasil. Dados da Associação Brasileira de Transplantes de Órgãos (ABTO) indicam que a recusa familiar chegou a 46% em 2022, um aumento significativo em relação a anos anteriores. As razões para essa recusa são multifatoriais e incluem desde a falta de conhecimento sobre o processo de doação até questões religiosas e culturais.
1. Falta de Informação e Compreensão sobre Morte Encefálica
Muitos familiares não compreendem completamente o conceito de morte encefálica, que é o diagnóstico necessário para a doação de órgãos. Este é um dos principais motivos de recusa, pois a ideia de que um paciente com sinais vitais como batimentos cardíacos e respiração (mecânica) possa estar legalmente morto é difícil de aceitar. Isso ressalta a importância de uma comunicação clara e eficaz por parte das equipes médicas.
2. Desconhecimento dos Desejos do Doador
Em muitos casos, os familiares não estão cientes dos desejos do potencial doador em vida. A falta de uma comunicação prévia sobre a vontade de doar órgãos coloca um grande peso sobre os familiares, que podem decidir pela recusa para evitar o sentimento de culpa ou arrependimento, acreditando que estão respeitando o que o ente querido desejaria.
3. Despreparo da Equipe Médica
O despreparo da equipe médica na abordagem dos familiares é outro fator crítico. Momentos de crise emocional, como a morte de um ente querido, requerem uma comunicação sensível e informada. A falta de um ambiente adequado e a ausência de apoio psicológico no momento da abordagem podem gerar desconfiança e até acusações de tráfico de órgãos, minando a confiança no sistema de saúde.
4. Influência de Crenças Religiosas
Embora nenhuma religião oficial se oponha à doação de órgãos, interpretações pessoais de textos religiosos frequentemente levam à recusa. A esperança de um “milagre” ou a crença de que a doação pode interferir na integridade do corpo na vida após a morte são razões comumente citadas pelos familiares.
Aplicação na Cirurgia Digestiva
Na área da cirurgia do aparelho digestivo, a doação de órgãos é fundamental para o transplante de órgãos como fígado, pâncreas e intestino. O aumento na recusa familiar afeta diretamente a disponibilidade desses órgãos, criando uma disparidade crescente entre a oferta e a demanda. Cirurgiões digestivos devem estar cientes dessas barreiras para melhor compreender os desafios do processo de doação e contribuir para estratégias que possam mitigar essas recusas. A compreensão desses fatores é crucial para que os cirurgiões possam apoiar a educação dos pacientes e suas famílias sobre a importância da doação de órgãos. Envolver-se em discussões multidisciplinares e colaborar com equipes de cuidados intensivos e de transplantes pode ajudar a melhorar a comunicação e, eventualmente, aumentar as taxas de aceitação.
Para mitigar a recusa dos familiares em relação à doação de órgãos, é importante implementar uma série de medidas que abordem as preocupações e dúvidas que podem surgir nesse momento delicado. Aqui estão 10 medidas eficazes:
- Educação e Conscientização: Promover campanhas de conscientização sobre a importância da doação de órgãos, esclarecendo os benefícios e o impacto positivo que essa ação pode ter na vida de outras pessoas.
- Comunicação Clara: Garantir que a equipe médica se comunique de forma clara e empática com os familiares, explicando o processo de doação e respondendo a todas as suas perguntas.
- Suporte Psicológico: Oferecer suporte psicológico aos familiares, ajudando-os a lidar com a perda e a entender melhor o processo de doação.
- Respeito ao Desejo do Doador: Incentivar os indivíduos a expressarem seus desejos sobre a doação de órgãos em vida, para que seus familiares possam respeitar essas vontades.
- Treinamento da Equipe Médica: Capacitar os profissionais de saúde para que abordem o tema da doação de forma sensível e respeitosa, evitando pressões indevidas.
- Apoio Familiar: Criar um ambiente onde outros membros da família possam apoiar a decisão de doar, ajudando a aliviar a carga emocional sobre o familiar que toma a decisão.
- Informação sobre a Morte Encefálica: Educar os familiares sobre o que significa a morte encefálica, para que compreendam a irreversibilidade da situação e a possibilidade de doação.
- Tempo Adequado para Decisão: Dar tempo suficiente para que os familiares processem a informação e tomem a decisão sem pressa, respeitando seu luto.
- Transparência no Processo: Garantir que os familiares estejam cientes de todas as etapas do processo de doação, incluindo a preservação dos órgãos e a logística envolvida.
- Apoio Religioso e Cultural: Considerar as crenças religiosas e culturais dos familiares, oferecendo informações que respeitem suas perspectivas e preocupações.
Essas medidas podem ajudar a aumentar a taxa de aceitação da doação de órgãos, promovendo um ambiente de respeito e compreensão durante um momento tão difícil.
Pontos-chave
- Falta de Informação: A desinformação sobre a morte encefálica e o processo de doação é um dos principais fatores de recusa.
- Desconhecimento dos Desejos do Doador: A ausência de uma conversa prévia sobre a doação entre o potencial doador e sua família contribui para a incerteza e recusa.
- Despreparo da Equipe Médica: A comunicação inadequada e a falta de apoio psicológico são barreiras significativas para a aceitação da doação.
- Influência Religiosa: As interpretações pessoais de textos religiosos frequentemente levam à recusa, apesar da posição oficial das religiões.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
Educar os pacientes e suas famílias, colaborar com equipes multidisciplinares e se engajar em práticas comunicativas eficazes são passos cruciais para superar essas barreiras. O aumento na aceitação da doação de órgãos não apenas salvará mais vidas, mas também melhorará a qualidade do tratamento oferecido aos pacientes que aguardam por transplantes.
“O transplante não é apenas sobre mover órgãos de uma pessoa para outra; é sobre restaurar a vida e a esperança para os pacientes e suas famílias.” Thomaz Starzl
Essa citação nos lembra que a prática médica vai além das técnicas cirúrgicas; envolve empatia, comunicação e educação contínua para garantir que cada vida possa ser potencialmente salva através da doação de órgãos.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e | ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.

Hashtags:
#DoaçãoDeÓrgãos #CirurgiaDigestiva #TransplanteDeÓrgãos #EducaçãoMédica #SaúdePública
Transplante Hepático para Neoplasias Gastrointestinais
Uma Abordagem Revolucionária na Cirurgia Digestiva
O transplante hepático (TH) há muito tempo é considerado a última opção para pacientes com doenças hepáticas terminais. No entanto, avanços recentes estenderam seu papel para a oncologia, especialmente para neoplasias gastrointestinais (GI). Este artigo explora o potencial transformador do transplante hepático no tratamento dessas neoplasias agressivas, com foco em sua aplicação na cirurgia digestiva.
Introdução
O transplante hepático tradicionalmente era reservado para pacientes com doença hepática em estágio terminal ou insuficiência hepática aguda. Contudo, seu papel se expandiu para o domínio oncológico, oferecendo uma cura potencial para certas neoplasias gastrointestinais que antes eram consideradas inoperáveis. Essa mudança marca uma evolução significativa na oncologia de transplantes, um campo que integra transplante com paradigmas de tratamento do câncer.
No Brasil, onde o câncer de fígado é a sexta causa mais comum de mortes relacionadas ao câncer, essa abordagem terapêutica emergente oferece nova esperança. O Instituto Nacional de Câncer (INCA) relata que o carcinoma hepatocelular (CHC), a forma mais prevalente de câncer hepático, tem uma taxa de incidência de 10,6 casos por 100.000 homens e 2,7 por 100.000 mulheres anualmente. Essa estatística sublinha a necessidade urgente de estratégias de tratamento inovadoras, como o transplante hepático.
Transplante Hepático Oncológico
O conceito de transplante hepático para neoplasias surgiu do reconhecimento de que a ressecção sozinha era insuficiente para muitos pacientes com tumores hepáticos primários ou secundários. Por exemplo, o carcinoma hepatocelular (CHC) frequentemente se apresenta no contexto da cirrose, limitando a viabilidade da ressecção cirúrgica. O colangiocarcinoma (CCA), outro câncer primário do fígado, muitas vezes se apresenta em estágio avançado, complicando ainda mais os esforços de ressecção.
Historicamente, o transplante hepático para câncer foi recebido com ceticismo devido a preocupações sobre recorrência e a disponibilidade limitada de órgãos doadores. No entanto, avanços na seleção de pacientes, tratamento pré-operatório (como terapias neoadjuvantes) e cuidados pós-operatórios melhoraram significativamente os desfechos. Por exemplo, os critérios de Milão, estabelecidos em 1996, revolucionaram a abordagem do CHC ao definir parâmetros rígidos para a elegibilidade ao transplante, resultando em uma taxa de sobrevida de cinco anos de 65-80%.
No Brasil, a lista de espera para transplante hepático continua sendo um problema crítico, com aproximadamente 2.300 pacientes aguardando um transplante em 2023. A escassez de órgãos exige critérios de seleção rigorosos para garantir os melhores resultados possíveis.
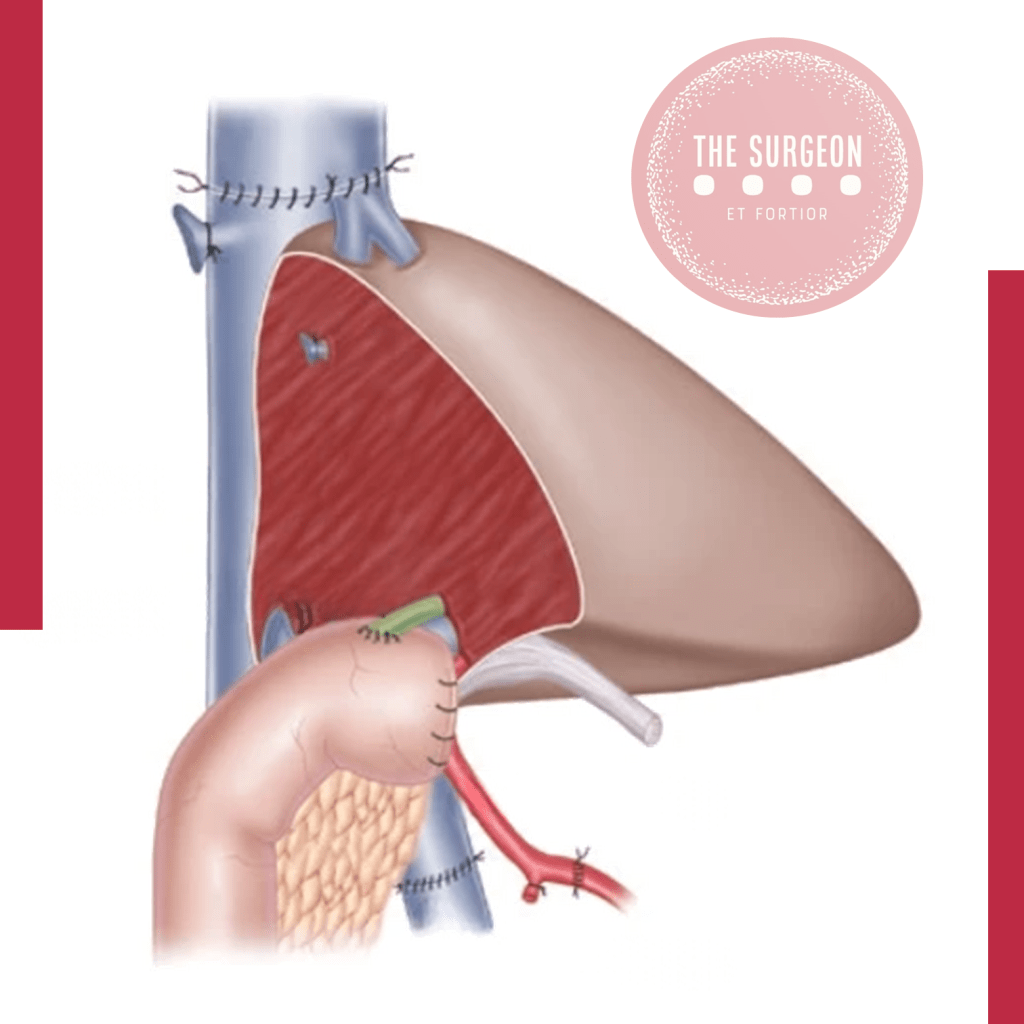

Aplicação na Cirurgia Digestiva
O transplante hepático para neoplasias gastrointestinais agora é uma opção viável para pacientes cuidadosamente selecionados. Condições como carcinoma hepatocelular, colangiocarcinoma, câncer colorretal metastático (mCRC) e tumores neuroendócrinos (TNEs) têm sido tratadas com sucesso através do transplante hepático nos últimos anos.
- Carcinoma Hepatocelular (CHC): Para pacientes com CHC, o transplante hepático oferece um duplo benefício: remoção do tumor e do fígado cirrótico, que muitas vezes é a causa subjacente do tumor. Estudos brasileiros mostraram que aderir a critérios de seleção rigorosos, como os critérios de Milão ou da UCSF, pode melhorar significativamente os desfechos de sobrevida.
- Colangiocarcinoma (CCA): O protocolo da Mayo Clinic, que inclui quimiorradiação neoadjuvante seguida de transplante hepático, demonstrou resultados promissores, com taxas de sobrevida de cinco anos chegando a 70%. Essa abordagem é particularmente relevante para pacientes com CCA hilar, que enfrentariam um prognóstico sombrio com métodos cirúrgicos tradicionais.
- Câncer Colorretal Metastático (mCRC): Embora inicialmente controverso, o transplante hepático para mCRC ganhou força devido ao trabalho pioneiro na Escandinávia. Estudos relataram taxas de sobrevida de cinco anos de 60% em pacientes selecionados, comparáveis às de cânceres primários do fígado.
- Tumores Neuroendócrinos (TNEs): Tumores neuroendócrinos, embora raros, muitas vezes metastatizam para o fígado e são tradicionalmente difíceis de tratar apenas com cirurgia. O transplante hepático emergiu como uma opção curativa potencial, especialmente para pacientes com TNEs metastáticos irressecáveis confinados ao fígado. Estudos mostraram taxas de sobrevida de cinco anos de até 73% em pacientes selecionados, particularmente aqueles com menos de 60 anos de idade, com tumores bem diferenciados e envolvimento hepático limitado. Essa abordagem é particularmente valiosa, dado o caráter indolente dos TNEs, que muitas vezes permite uma sobrevida a longo prazo após o transplante.
No contexto da cirurgia digestiva, o transplante hepático vai além das ressecções tradicionais, oferecendo uma opção curativa onde a cirurgia convencional não é suficiente. Os cirurgiões devem estar familiarizados com os critérios e diretrizes em evolução que determinam quais pacientes são candidatos adequados para este procedimento complexo.
Pontos-Chave
- Avanços nos Critérios: Os critérios de Milão e UCSF para CHC, bem como protocolos para CCA, mCRC e TNEs, refinam a seleção de pacientes, melhorando as taxas de sobrevida e reduzindo a recorrência.
- Contexto Brasileiro: No Brasil, onde o câncer de fígado apresenta morbidade e mortalidade significativas, o transplante hepático é um componente essencial do arsenal terapêutico contra essas neoplasias.
- Implicações Cirúrgicas: O transplante hepático requer uma abordagem multidisciplinar, integrando expertise cirúrgica, oncológica e imunológica para otimizar os resultados.
- Considerações Éticas: A escassez de órgãos doadores no Brasil destaca a necessidade de uma consideração cuidadosa das questões éticas, como alocação e priorização de órgãos.
Conclusão
O transplante hepático para neoplasias gastrointestinais representa um avanço significativo na área da cirurgia digestiva. Ao aderir a critérios de seleção rigorosos e integrar protocolos de tratamento inovadores, os cirurgiões podem oferecer esperança a pacientes com cânceres anteriormente inoperáveis. À medida que o campo da oncologia de transplantes continua a evoluir, o papel do transplante hepático certamente se expandirá, tornando-se um pilar do tratamento curativo para pacientes selecionados. Para os cirurgiões brasileiros, entender e aplicar esses desenvolvimentos é crucial para melhorar os desfechos dos pacientes. Como disse Hipócrates: “Curar às vezes, tratar frequentemente, consolar sempre.” O transplante hepático personifica esse ethos, oferecendo uma cura potencial para aqueles que antes não tinham nenhuma.
Gostou? Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#TransplanteHepático #OncologiaDigestiva #CirurgiaDigestiva #CâncerGastrointestinal #MedicinaTranslacional
Cirurgia Paliativa do Aparelho Digestivo
Uma Ferramenta Essencial no Cuidado Integral das Doenças Digestivas
Introdução
No complexo cenário dos cuidados cirúrgicos, onde o foco costuma ser em intervenções curativas, a cirurgia paliativa surge como um domínio crucial, embora frequentemente subestimado. Isso é especialmente verdadeiro na cirurgia do aparelho digestivo, onde a carga de malignidades e outras condições intratáveis exige uma abordagem que priorize o alívio dos sintomas e a qualidade de vida. Em um país como o Brasil, onde a incidência de câncer tem aumentado significativamente—estimada em 625.000 novos casos por ano pelo Instituto Nacional de Câncer (INCA)—o papel da cirurgia paliativa não pode ser subestimado. Este artigo explora as nuances da cirurgia paliativa gastrointestinal, abordando suas aplicações, desafios e impacto no cuidado ao paciente.
Importância do Tema
A cirurgia paliativa no sistema digestivo é uma área em evolução, com raízes profundas na história da prática cirúrgica. O principal objetivo da cirurgia paliativa gastrointestinal é aliviar sintomas como obstrução, hemorragia e dor intratável, comuns nos estágios avançados das doenças digestivas, incluindo cânceres de estômago, pâncreas e cólon. Ao contrário da cirurgia curativa, cujo objetivo é remover completamente a doença, a cirurgia paliativa foca em melhorar a qualidade de vida do paciente ao mitigar os sintomas angustiantes da sua doença. No Brasil, os cânceres do aparelho digestivo estão entre as principais causas de mortalidade relacionada ao câncer, com o câncer colorretal ocupando o terceiro lugar em incidência. A necessidade de intervenções paliativas nesses casos é essencial, especialmente considerando que muitos pacientes apresentam a doença em estágio avançado, onde as opções curativas são limitadas. A cirurgia paliativa do aparelho digestivo, portanto, desempenha um papel crítico no manejo abrangente desses pacientes.
Tipos de Cirurgias Paliativas no Aparelho Digestivo
Diversos tipos de cirurgias paliativas são realizadas na prática cirúrgica do aparelho digestivo, cada uma destinada a aliviar sintomas específicos e melhorar a qualidade de vida do paciente. Entre as cirurgias mais comuns, destacam-se:
- Gastrojejunostomia: Utilizada para aliviar a obstrução do trato de saída gástrico em pacientes com câncer gástrico avançado ou câncer pancreático, permitindo que o alimento passe do estômago para o intestino delgado.
- Colectomia e Colostomia: Indicadas para obstruções malignas do cólon, essas cirurgias podem evitar complicações como perfuração ou necrose do cólon, proporcionando alívio significativo dos sintomas.
- Biliodigestivas: Como a hepáticojejunostomia, são indicadas para aliviar a icterícia obstrutiva em cânceres pancreáticos avançados, permitindo a drenagem adequada da bile.
- Bypass intestinal: Usado em obstruções intestinais malignas, onde a remoção direta do tumor não é possível, mas a criação de uma nova rota para o trânsito intestinal pode aliviar os sintomas.
Protocolo CLASS
O protocolo CLASS é uma ferramenta essencial para guiar a comunicação cirúrgica em contextos de cuidados paliativos. Este protocolo consiste em cinco etapas fundamentais:
- Contexto: Criar um ambiente adequado para a conversa, garantindo privacidade e mostrando-se acessível e receptivo.
- Escuta: Demonstrar habilidades de escuta ativa, permitindo que o paciente e seus familiares expressem suas preocupações e compreensões.
- Reconhecimento das emoções: Identificar e validar as emoções expressas pelo paciente, usando respostas empáticas para criar uma conexão significativa.
- Estratégia: Propor um plano de manejo que seja compreensível e que o paciente esteja disposto a seguir.
- Resumo: Encerrar a conversa resumindo os principais pontos discutidos, garantindo que todos tenham compreendido as próximas etapas.
Parâmetros de Pior Prognóstico
Na realização de uma cirurgia paliativa, é fundamental avaliar cuidadosamente o prognóstico do paciente. Alguns parâmetros associados a um pior prognóstico incluem:
- Perda de peso significativa: Historial de perda de peso superior a 10 kg, indicando desnutrição severa.
- Anemia severa: Níveis de hemoglobina abaixo de 10,5 g/dL, associados a piora do estado geral do paciente.
- Hipoalbuminemia: Níveis de albumina sérica abaixo de 3,5 g/dL, refletindo um estado nutricional comprometido.
- PCR elevada: Proteína C-reativa elevada, sugerindo um estado inflamatório significativo.
- Escala de Fadiga do NCI: Escore de fadiga igual ou superior a 1, indicando piora da condição clínica.
- Escala de Karnofsky ou ECOG: Escores elevados nestas escalas indicam uma menor capacidade funcional, o que pode influenciar negativamente o resultado da cirurgia.
Esses fatores ajudam a determinar a viabilidade da cirurgia e a balancear os benefícios e riscos envolvidos.
Pontos-Chave
- Cuidado Centrado no Paciente: A cirurgia paliativa gastrointestinal prioriza o cuidado individualizado, focando no alívio dos sintomas ao invés de prolongar a vida a qualquer custo.
- Abordagem Multidisciplinar: A decisão de realizar uma cirurgia paliativa deve envolver uma equipe de especialistas para garantir que o cuidado seja holístico e alinhado com os valores e objetivos do paciente.
- Contexto Brasileiro: No Brasil, onde o acesso ao cuidado cirúrgico avançado pode ser desigual, o papel da cirurgia paliativa é ainda mais crucial. Cirurgiões precisam tomar decisões que sejam clinicamente sólidas e também socialmente e eticamente informadas.
- Técnicas Avançadas: Com os avanços em técnicas minimamente invasivas, como a cirurgia laparoscópica e robótica, as intervenções paliativas se tornaram menos gravosas para os pacientes, oferecendo alívio dos sintomas com menor tempo de recuperação e menos complicações.
- Medidas de Desfecho: O sucesso na cirurgia paliativa deve ser medido pelo grau de alívio dos sintomas e pela melhoria na qualidade de vida do paciente, conforme destacado em estudos de centros oncológicos brasileiros.
Conclusões
A cirurgia paliativa gastrointestinal ocupa um espaço único e essencial dentro do espectro dos cuidados cirúrgicos. Ela exige uma compreensão aprofundada das necessidades dos pacientes, da progressão da doença e das dimensões éticas das intervenções cirúrgicas. Para estudantes de medicina, residentes e cirurgiões pós-graduados especializados em doenças do aparelho digestivo, dominar os princípios da cirurgia paliativa é crucial. Não se trata apenas de realizar uma operação tecnicamente competente, mas de tomar decisões informadas e compassivas que impactam profundamente os últimos dias do paciente.
No Brasil, onde a carga de cânceres do aparelho digestivo é significativa, a importância da cirurgia paliativa continuará a crescer. Como tal, a educação continuada e a pesquisa nessa área são essenciais para melhorar os desfechos para pacientes com doenças digestivas avançadas. Nas palavras de Dr. William Osler, “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” Este sentimento captura a essência da cirurgia paliativa no aparelho digestivo, onde o objetivo final é cuidar do paciente como um todo, abordando tanto o sofrimento físico quanto o emocional.
Gostou do conteúdo? Deixe-nos um comentário ✍️, compartilhe nas suas redes sociais, e|ou envie sua pergunta via 💬 Chat Online no nosso DM do Instagram.
CirurgiaPaliativa #CuidadosPaliativos #AparelhoDigestivo #OncologiaCirúrgica #QualidadeDeVida

Cirurgia Robótica no Tratamento do Câncer Pancreático: Avanço ou Risco?
Introdução
O câncer pancreático é uma das neoplasias mais desafiadoras na prática cirúrgica, com altas taxas de mortalidade e morbidade, mesmo em estágios iniciais. No Brasil, o Instituto Nacional de Câncer (INCA) estima que a incidência anual de câncer pancreático seja de aproximadamente 10 mil novos casos, com uma taxa de mortalidade de cerca de 95% nos primeiros cinco anos após o diagnóstico. A cirurgia é a única chance de cura, mas os desafios técnicos e a complexidade anatômica do pâncreas tornam a abordagem cirúrgica tradicional uma tarefa árdua, muitas vezes associada a complicações graves.
Com o avanço da tecnologia, a cirurgia robótica tem ganhado espaço como uma alternativa minimamente invasiva para o tratamento do câncer pancreático. Mas qual é o real valor dessa abordagem na prática clínica? Como ela se compara à cirurgia convencional em termos de eficácia, segurança e custo-benefício? Este post explora o estado atual da cirurgia robótica no tratamento do câncer pancreático, abordando desde a curva de aprendizado até os desfechos clínicos e as principais contra-indicações.
Desenvolvimento
A cirurgia robótica foi introduzida como uma evolução da cirurgia laparoscópica, oferecendo maior precisão e controle ao cirurgião, com benefícios como visão tridimensional, maior amplitude de movimentos e ergonomia aprimorada. No entanto, a implementação dessa tecnologia na cirurgia pancreática, especialmente na pancreatoduodenectomia (procedimento de Whipple) e na pancreatectomia distal, ainda é um tema de intenso debate.
Estudos recentes indicam que a cirurgia robótica pode reduzir o tempo de internação e a perda de sangue intraoperatória em comparação com a cirurgia aberta. No entanto, essas vantagens vêm acompanhadas de desafios significativos, incluindo uma curva de aprendizado íngreme e maior tempo operatório. De acordo com estudos realizados no Brasil, a curva de aprendizado para a pancreatoduodenectomia robótica pode variar entre 20 a 40 casos, com uma redução progressiva das complicações à medida que o cirurgião adquire mais experiência. Isso levanta a questão: será que todos os centros de cirurgia pancreática no Brasil estão preparados para adotar essa tecnologia de forma segura?
MEDICINA BASEADA EM EVIDÊNCIAS
A cirurgia robótica no tratamento do câncer pancreático, incluindo procedimentos complexos como a pancreatectomia distal e a pancreatoduodenectomia, está associada a uma série de riscos e complicações potenciais. Complicações comuns incluem fístula pancreática pós-operatória (POPF), que pode ocorrer em até 28% dos casos. A taxa de fístula pancreática clinicamente relevante (grau B/C) pode ser significativa, como observado em várias séries de casos. Outras complicações incluem sangramento intraoperatório, que pode levar à necessidade de conversão para cirurgia aberta. A taxa de conversão para cirurgia aberta varia, mas pode ser necessária em até 6% dos casos devido a falha de progressão ou sangramento. Complicações maiores, como infecções de ferida e necessidade de reoperação, também são preocupações importantes. A taxa de reoperação pode chegar a 7%. A mortalidade perioperatória é baixa, com taxas de mortalidade de 30 e 90 dias relatadas em 0,5% e 1%, respectivamente. No entanto, a morbidade geral pode ser alta, com complicações ocorrendo em até 63% dos pacientes, incluindo complicações graves (Clavien-Dindo ≥ IIIb) em 4% dos casos. O tempo operatório prolongado é outra consideração, com a pancreatoduodenectomia robótica frequentemente exigindo mais tempo do que a cirurgia aberta. Além disso, a cirurgia robótica pode estar associada a custos hospitalares mais elevados, apesar de uma menor taxa de complicações perioperatórias e menor tempo de internação. Em resumo, a cirurgia robótica para câncer pancreático é viável e segura em centros especializados, mas está associada a complicações significativas, como fístula pancreática, necessidade de conversão para cirurgia aberta e complicações maiores. A seleção cuidadosa dos pacientes e a experiência do cirurgião são cruciais para minimizar esses riscos.
Aplicação na Cirurgia Digestiva
A principal aplicação da cirurgia robótica no câncer pancreático tem sido na pancreatoduodenectomia e na pancreatectomia distal. Essas cirurgias, que envolvem a ressecção de partes significativas do pâncreas, são tradicionalmente associadas a altas taxas de complicações, como fístulas pancreáticas e infecções. A cirurgia robótica, com sua precisão aprimorada, tem o potencial de mitigar alguns desses riscos, mas a evidência atual ainda é limitada.
No Brasil, onde os custos são uma preocupação constante, a cirurgia robótica apresenta um desafio adicional. O custo médio de um procedimento robótico é significativamente maior que o da cirurgia aberta, com um aumento estimado de até 30% no valor total do procedimento, devido aos altos custos dos equipamentos e da manutenção do robô. Isso sem considerar a necessidade de treinamento específico e o tempo adicional de cirurgia, que pode impactar a disponibilidade de salas cirúrgicas.
Além disso, a literatura indica que as taxas de mortalidade em 30 dias não diferem significativamente entre a cirurgia robótica e a aberta, com ambos os métodos apresentando taxas em torno de 2% a 5% nos principais centros de referência. Entretanto, a incidência de complicações graves pode ser menor em centros de excelência que realizam um grande número de procedimentos robóticos.
Pontos-Chave
- Curva de Aprendizado e Expertise: A cirurgia robótica pancreática exige uma curva de aprendizado longa, com a aquisição de habilidades específicas ao longo de muitos casos, o que pode limitar sua aplicação em centros de menor volume.
- Custos Associados: O alto custo da cirurgia robótica, tanto em termos de equipamento quanto de manutenção, representa uma barreira significativa, especialmente em sistemas de saúde pública como o SUS no Brasil.
- Taxas de Complicações e Mortalidade: Embora a cirurgia robótica possa oferecer benefícios em termos de menor perda de sangue e recuperação mais rápida, as taxas de complicações graves e mortalidade não mostram uma vantagem clara sobre a cirurgia aberta, especialmente fora de centros de excelência.
- Contra-Indicações: Pacientes com tumores avançados ou invasão vascular significativa podem não ser candidatos ideais para a cirurgia robótica, onde a necessidade de ressecções complexas e múltiplas anastomoses pode superar os benefícios da abordagem minimamente invasiva.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A cirurgia robótica no tratamento do câncer pancreático representa uma fronteira promissora, mas ainda envolta em desafios. Para o cirurgião digestivo, a decisão de utilizar essa tecnologia deve ser baseada em uma avaliação criteriosa do perfil do paciente, da experiência da equipe cirúrgica e dos recursos disponíveis. Embora os benefícios potenciais sejam atraentes, eles precisam ser equilibrados com os custos e as limitações operacionais.
Em suma, a cirurgia robótica pode ser uma ferramenta valiosa, mas seu sucesso depende do contexto em que é aplicada. Centros com alta expertise e volume cirúrgico estão mais bem posicionados para maximizar os benefícios dessa abordagem, enquanto outros devem ponderar cuidadosamente antes de adotar essa tecnologia. Como o célebre cirurgião William Halsted disse uma vez: “O que o cirurgião precisa fazer pelo paciente é fazê-lo da melhor forma possível.” No caso da cirurgia robótica, isso significa não apenas adotar a tecnologia mais avançada, mas garantir que ela seja usada de forma segura e eficaz.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaRobótica #CâncerDePâncreas #Pancreatoduodenectomia #InovaçãoCirúrgica #CirurgiaDigestiva
Do Bisturi à Inteligência Artificial
Como a Tecnologia Está Revolucionando o Diagnóstico e Tratamento do Abdome Agudo
Introdução
O abdome agudo, uma condição que desafia médicos há séculos, continua sendo uma das principais causas de admissão nos serviços de emergência em todo o mundo. No Brasil, estima-se que cerca de 5-10% das visitas às emergências sejam devido a dor abdominal aguda. Desde os tempos de Zachary Cope, autor do clássico “Early Diagnosis of the Acute Abdomen” em 1921, até os dias atuais, muito mudou na abordagem dessa condição. Este artigo explora os avanços propedêuticos e terapêuticos no manejo do abdome agudo no século XXI, com foco especial nas aplicações para a cirurgia do aparelho digestivo.
- Evolução da Analgesia
Contrariamente à crença antiga de que analgésicos poderiam mascarar sintomas importantes, estudos recentes demonstram que a administração precoce de analgesia não interfere no diagnóstico e pode, na verdade, melhorar a acurácia do exame físico. Um estudo brasileiro mostrou que o uso de tramadol em pacientes com suspeita de apendicite aguda não alterou o diagnóstico final em 95% dos casos.
- Avanços em Imagem
A tomografia computadorizada (TC) com contraste intravenoso emergiu como o padrão-ouro para avaliação do abdome agudo. No Brasil, um estudo multicêntrico revelou que a implementação de protocolos de TC reduziu o tempo médio para diagnóstico em 40% e diminuiu a taxa de laparotomias não terapêuticas em 15%.
- Papel da Ultrassonografia
Embora a TC seja predominante, a ultrassonografia mantém seu valor, especialmente em gestantes e na avaliação de patologias biliares. No contexto brasileiro, onde o acesso à TC pode ser limitado em algumas regiões, a ultrassonografia point-of-care tem se mostrado uma ferramenta valiosa, com sensibilidade de 85% para apendicite aguda em um estudo nacional.
- Consulta Cirúrgica Oportuna
A importância da avaliação precoce por um cirurgião não pode ser subestimada. Dados do Sistema Único de Saúde (SUS) indicam que a redução do tempo entre a admissão e a avaliação cirúrgica de 6 para 3 horas resultou em uma diminuição de 20% na mortalidade por perfuração de víscera oca.
Aplicação na Cirurgia Digestiva, esses avanços trazem implicações significativas:
- Diagnóstico Preciso: A TC de alta resolução permite a identificação precisa de patologias como isquemia mesentérica, diverticulite complicada e neoplasias perfuradas, orientando a abordagem cirúrgica.
- Planejamento Cirúrgico: Imagens tridimensionais permitem um planejamento detalhado, especialmente útil em casos de obstrução intestinal complexa ou tumores localmente avançados.
- Cirurgia Minimamente Invasiva: O diagnóstico precoce e preciso tem aumentado as oportunidades para abordagens laparoscópicas, mesmo em cenários de urgência. No Brasil, a taxa de colecistectomias laparoscópicas de urgência aumentou de 30% para 60% na última década.
- Manejo Não Operatório: Em casos selecionados, como alguns abscessos intra-abdominais, o manejo não operatório guiado por imagem tem se mostrado uma alternativa segura e eficaz.
Pontos-Chave:
- A analgesia precoce é segura e não mascara o diagnóstico.
- A TC com contraste é o exame de escolha na maioria dos casos de abdome agudo.
- A ultrassonografia mantém seu valor, especialmente em cenários específicos.
- A consulta cirúrgica precoce está associada a melhores desfechos.
- O diagnóstico preciso tem expandido as opções de tratamento minimamente invasivo.
Conclusões:
O manejo do abdome agudo no século XXI representa uma síntese harmoniosa entre a arte clínica tradicional e os avanços tecnológicos. Para o cirurgião digestivo, a integração desses elementos – desde a anamnese cuidadosa até a interpretação sofisticada de imagens – é crucial para oferecer o melhor cuidado possível.
A era digital também traz novos desafios e oportunidades. A inteligência artificial está emergindo como uma ferramenta promissora na interpretação de imagens e na predição de desfechos. No entanto, é importante lembrar que a tecnologia é um complemento, não um substituto para o julgamento clínico experiente.
À medida que avançamos, a formação do cirurgião digestivo deve incorporar não apenas habilidades técnicas, mas também competências em interpretação de imagens avançadas e análise crítica de dados. O futuro promete diagnósticos ainda mais precisos e intervenções mais personalizadas, sempre com o objetivo de oferecer o melhor cuidado possível aos pacientes com abdome agudo.
AbdomeAgudo #CirurgiaDigestiva #DiagnósticoPorImagem #MedicinadeEmergência #EducaçãoMédica
“O médico que não pode fazer um diagnóstico sem muitos exames não é um bom médico.” – Martin H. Fischer
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Cuidados Paliativos em Tumores Biliares
Como Integrar Práticas Cirúrgicas com Abordagens Humanizadas para Melhorar a Qualidade de Vida do Paciente
Introdução
Os tumores biliares, compreendendo o câncer de vesícula biliar e o colangiocarcinoma, apresentam-se como desafios significativos no campo da cirurgia do aparelho digestivo. Essas malignidades raras são frequentemente diagnosticadas em estágios avançados, quando a ressecção curativa não é mais uma opção viável para a maioria dos pacientes. Neste contexto, a integração precoce dos cuidados paliativos torna-se crucial para melhorar a qualidade de vida dos pacientes, abordando tanto os sintomas físicos quanto as necessidades emocionais e espirituais.
Desenvolvimento
A palavra “paliativo” deriva do latim palliare, que significa cobrir com um manto, uma metáfora que reflete a proteção e o alívio oferecidos ao paciente diante de uma doença incurável. No caso dos tumores biliares, onde apenas 20% a 30% dos pacientes com câncer de ducto biliar e 15% a 47% daqueles com câncer de vesícula biliar são candidatos à ressecção cirúrgica, os cuidados paliativos assumem um papel central.
O prognóstico desses pacientes é frequentemente desolador, com taxas de sobrevida de 5 anos inferiores a 5% para o câncer de vesícula biliar e de 2% a 17% para o colangiocarcinoma. Essas estatísticas evidenciam a necessidade urgente de abordagens paliativas que não apenas prolonguem a vida, mas que, acima de tudo, melhorem sua qualidade.
As intervenções paliativas em tumores biliares incluem uma variedade de técnicas, como a colocação de stents biliares, tanto endoscópicos quanto percutâneos, para aliviar a obstrução biliar, radiofrequência para ablação tumoral, terapia fotodinâmica e braquiterapia intraluminal. Cada uma dessas opções é escolhida com base no quadro clínico específico do paciente, buscando-se sempre um equilíbrio entre eficácia e minimização dos riscos.
Aplicação na Cirurgia Digestiva
No cenário da cirurgia digestiva, o papel do cirurgião vai além da remoção tumoral. Em muitos casos, os cirurgiões são os principais responsáveis pela implementação de medidas paliativas que podem incluir desde procedimentos de derivação biliar até a colocação de stents para aliviar sintomas obstrutivos. Além disso, a abordagem multidisciplinar é fundamental para assegurar que o paciente receba um cuidado integral, que envolva não apenas o controle dos sintomas, mas também suporte psicológico e espiritual.
Por exemplo, a inserção de um stent metálico endoscópico, que oferece maior patência a longo prazo em comparação aos stents plásticos, pode ser preferível em casos de obstrução biliar maligna. Outro exemplo é o bloqueio do plexo celíaco, que pode ser realizado para o controle da dor em pacientes com tumores avançados que envolvem o plexo celíaco. Essas intervenções cirúrgicas e endoscópicas são cruciais para manter a qualidade de vida, mesmo quando a cura não é mais possível.
Pontos-Chave
- Diagnóstico Tardio: A maioria dos tumores biliares é diagnosticada em estágio avançado, quando as opções curativas são limitadas.
- Importância dos Cuidados Paliativos: A introdução precoce dos cuidados paliativos é essencial para melhorar a qualidade de vida dos pacientes com tumores biliares.
- Intervenções Paliativas: Técnicas como a colocação de stents, ablação por radiofrequência, e terapia fotodinâmica são opções importantes no manejo paliativo.
- Abordagem Multidisciplinar: O cuidado paliativo eficaz em tumores biliares requer uma abordagem que envolva cirurgiões, oncologistas, endoscopistas, radiologistas e especialistas em cuidados paliativos.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
Para o cirurgião digestivo, é imperativo compreender que a eficácia do tratamento paliativo não se mede apenas em termos de sobrevivência, mas na capacidade de aliviar sintomas e melhorar o bem-estar do paciente. O papel do cirurgião evolui para incluir a gestão de técnicas paliativas, que devem ser integradas precocemente no curso da doença. A educação contínua sobre essas técnicas e o desenvolvimento de habilidades de comunicação para discutir prognóstico e expectativas com os pacientes e suas famílias são igualmente cruciais. Assim, ao ampliar o foco para além da intervenção curativa, o cirurgião digestivo pode fornecer um cuidado mais compassivo e centrado no paciente, alinhado com as melhores práticas em cuidados paliativos.
“Curar quando possível, aliviar frequentemente, consolar sempre.” – Edward Livingston Trudeau
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CuidadosPaliativos #TumoresBiliares #CirurgiaDigestiva #Oncologia #QualidadedeVida
Tratamento Cirúrgico do IPMN
A Neoplasia Intraductal Mucinosa Papilífera (IPMN) do pâncreas tem se tornado um desafio crescente para cirurgiões digestivos. Com o avanço dos métodos de imagem, o diagnóstico dessa condição tem aumentado significativamente, exigindo uma abordagem cirúrgica criteriosa e individualizada. Vamos explorar as nuances do tratamento cirúrgico do IPMN, fornecendo insights valiosos para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
Introdução
O IPMN é uma neoplasia cística do pâncreas caracterizada pelo crescimento papilar no interior do sistema ductal pancreático, com produção de secreção mucinosa espessa. Representa 7,5 a 10% das neoplasias pancreáticas e 50% dos cistos pancreáticos identificados acidentalmente. No Brasil, embora não haja dados precisos, estima-se que a incidência acompanhe as tendências globais, com aumento significativo nos últimos anos devido ao maior acesso a exames de imagem avançados.
Classificação
Os IPMNs (Neoplasias Mucinosas Papilares Intraductais) surgem a partir do epitélio que reveste os ductos pancreáticos. Mais especificamente, eles se originam do epitélio ductal intrapancreático, que é o revestimento das vias que transportam as secreções exócrinas (como enzimas digestivas) do pâncreas para o duodeno. Aqui está um resumo de como esses tumores se desenvolvem:
- Origem Ductal: Os IPMNs se desenvolvem a partir das células epiteliais que revestem os ductos pancreáticos principais ou secundários. Esse epitélio é composto por células que normalmente têm a função de secretar substâncias (como bicarbonato e enzimas digestivas) para auxiliar na digestão.
- Transformação Neoplásica: As células epiteliais ductais passam por alterações genéticas e fenotípicas que levam à proliferação anormal e formação de estruturas papilares e produção excessiva de mucina. Essas células neoplásicas se proliferam dentro dos ductos pancreáticos, causando sua dilatação e levando à formação das lesões císticas características do IPMN.
- Localização no Pâncreas: IPMNs podem ocorrer ao longo de todo o sistema ductal pancreático, incluindo o ducto pancreático principal (IPMN do ducto principal) ou nos ramos menores (IPMN dos ramos laterais).
Essa origem a partir do epitélio ductal é o que distingue os IPMNs de outras neoplasias císticas pancreáticas, como os cistoadenomas mucinosos, que surgem de diferentes tipos de células ou estruturas dentro do pâncreas.
O IPMN (Neoplasia Mucinosa Papilar Intraductal) é uma lesão cística do pâncreas caracterizada por proliferação neoplásica de células produtoras de mucina que envolvem os ductos pancreáticos. A histologia do IPMN é definida por várias características específicas:
1. Arquitetura Papilar
- O IPMN é tipicamente composto por projeções papilares intraductais, que podem variar de simples a complexas. Essas projeções são revestidas por células epiteliais neoplásicas que produzem mucina.
2. Tipo de Epitélio
- O epitélio que reveste essas projeções papilares pode apresentar várias formas, classificadas em quatro tipos histológicos principais:
- Gástrico: O tipo gástrico é o mais comum e apresenta células semelhantes ao epitélio gástrico foveolar, com secreção abundante de mucina.
- Intestinal: Esse tipo apresenta células com características morfológicas e imuno-histoquímicas semelhantes ao epitélio intestinal, incluindo células caliciformes.
- Pancreatobiliar: As células desse tipo têm características mais semelhantes ao epitélio pancreatobiliar, com menor produção de mucina.
- Oncocítico: Este tipo é mais raro e apresenta células oncocíticas, que são ricas em mitocôndrias, dando-lhes uma aparência granular eosinofílica.
3. Displasia
- As células epiteliais do IPMN podem exibir vários graus de displasia, que são classificados como:
- Baixo grau: Displasia leve, com pouca atipia celular e organização arquitetônica preservada.
- Moderado grau: Displasia moderada, com maior atipia celular e desorganização.
- Alto grau: Displasia severa, com atipia celular pronunciada e risco elevado de progressão para carcinoma invasivo.
4. Produção de Mucina
- As células neoplásicas do IPMN secretam mucina, que é uma característica marcante da lesão. A presença de mucina nos ductos pancreáticos dilatados pode ser confirmada por coloração histoquímica, como PAS (ácido periódico de Schiff) ou alcian blue.
5. Invasão
- IPMNs podem evoluir para carcinoma invasivo, especialmente em casos de displasia de alto grau. A invasão geralmente ocorre a partir das áreas de maior displasia, e o carcinoma invasivo resultante pode ser do tipo adenocarcinoma mucinoso ou tubular.
A correta identificação do tipo histológico e do grau de displasia é essencial para determinar o comportamento clínico do IPMN e orientar o manejo terapêutico.
O IPMN é classificado em três tipos principais:
- Tipo ducto secundário (BD-IPMN)
- Tipo ducto principal (MD-IPMN)
- Tipo misto
Cada tipo apresenta características distintas e riscos variados de malignização, influenciando diretamente a decisão cirúrgica.
BD-IPMN: Quando Operar?
O risco de carcinoma invasor ou displasia de alto grau (DAG) nos BD-IPMN varia de 14 a 48%. As diretrizes do Consenso de Fukuoka (2012) são amplamente aceitas para orientar o tratamento cirúrgico, apresentando um valor preditivo positivo (VPP) superior a 60% para malignidade.
Indicações absolutas para ressecção incluem:
- Citologia positiva para DAG ou carcinoma
- Presença de nódulos murais > 5 mm
- Icterícia obstrutiva com lesão cística cefálica associada
A presença de nódulos murais aumenta o risco de DAG ou carcinoma invasivo em 6 a 7 vezes, com um VPP de 60%.
MD-IPMN: Quando Operar?
O MD-IPMN apresenta um risco ainda maior de malignidade, variando de 36 a 100%. A ressecção cirúrgica é geralmente recomendada em todos os pacientes com:
- Ducto pancreático principal (DPP) > 10 mm
- Icterícia
- Nódulos murais (independentemente do tamanho)
Nos casos com DPP entre 5,0 e 9,0 mm, a decisão deve ser individualizada, considerando fatores de risco adicionais e as condições do paciente.
Aplicação na Cirurgia Digestiva
O objetivo da cirurgia no IPMN é ressecar todo o tumor com margens livres. O tipo de ressecção (pancreatectomia proximal ou distal) depende da localização e extensão da lesão. Pontos cruciais na abordagem cirúrgica:
- Exame de congelação das margens de ressecção é mandatório
- Linfadenectomia é recomendada nos casos de MD-IPMN com DPP > 10 mm
- Em casos de dilatação difusa do DPP, a CPER (Colangiopancreatografia Endoscópica Retrógrada) e a EUS-FNA (Ecoendoscopia com Punção Aspirativa por Agulha Fina) são indicadas para confirmar o diagnóstico e excluir outras condições como pancreatite crônica
A cirurgia laparoscópica tem ganhado espaço no tratamento do IPMN, oferecendo benefícios como menor tempo de recuperação e menor morbidade pós-operatória. No entanto, a escolha entre abordagem aberta ou minimamente invasiva deve considerar a experiência do cirurgião e as características específicas do caso.
Pontos-chave
- A decisão cirúrgica no IPMN deve ser baseada em múltiplos fatores, não apenas no tamanho da lesão.
- A ecoendoscopia com contraste é fundamental para diferenciar nódulos murais de bolhas de mucina.
- O acompanhamento rigoroso é essencial para lesões que não preenchem critérios imediatos para cirurgia.
- A ressecção com margens livres e linfadenectomia adequada são cruciais para o prognóstico.
- A abordagem multidisciplinar, envolvendo gastroenterologistas, cirurgiões digestivos , endoscopistas, radiologistas e patologistas, é fundamental para o manejo adequado do IPMN.
Conclusões
O tratamento cirúrgico do IPMN requer uma abordagem personalizada, equilibrando o risco de malignização com os potenciais riscos da cirurgia. A evolução das diretrizes internacionais tem permitido uma seleção mais precisa dos pacientes que realmente se beneficiarão da intervenção cirúrgica. Para o cirurgião digestivo, é essencial manter-se atualizado sobre as mais recentes evidências e recomendações, participar de discussões multidisciplinares e considerar cuidadosamente cada caso. A cirurgia, quando indicada, deve ser realizada em centros especializados, com equipes experientes no manejo de neoplasias pancreáticas complexas. O futuro do tratamento do IPMN aponta para abordagens ainda mais personalizadas, possivelmente incorporando marcadores moleculares e técnicas de imagem avançadas para refinar ainda mais a seleção de pacientes para cirurgia.
#CirurgiaDigestiva #IPMN #NeoplasiasPancreáticas #CirurgiaPancreática #OncologiaCirúrgica
“A cirurgia é uma disciplina de vigilância e decisão, onde o conhecimento profundo se une à habilidade técnica para oferecer o melhor cuidado possível.” – William Stewart Halsted
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Tratamento dos Tumores Císticos do Pâncreas
Controvérsias no Tratamento Cirúrgico
Os tumores císticos do pâncreas representam um desafio significativo na prática da cirurgia digestiva, tanto pela complexidade de seu diagnóstico quanto pela diversidade de suas apresentações clínicas. Este artigo visa explorar as nuances do tratamento cirúrgico desses tumores, fornecendo uma visão abrangente para estudantes de medicina, residentes e pós-graduandos em cirurgia do aparelho digestivo.
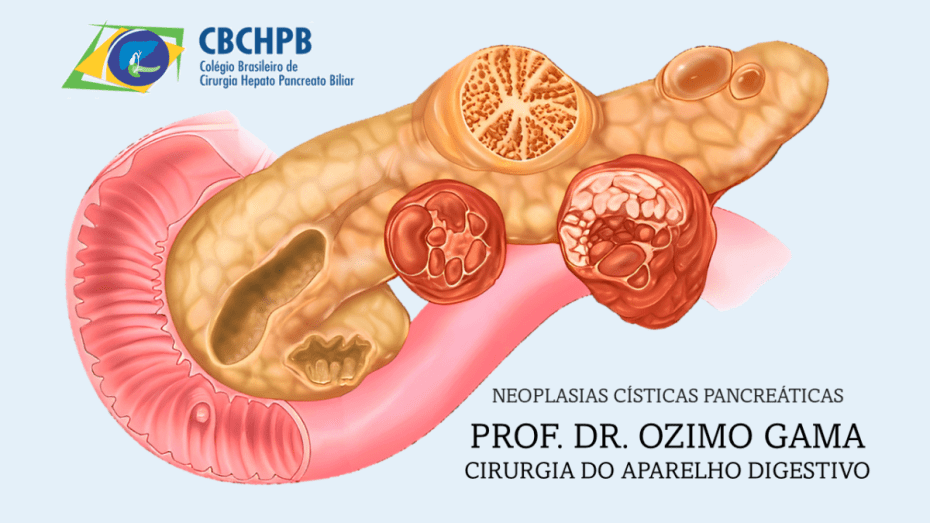
Introdução
Os tumores císticos do pâncreas são lesões que podem variar de benignas a malignas, e sua prevalência tem aumentado com o uso de técnicas de imagem avançadas. Estudos indicam que a prevalência de lesões císticas do pâncreas pode chegar a 20% em exames post-mortem e até 45% em ressonâncias magnéticas de alta resolução. A identificação e o manejo adequado dessas lesões são cruciais, pois muitas podem não necessitar de intervenção cirúrgica, enquanto outras podem evoluir para condições malignas.
Características de Malignidade e Fatores de Risco
As características que sugerem malignidade em tumores císticos do pâncreas incluem:
- Tamanho do Cisto: Cistos com diâmetro superior a 4 cm apresentam maior risco de malignidade.
- Presença de Componentes Sólidos: A presença de nódulos sólidos no interior do cisto é um forte indicativo de potencial maligno.
- Dilatação do Ducto Pancreático Principal: A dilatação do ducto pancreático pode ser um sinal de obstrução e malignidade.
Fatores de risco associados incluem histórico familiar de câncer pancreático, pancreatite crônica e condições genéticas como a síndrome de Peutz-Jeghers e a síndrome de von Hippel-Lindau. No Brasil, a incidência de câncer pancreático é de aproximadamente 10.000 novos casos por ano, refletindo a necessidade de vigilância em pacientes com lesões císticas.
Tipos de Cirurgia
O manejo cirúrgico dos tumores císticos do pâncreas exige uma abordagem cuidadosa e multidisciplinar. As opções cirúrgicas incluem:
- Cistectomia: Indicado para tumores císticos isolados e benignos, onde o cisto é removido sem a necessidade de ressecar o tecido pancreático saudável.
- Pancreatectomia Distal: Utilizada para ressecar a parte distal do pâncreas, frequentemente indicada para neoplasias císticas mucinosas.
- Pancreatoduodenectomia (Whipple): Indicada para tumores císticos localizados na cabeça do pâncreas, envolvendo a ressecção do duodeno e da vesícula biliar, além da parte do pâncreas.
A escolha do procedimento depende das características do tumor, da localização e da saúde geral do paciente. A taxa de morbidade associada a essas cirurgias é significativa, o que torna a avaliação pré-operatória crítica para evitar intervenções desnecessárias.
Morbi-mortalidade das Ressecções Pancreáticas
As ressecções pancreáticas, incluindo a pancreatoduodenectomia (Whipple), pancreatectomia distal e pancreatectomia total, são procedimentos complexos associados a taxas significativas de morbidade e mortalidade. Entender os riscos e complicações potenciais é crucial para otimizar os resultados cirúrgicos.
Mortalidade e Tempo de Internação
A mortalidade perioperatória para ressecções pancreáticas varia de 1% a 5% em centros de alto volume. O tempo médio de internação hospitalar é de 7 a 14 dias, dependendo do tipo de ressecção e da presença de complicações.
Principais Complicações
As cinco principais complicações das pancreatectomias e suas taxas de incidência típicas são:
- Fístula pancreática: 10-30%
- Tratamento: Drenagem percutânea, endoscópica ou cirúrgica, nutrição parenteral e antibióticos.
- Hemorragia: 5-10%
- Tratamento: Reabordagem cirúrgica, embolização angiográfica, reposição volêmica e transfusão.
- Retardo do esvaziamento gástrico: 20-40%
- Tratamento: Nutrição enteral, procinéticos e descompressão gástrica.
- Infecção da ferida operatória: 10-20%
- Tratamento: Antibióticos, desbridamento e fechamento por segunda intenção.
- Trombose venosa profunda/Embolia pulmonar: 5-10%
- Tratamento: Anticoagulação e compressão pneumática intermitente.
Contraindicações para Vídeo e Robótica
Não há contraindicações absolutas para abordagens minimamente invasivas nas ressecções pancreáticas. No entanto, alguns fatores podem aumentar o risco e devem ser considerados:
- Tumor localmente avançado ou com invasão vascular
- História de pancreatite crônica ou múltiplas cirurgias abdominais prévias
- Obesidade mórbida ou desnutrição grave
Nesses casos, uma abordagem aberta pode ser preferível para minimizar o risco de complicações.
Fatores de Risco do Paciente
Fatores de risco associados ao paciente para desenvolvimento de complicações incluem:
- Idade avançada
- Comorbidades (diabetes, doença cardíaca, doença pulmonar)
- Desnutrição
- História de pancreatite
- Anatomia pancreática desfavorável (pâncreas firme, ducto pancreático estreito)
A otimização desses fatores de risco, quando possível, pode melhorar os resultados cirúrgicos.Em conclusão, as ressecções pancreáticas permanecem procedimentos de alto risco, com taxas significativas de morbidade e mortalidade. O reconhecimento precoce e o tratamento adequado das complicações são essenciais. A seleção cuidadosa dos pacientes e a realização em centros de alto volume são fundamentais para otimizar os resultados.
Aplicação na Cirurgia Digestiva
O manejo cirúrgico dos tumores císticos do pâncreas exige uma abordagem cuidadosa e multidisciplinar. A ressecção pode variar de procedimentos menos invasivos, como a cistectomia, a ressecções mais extensas, como a pancreatoduodenectomia, dependendo da localização e da natureza do tumor. A taxa de morbidade associada a essas cirurgias é significativa, o que torna a avaliação pré-operatória crítica para evitar intervenções desnecessárias.
Pontos-Chave
- Prevalência: Lesões císticas do pâncreas são comuns, com alta taxa de detecção em exames de imagem.
- Classificação: Compreender as diferentes categorias de tumores císticos é fundamental para o manejo adequado (mucinosos e não mucinosos).
- Diagnóstico: O uso combinado de TC, RM e ecoendoscopia é essencial para um diagnóstico preciso.
- Indicações Cirúrgicas: A decisão de operar deve ser baseada em uma avaliação criteriosa dos sintomas e características do cisto.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
O tratamento dos tumores císticos do pâncreas é um campo em evolução, onde a precisão no diagnóstico e a individualização do tratamento são fundamentais. A formação contínua e a atualização sobre as diretrizes mais recentes são essenciais para os cirurgiões digestivos, a fim de otimizar os resultados e minimizar a morbidade associada às intervenções.
A frase de Sir William Osler, “A medicina é uma ciência da incerteza e uma arte da probabilidade”, ressoa fortemente neste contexto, lembrando-nos da importância de uma abordagem informada e cuidadosa no tratamento de condições complexas como os tumores císticos do pâncreas.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#TumoresCísticos #Pâncreas #CirurgiaDigestiva #EducaçãoMédica #OncologiaPancreática
Trauma Cirúrgico Controlado: Como Gerenciar a Resposta Metabólica em Intervenções Eletivas
INTRODUÇÃO
Sempre que ocorre uma agressão ao organismo, independentemente da causa, um conjunto complexo de respostas é desencadeado para manter a homeostase e a sobrevivência. Se a lesão for de pequena intensidade, o corpo rapidamente retoma o equilíbrio metabólico e imunológico. No entanto, em casos de traumas extensos, a resposta pode ser exacerbada, levando à disfunção orgânica e aumentando os riscos de mortalidade. Para o cirurgião, é crucial compreender os eventos endócrinos, metabólicos e imunológicos que ocorrem durante e após uma intervenção cirúrgica para manejar adequadamente essas respostas e minimizar complicações.
DESENVOLVIMENTO
A resposta metabólica ao trauma pode ser dividida em três fases: Ebb, Flow e Anabólica. A fase Ebb ocorre imediatamente após o trauma e é caracterizada por instabilidade hemodinâmica, hipovolemia, e aumento de hormônios como catecolaminas e glicocorticoides. Nessa fase, apesar da elevação dos hormônios contrarreguladores, o metabolismo é diminuído. A fase Flow, que segue a fase Ebb, é marcada por hipermetabolismo, retenção hídrica e hiperglicemia, devido ao aumento dos hormônios catabólicos. A fase Anabólica, que pode durar meses, é quando o corpo começa a recuperar o peso e a massa muscular perdidos, com os níveis hormonais retornando ao normal.
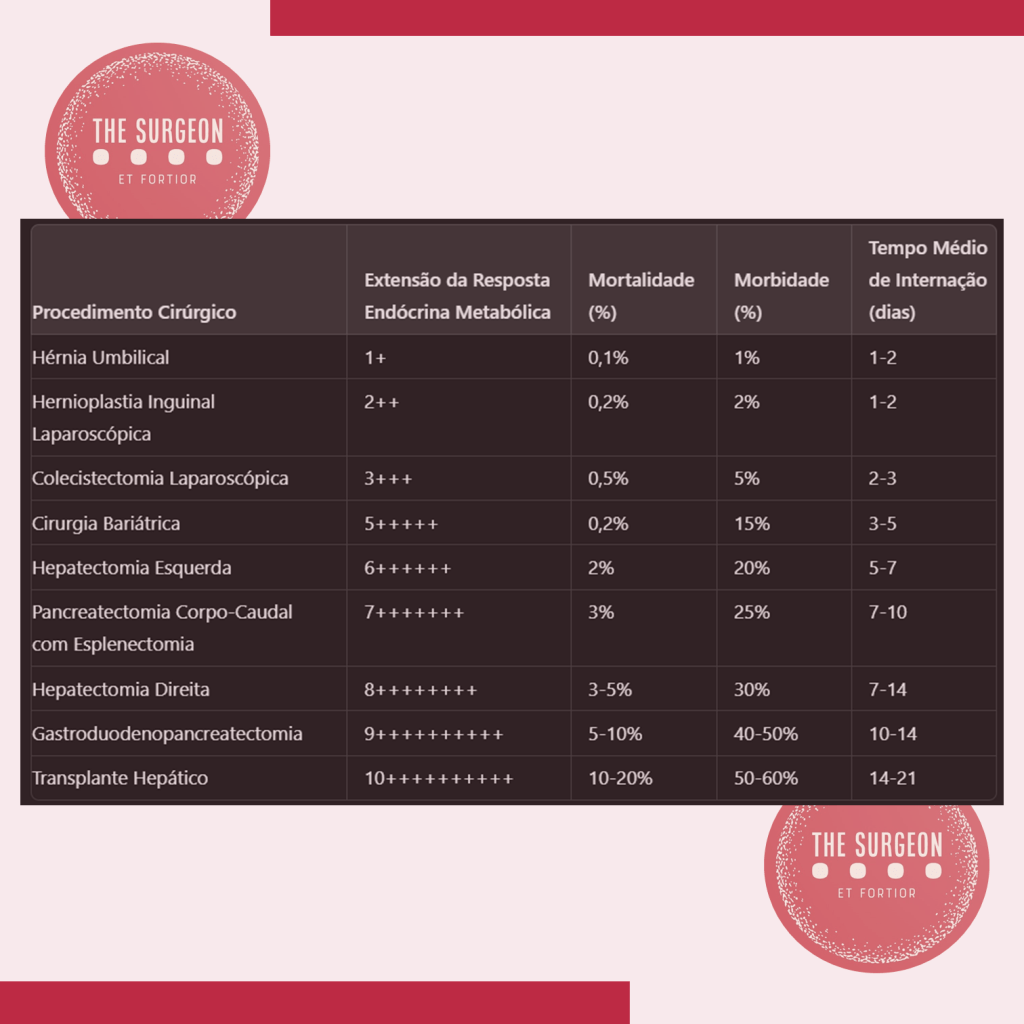
APLICAÇÃO NA CIRURGIA DIGESTIVA
Em cirurgias eletivas, a resposta ao trauma pode ser melhor controlada. A avaliação pré-operatória, a escolha da técnica cirúrgica e o manejo adequado do jejum são essenciais para reduzir o impacto do trauma. A laparoscopia, por exemplo, deve ser priorizada sempre que possível, pois está associada a uma menor agressão tecidual e, consequentemente, a uma resposta metabólica mais branda. Além disso, controlar a ansiedade pré-operatória com benzodiazepínicos pode reduzir a liberação de catecolaminas, diminuindo os riscos de complicações como arritmias e hipertensão.
PONTOS-CHAVE
- A resposta ao trauma cirúrgico envolve fases distintas, cada uma com características metabólicas específicas.
- A laparoscopia é uma via cirúrgica que pode minimizar a resposta ao trauma.
- Controlar a ansiedade pré-operatória é fundamental para reduzir a liberação de catecolaminas e suas consequências.
CONCLUSÕES APLICADAS À PRÁTICA DO CIRURGIÃO DIGESTIVO
O manejo adequado da resposta ao trauma em cirurgias eletivas é vital para reduzir complicações e melhorar os resultados cirúrgicos. A compreensão das fases da resposta metabólica, a escolha de técnicas menos invasivas e a gestão da ansiedade pré-operatória são pilares essenciais para a prática do cirurgião digestivo. Com esses conhecimentos, os profissionais podem proporcionar uma recuperação mais rápida e segura aos seus pacientes. Como disse o renomado cirurgião Harvey Cushing: “A cirurgia é o mais elevado empreendimento humano, pois requer uma combinação de conhecimentos científicos, habilidade técnica e sensibilidade ética.”
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Regeneração Hepática
O Notável Mecanismo de Cura da Natureza
Introdução
O fígado humano é um dos órgãos mais notáveis do corpo, não apenas por suas funções diversas e críticas, mas também por sua extraordinária capacidade de regeneração. Essa capacidade regenerativa tem fascinado profissionais de saúde e cientistas há séculos, oferecendo esperança para pacientes que sofrem de doenças hepáticas e que necessitam de cirurgias hepáticas. Compreender os mecanismos por trás da regeneração hepática é crucial para os avanços no tratamento cirúrgico de doenças do fígado, especialmente em um país como o Brasil, onde as doenças hepáticas são prevalentes.
Desenvolvimento do Tema
A regeneração hepática é um processo complexo e altamente regulado, que permite ao fígado restaurar sua massa e função após uma lesão ou hepatectomia parcial. Ao contrário de outros tecidos, o fígado não depende de células-tronco para regenerar; em vez disso, os hepatócitos maduros reentram no ciclo celular para proliferar. Essa capacidade regenerativa é desencadeada por uma combinação de citocinas, fatores de crescimento e sinais metabólicos que coordenam a proliferação das células hepáticas, mantendo ao mesmo tempo a arquitetura e a função do órgão.
No Brasil, doenças hepáticas como cirrose e carcinoma hepatocelular são preocupações significativas de saúde pública. Segundo o Ministério da Saúde, as doenças hepáticas estão entre as dez principais causas de mortalidade no país. A prevalência de hepatite B e C, que são os principais fatores de risco para cirrose e câncer de fígado, reforça ainda mais a importância da pesquisa em regeneração hepática. Avanços na compreensão de como o fígado regenera podem levar a melhorias nas técnicas cirúrgicas e em melhores resultados pós-operatórios para pacientes com doenças hepáticas.
Pontos-Chave
- Mecanismos de Regeneração Hepática: A capacidade do fígado de regenerar envolve uma interação bem coordenada de mecanismos celulares e moleculares. Os principais atores incluem o fator de crescimento de hepatócitos (HGF), o fator de crescimento transformador-beta (TGF-β) e várias citocinas, como a interleucina-6 (IL-6). Esses fatores iniciam a proliferação dos hepatócitos e a reconstrução do tecido hepático.
- Implicações Clínicas na Cirurgia: Na cirurgia hepática, particularmente em ressecções e transplantes de fígado de doadores vivos, a capacidade regenerativa do fígado é um fator crítico. Compreender o tempo e a extensão da regeneração hepática pode ajudar os cirurgiões a otimizar a quantidade de tecido hepático removido ou transplantado, garantindo a segurança e a recuperação do paciente.
- Desafios e Inovações: Apesar de sua capacidade regenerativa, a capacidade do fígado de regenerar pode ser prejudicada por condições como cirrose, hepatite crônica e doença hepática gordurosa. Recentes inovações em medicina regenerativa, incluindo o uso de células-tronco, bioengenharia e agentes farmacológicos, estão sendo exploradas para melhorar a regeneração hepática, especialmente em pacientes com função hepática comprometida.
- Contexto Brasileiro: No Brasil, o aumento da incidência de doenças hepáticas destaca a necessidade de intervenções cirúrgicas eficazes e cuidados pós-operatórios que aproveitem o potencial regenerativo do fígado. Iniciativas de saúde pública voltadas para o controle das infecções por hepatite e a redução do consumo de álcool também são essenciais para prevenir danos hepáticos e promover a saúde do fígado.
Conclusões Aplicadas à Prática da Cirurgia Digestiva
Para cirurgiões especializados no sistema digestivo, uma compreensão profunda da regeneração hepática é indispensável. Isso informa não apenas a abordagem à ressecção hepática e ao transplante, mas também o manejo dos cuidados pós-operatórios. A capacidade do fígado de regenerar oferece uma oportunidade única de restaurar a função em pacientes com doenças hepáticas, mas também apresenta desafios que exigem um planejamento e uma execução cirúrgica precisos.
A pesquisa contínua sobre os mecanismos moleculares da regeneração hepática provavelmente resultará em novas estratégias terapêuticas que podem melhorar os processos regenerativos, particularmente em pacientes com função hepática comprometida. Para os cirurgiões brasileiros, integrar esse conhecimento na prática clínica é crucial para melhorar os resultados dos pacientes em um país que enfrenta uma alta carga de doenças hepáticas.
Nas palavras do pioneiro da cirurgia hepática, Henri Bismuth: “O fígado é um órgão que sempre pode nos surpreender com sua resiliência e capacidade de regeneração, desde que lhe demos a oportunidade.”
Gostou? Deixe-nos um comentário ✍️, compartilhe em suas redes sociais e|ou envie sua pergunta via 💬 Chat Online no nosso Instagram DM.
RegeneracaoHepatica #CirurgiaHepatica #SaudeHepatica #SaudePublicaBrasileira #CirurgiaDigestiva
Tratamento Cirúrgico do Cisto Pancreático
Introdução
As lesões císticas pancreáticas representam um desafio diagnóstico e terapêutico significativo na prática cirúrgica. Embora muitas dessas lesões sejam benignas, a potencial malignidade e o risco de complicações impõem a necessidade de uma avaliação criteriosa para determinar a melhor abordagem terapêutica. Este artigo abordará o tratamento cirúrgico das lesões císticas pancreáticas, explorando as indicações, técnicas cirúrgicas e prognósticos, com foco na prática clínica de cirurgiões do aparelho digestivo.

Desenvolvimento
O tratamento cirúrgico das lesões císticas pancreáticas é indicado principalmente em pacientes sintomáticos e em casos em que há suspeita de malignidade. O tamanho da lesão, a localização, o tipo histológico e o estado geral do paciente são fatores determinantes na escolha da abordagem. Estudos demonstram que em centros especializados, a mortalidade cirúrgica é inferior a 2%, e a taxa de complicações varia entre 8% e 10%, evidenciando a importância de se realizar a cirurgia com equipes experientes.
Para lesões menores que 2 cm, a taxa de malignidade é de apenas 2%. No entanto, lesões que ultrapassam essa dimensão, especialmente em pacientes jovens ou de meia-idade, são frequentemente indicadas para ressecção cirúrgica devido ao risco de crescimento e transformação maligna. Cistos maiores que 2 cm em pacientes idosos devem ser investigados mais a fundo com exames como ultrassonografia endoscópica, punção aspirativa e análise de marcadores tumorais como CEA e mucina.
Aplicação na Cirurgia Digestiva
As técnicas cirúrgicas variam de acordo com a localização e o tipo da lesão. Para cistos localizados na cabeça do pâncreas, a duodenopancreatectomia (cirurgia de Whipple) é frequentemente indicada. Esta cirurgia pode incluir ou não a preservação do duodeno, dependendo da extensão da lesão. Já para lesões na cauda do pâncreas, a pancreatectomia caudal com preservação do baço é a escolha preferida, especialmente em casos de cistoadenoma seroso.
Em situações em que há suspeita de lesão maligna, como em cistos mucinosos, a esplenectomia pode ser necessária. Tumores pseudopapilares, que geralmente acometem pacientes jovens, são tratados com ressecção completa, preservando-se estruturas adjacentes sempre que possível. A realização de exames intraoperatórios de citologia e histologia é crucial para assegurar a remoção completa das lesões e garantir margens cirúrgicas livres de tumor.
Pontos-Chave
- Indicação Cirúrgica: Lesões císticas maiores que 2 cm, especialmente em pacientes jovens, devem ser avaliadas para possível ressecção cirúrgica.
- Técnica Cirúrgica: A escolha da técnica depende da localização da lesão, com opções que variam desde a duodenopancreatectomia até a pancreatectomia caudal.
- Prognóstico: Lesões mucinosas sem degeneração têm prognóstico excelente, com cura em 100% dos casos.
- Avaliação Intraoperatória: Essencial para a definição da extensão da ressecção e para assegurar margens livres.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
O tratamento cirúrgico das lesões císticas pancreáticas é uma área onde a expertise e o julgamento clínico do cirurgião fazem toda a diferença. A abordagem individualizada, baseada em fatores como idade, comorbidades, e características da lesão, é fundamental para otimizar os resultados e minimizar complicações. A experiência em centros especializados contribui para taxas de mortalidade e complicações substancialmente mais baixas, reforçando a importância de uma formação sólida e continuada na área.
“O bom cirurgião é aquele que sabe quando operar, mas, sobretudo, quando não operar.” – Anônimo
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaPancreática #CistosPancreáticos #SaúdeDigestiva #CirurgiaGeral #EducaçãoMédica
“Aleijados Biliares”| O flagelo silencioso da lesão do ducto biliar na colecistectomia laparoscópica
No âmbito da cirurgia digestiva, poucas complicações causam tanto temor aos cirurgiões quanto a lesão do ducto biliar (LDB) durante a colecistectomia laparoscópica. Apesar de ser o padrão-ouro para o tratamento da colelitíase sintomática, este procedimento carrega um perigo oculto que pode transformar uma operação de rotina em um evento que altera a vida tanto do paciente quanto do cirurgião.
A colecistectomia laparoscópica, introduzida no final dos anos 1980, revolucionou a cirurgia da vesícula biliar. No entanto, trouxe consigo um risco aumentado de LDB em comparação com a abordagem aberta. No Brasil, um estudo do Colégio Brasileiro de Cirurgiões relatou uma taxa de LDB de 0,18% em colecistectomias laparoscópicas, ligeiramente inferior à média global de 0,3-0,7%.
As consequências da LDB são graves, frequentemente exigindo cirurgia reconstrutiva complexa e resultando em significativa morbidade, mortalidade e custos de saúde. Um estudo brasileiro estimou que os casos de LDB levam a uma média de 22 dias adicionais de internação hospitalar e um aumento de 30 vezes nos custos hospitalares.
Pontos-Chave:
- Fatores de Risco: Compreender os fatores relacionados ao paciente (ex: colecistite aguda, obesidade) e ao cirurgião (ex: inexperiência, interpretação errônea da anatomia) é crucial.
- Estratégias de Prevenção: a) Visão Crítica de Segurança: Esta técnica, defendida por Steven Strasberg, é fundamental na prevenção da LDB. b) Colangiografia Intraoperatória: Embora controversa, pode ajudar na identificação da anatomia biliar. c) “Cultura de Segurança”: Adotar uma mentalidade que priorize a segurança do paciente acima da conclusão do procedimento a todo custo.
- Reconhecimento e Manejo: O reconhecimento precoce da LDB é vital. O reparo imediato por cirurgiões hepatobiliares experientes proporciona os melhores resultados.
- Treinamento e Educação: Treinamento baseado em simulação e protocolos padronizados podem ajudar a reduzir as taxas de LDB, especialmente entre residentes de cirurgia.
Como cirurgiões digestivos, devemos permanecer vigilantes contra a ameaça da LDB. Aderindo às técnicas adequadas, mantendo um alto índice de suspeita e fomentando uma cultura de segurança, podemos minimizar esta complicação potencialmente devastadora. A jornada para zero LDB está em andamento, exigindo educação contínua, autorreflexão e um compromisso com a excelência na prática cirúrgica.
“O desafio da cirurgia é a mão do cirurgião curar um paciente pela precisão na estrutura e propósito.” – Joseph E. Murray
Gostou? Deixe-nos um comentário ✍️, compartilhe em suas redes sociais e|ou envie sua pergunta via 💬 Chat Online em nossa DM do Instagram.
#LesãoDuctoBiliar #ColecistectomiaLaparoscópica #CirurgiaDigestiva #SegurançaCirúrgica #EducaçãoMédicaContinuada
Pacientes de Alto Risco em Cirurgia Digestiva: Otimizando os Resultados
As intervenções cirúrgicas, especialmente no campo da cirurgia digestiva, estão repletas de riscos, particularmente para pacientes de alto risco. Esses indivíduos frequentemente apresentam múltiplas comorbidades e exigem uma gestão perioperatória cuidadosa para minimizar complicações e melhorar os resultados. Este artigo explora as complexidades da gestão de pacientes cirúrgicos de alto risco no contexto da cirurgia digestiva, fornecendo insights cruciais para estudantes de medicina, residentes em cirurgia e pós-graduandos especializados nesta área.
Introdução
O cenário cirúrgico está evoluindo, com um número crescente de pacientes apresentando-se para procedimentos eletivos e de emergência, apesar de comorbidades significativas. No Brasil, assim como em muitos países, a população cirúrgica de alto risco—composta por pacientes idosos e aqueles com doenças crônicas—constitui uma parte significativa dos casos cirúrgicos. Aproximadamente 10-15% dos procedimentos cirúrgicos hospitalares se enquadram nesta categoria de alto risco, representando mais de 80% das mortes cirúrgicas. Compreender as sutilezas do cuidado perioperatório para esses pacientes é essencial para melhorar os resultados cirúrgicos e reduzir as taxas de mortalidade.
O Perfil do Paciente de Alto Risco
Pacientes cirúrgicos de alto risco frequentemente exibem uma combinação das seguintes características:
- Idade Avançada: A idade é um fator crítico, pois as reservas fisiológicas diminuem com os anos.
- Condições Comórbidas: Condições como doença cardíaca isquêmica, doença pulmonar obstrutiva crônica (DPOC) e diabetes elevam significativamente o risco cirúrgico.
- Procedimentos de Emergência: Muitos pacientes de alto risco necessitam de intervenções cirúrgicas urgentes, deixando pouco tempo para otimização pré-operatória.
No Brasil, a crescente prevalência de doenças crônicas entre a população idosa exige uma abordagem proativa ao cuidado perioperatório, particularmente na cirurgia digestiva, onde as complicações podem ser severas.
Pontos Chave na Gestão Perioperatória
- Avaliação Pré-operatória
Uma avaliação pré-operatória abrangente é vital para identificar pacientes de alto risco e otimizar suas condições médicas. Esta avaliação deve incluir:
- Avaliação Cardiovascular: Utilizar as diretrizes do American College of Cardiology/American Heart Association (ACC/AHA) para estratificar o risco cardíaco com base em equivalentes metabólicos (METs).
- Estado Nutricional: Avaliar e tratar a desnutrição, comum em pacientes que necessitam de cirurgia digestiva.
Durante a cirurgia, vários fatores devem ser meticulosamente geridos:
- Gestão de Fluidos: A estimativa precisa das necessidades de fluidos é crucial para prevenir desidratação e sobrecarga de fluidos, especialmente em cirurgias envolvendo resseção intestinal.
- Controle da Dor: Analgesia eficaz é essencial para promover mobilidade e prevenir complicações respiratórias pós-cirúrgicas.
- Técnicas de Cirurgia Minimamente Invasivas : Diminuem a resposta metábolica ao trauma cirúrgico.
A gestão pós-operatória de pacientes de alto risco inclui:
- Monitoramento em Unidade de Terapia Intensiva: Muitos pacientes de alto risco requerem monitoramento intensivo em uma unidade de terapia intensiva para garantir a detecção precoce de complicações cardiovasculares e pulmonares.
- Suporte Nutricional: A reintrodução precoce da nutrição, quando viável, é essencial para a recuperação.
Conclusão
A gestão perioperatória de pacientes de alto risco em cirurgia digestiva é um desafio multifacetado que exige uma abordagem sistemática. Ao integrar avaliações pré-operatórias minuciosas, gestão intraoperatória vigilante e cuidados pós-operatórios abrangentes, as equipes cirúrgicas podem reduzir significativamente o risco de complicações e melhorar os resultados dos pacientes. No Brasil, onde a carga de doenças crônicas está aumentando, é imperativo que os profissionais cirúrgicos estejam equipados com o conhecimento e as habilidades para navegar nas complexidades dos pacientes cirúrgicos de alto risco.
Como afirmou sabiamente Sir William Osler:
“O bom médico trata a doença; o grande médico trata o paciente que tem a doença.”
Esta filosofia destaca a importância de uma abordagem holística na gestão de pacientes cirúrgicos de alto risco.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #PacientesDeAltoRisco #CuidadosPerioperatórios #GestãoCirúrgica #EducaçãoMédica
Manejo Perioperatório da Icterícia: Uma Perspectiva Cirúrgica
A icterícia, uma condição caracterizada pelo amarelamento da pele e da esclera devido à hiperbilirrubinemia, é uma preocupação perioperatória crítica na cirurgia digestiva. Gerenciar a icterícia efetivamente no período perioperatório é essencial para minimizar complicações e melhorar os resultados dos pacientes. Este artigo aprofunda-se nas complexidades do manejo perioperatório da icterícia, particularmente no contexto da cirurgia digestiva, e destaca estratégias-chave para equipes cirúrgicas.
Introdução
A icterícia em pacientes cirúrgicos é frequentemente uma manifestação de doença hepática ou biliar subjacente, como icterícia obstrutiva devido a cálculos biliares ou neoplasias. No Brasil, as doenças do trato biliar são prevalentes, com cálculos biliares afetando aproximadamente 10-15% da população adulta, tornando-se uma causa comum de icterícia. O manejo da icterícia no período perioperatório é crucial, pois pode impactar significativamente o risco de complicações cirúrgicas, incluindo coagulopatia, disfunção renal e sepse.
Ciclo Enterohepático da Bile

O ciclo enterohepático da bile é um processo fisiológico fundamental que ilustra a complexa interação entre o fígado e o sistema digestivo. Este ciclo inicia-se com a produção de bile pelos hepatócitos, uma secreção crucial que contém ácidos biliares, bilirrubina, colesterol e eletrólitos. A bile, armazenada temporariamente na vesícula biliar, é liberada no duodeno em resposta à ingestão de alimentos, onde desempenha um papel vital na digestão e absorção de lipídios. Após cumprir sua função digestiva, aproximadamente 95% dos sais biliares são reabsorvidos no íleo terminal, retornando ao fígado via circulação portal, completando assim o ciclo enterohepático.
A bilirrubina, um componente-chave da bile, existe em duas formas principais: não conjugada (indireta) e conjugada (direta). A bilirrubina não conjugada, lipossolúvel, é produzida pela degradação da hemoglobina e transportada no sangue ligada à albumina. No fígado, ela é conjugada com ácido glicurônico, tornando-se hidrossolúvel e, portanto, passível de excreção biliar. Em condições normais, os níveis séricos de bilirrubina total variam entre 0,3 e 1,0 mg/dL, com a fração direta não excedendo 0,3 mg/dL. Alterações nesse equilíbrio podem resultar em icterícia, uma manifestação clínica caracterizada pela coloração amarelada da pele e mucosas.
A etiologia da icterícia é diversa e sua apresentação varia conforme a causa subjacente. Na hepatite viral, observa-se um aumento tanto da bilirrubina direta quanto da indireta, acompanhado de elevação das enzimas hepáticas, refletindo o dano hepatocelular. Em contraste, a hemólise resulta predominantemente em elevação da bilirrubina indireta, sem alterações significativas nas enzimas hepáticas, mas frequentemente associada a anemia e reticulocitose. Por outro lado, a obstrução do ducto hepático por tumor caracteriza-se por um aumento marcante da bilirrubina direta, elevação da fosfatase alcalina e GGT, além de possível dilatação das vias biliares detectável por exames de imagem. Cada um desses cenários demanda uma abordagem diagnóstica e terapêutica específica, ressaltando a importância do entendimento detalhado do metabolismo da bilirrubina e do funcionamento do sistema hepatobiliar para o manejo adequado das doenças que afetam esse sistema.
Semiologia Cirúrgica
Na avaliação pré-operatória de um paciente ictérico que será submetido a uma cirurgia hepatobiliar, a semiologia desempenha um papel essencial para identificar estigmas clínicos, sinais de hipertensão porta, parâmetros de desnutrição e sinais específicos de tumores periampulares. Uma análise minuciosa desses elementos, aliada ao uso das escalas de Child-Pugh e MELD, é fundamental para planejar a intervenção cirúrgica e prever riscos perioperatórios.
Estigmas Clínicos de Cirrose
A cirrose hepática é frequentemente associada a uma série de manifestações clínicas, conhecidas como estigmas de cirrose. Entre eles, telangiectasias ou “aranhas vasculares” são pequenas dilatações dos vasos sanguíneos visíveis na pele, geralmente no tronco e face. O eritema palmar, caracterizado por uma vermelhidão nas palmas das mãos, é outro sinal indicativo. Nos homens, é comum observar ginecomastia (aumento das mamas) e atrofia testicular (diminuição do tamanho dos testículos), frequentemente acompanhados pela perda de pelos corporais. A icterícia, amarelamento da pele e das mucosas, resulta da disfunção hepática no metabolismo da bilirrubina. Outros sinais importantes incluem a contratura de Dupuytren, que causa o espessamento e encurtamento da fáscia palmar, e as unhas de Terry, que apresentam uma coloração esbranquiçada com uma borda distal avermelhada.
- Courvoisier: Vesícula biliar palpável e icterícia – Carcinoma da cabeça do pâncreas.
- Cullen: Equimose peri-umbilical – Pancreatite hemorrágica ou gravidez ectópica.
- Grey Turner: Equimose no flanco – Pancreatite hemorrágica.
- Rovsing: Dor à extensão da articulação do quadril (devido à irritação do psoas) – Apendicite retrocecal.
- Murphy: Sensibilidade no quadrante superior direito exacerbada pela inspiração – Colecistite aguda.
- Virchow: Linfonodo palpável na fossa supraclavicular esquerda – Carcinoma esofagogástrico.
- Tríade de Charcot: Dor abdominal no quadrante superior direito, icterícia e febre com calafrios – Colangite.
- Pêntade de Reynolds: Tríade de Charcot (dor abdominal no quadrante superior direito, icterícia e febre com calafrios) acrescida de hipotensão e confusão mental – Colangite supurativa aguda.
- Sinal de Blumer: Massa palpável no fundo de saco de Douglas – Carcinomatose peritoneal.
- Sinal de Kehr: Dor referida no ombro esquerdo ao aplicar pressão no quadrante superior esquerdo – Irritação diafragmática, como em ruptura esplênica.
- Sinal de Boas: Hipersensibilidade à palpação no ângulo costovertebral direito – Colecistite aguda.
- Sinal de Trousseau: Episódios recorrentes de tromboflebite migratória – Associado a adenocarcinoma pancreático.
- Sinal de Fox: Descoloração azulada da região inguinal – Pancreatite hemorrágica.
- Sinal de Lasegue Hepático: Dor à compressão no hipocôndrio direito durante a inspiração profunda – Distensão da cápsula hepática.
- Sinal de Traube Positivo: Presença de som maciço à percussão na região de Traube (localizada entre a margem inferior esquerda do tórax e a linha axilar anterior) – Indicativo de esplenomegalia, que pode ocorrer em doenças hepatobiliares, como hipertensão portal.
Esses sinais são importantes para o diagnóstico clínico da ascite e ajudam a distinguir a presença de líquido na cavidade abdominal de outras possíveis causas de aumento do volume abdominal, como distensão gasosa ou massas tumorais:
- Abdome Globoso: O abdome assume uma forma globosa, com aumento do volume abdominal, especialmente em pacientes deitados em decúbito dorsal.
- Sinal do Piparote: Com uma das mãos posicionada em um dos lados do abdome, aplica-se um pequeno golpe com a outra mão no lado oposto. Se houver ascite, o líquido no interior da cavidade abdominal transmite o golpe, e a sensação é sentida na mão oposta.
- Macicez Móvel: Ao percutir o abdome, o som será maciço nas regiões onde o líquido se acumula. Quando o paciente muda de posição (por exemplo, deitado de lado), a área de macicez se desloca, indicando a presença de líquido livre na cavidade peritoneal.
- Sinal de Sucussão: Ao agitar suavemente o abdome do paciente, se houver líquido ascítico em grande quantidade, é possível ouvir o som de agitação do líquido (com o auxílio de um estetoscópio).
- Sinal de Oleada: Durante a palpação, a sensação de “oleada” ou “flutuação” pode ser sentida, indicando a presença de líquido sob a parede abdominal.
- Sinal de Fogueira: Na percussão do abdome, encontra-se uma área central de timpanismo (área onde o intestino flutua no líquido) cercada por áreas de macicez, que pode ser interpretada como um “fogo cercado por lenha”.
Sinais de Hipertensão Porta
A hipertensão porta, complicação comum em pacientes cirróticos, manifesta-se por uma série de sinais clínicos. A ascite, ou acúmulo de líquido na cavidade abdominal, é um dos sinais mais evidentes e frequentemente observado ao exame físico. A esplenomegalia, aumento do baço, também pode estar presente e é decorrente do aumento da pressão no sistema portal. A circulação colateral abdominal ou “cabeça de medusa” refere-se à visualização de veias dilatadas ao redor do umbigo, indicando desvio do fluxo sanguíneo devido à obstrução portal. As varizes esofágicas, detectadas pela endoscopia, e as hemorroidas são outros sinais que indicam hipertensão portal e representam riscos de complicações hemorrágicas graves.
Parâmetros Clínicos de Desnutrição
A desnutrição é um fator crítico que deve ser cuidadosamente avaliado em pacientes cirróticos, pois influencia diretamente o prognóstico cirúrgico. A perda de massa muscular, também conhecida como sarcopenia, é um dos principais indicadores de desnutrição. Associada a ela, a perda de gordura subcutânea e o edema por hipoalbuminemia (baixa albumina sérica) são sinais clínicos relevantes. Outros indicadores incluem queda de cabelos, unhas quebradiças e pele seca e descamativa. O cálculo do Índice de Massa Corporal (IMC) e a avaliação da força de preensão palmar complementam a análise nutricional, fornecendo dados objetivos para a avaliação do estado nutricional.
Sinais Semiológicos Relacionados aos Tumores Periampulares
No contexto dos tumores periampulares, a icterícia progressiva e indolor é um sinal de alerta precoce e significativo. O sinal de Courvoisier-Terrier, caracterizado pela presença de uma vesícula biliar palpável e indolor, é um achado importante que sugere obstrução biliar, frequentemente associada a neoplasias malignas. A perda de peso inexplicada é outro sintoma comum nesses pacientes, muitas vezes relacionada à natureza crônica da doença. Dor abdominal, geralmente em estágios mais avançados, prurido (devido à colestase) e febre (em casos de colangite associada) são outros sinais relevantes a serem investigados.
Escala de Child-Pugh
A escala de Child-Pugh é um sistema de pontuação utilizado para avaliar o prognóstico da cirrose hepática. Ela considera cinco parâmetros: bilirrubina total, albumina sérica, tempo de protrombina (ou INR), ascite e encefalopatia hepática. Cada parâmetro recebe uma pontuação de 1 a 3, resultando em uma classificação que varia de Child A (5-6 pontos) a Child C (10-15 pontos). Essa classificação é crucial para a avaliação da reserva funcional hepática e do risco cirúrgico.
- Child A (5-6 pontos): Pacientes com cirrose compensada, apresentando a menor morbimortalidade perioperatória. A mortalidade cirúrgica é geralmente inferior a 10%.
- Child B (7-9 pontos): Pacientes com cirrose descompensada moderada. A mortalidade perioperatória pode variar de 10% a 30%, dependendo da complexidade do procedimento cirúrgico e da presença de complicações associadas, como infecções ou sangramentos.
- Child C (10-15 pontos): Pacientes com cirrose descompensada grave. Esses pacientes têm a maior taxa de morbimortalidade perioperatória, que pode ultrapassar 50%, sendo que em muitos casos, a cirurgia só é indicada em situações de emergência ou quando não existem alternativas terapêuticas.
Escore MELD
O escore MELD (Model for End-Stage Liver Disease) é utilizado para avaliar a gravidade da doença hepática crônica, baseando-se em três parâmetros laboratoriais: bilirrubina total, creatinina sérica e INR. A pontuação varia de 6 a 40, com escores mais altos indicando uma maior gravidade da doença hepática e maior risco de mortalidade. A fórmula do MELD é complexa e leva em consideração os níveis de bilirrubina, creatinina e INR para fornecer uma avaliação precisa do estado do paciente.
- MELD < 9: Pacientes com escore MELD abaixo de 9 geralmente têm um risco relativamente baixo de morbimortalidade perioperatória.
- MELD 10-19: Pacientes com escore MELD nessa faixa apresentam um risco moderado a elevado de complicações, com uma mortalidade que pode variar de 10% a 25% dependendo do procedimento e do estado geral do paciente.
- MELD 20-29: Pacientes com MELD entre 20 e 29 têm um risco significativamente elevado de morbimortalidade perioperatória, frequentemente superior a 25%.
- MELD ≥ 30: Pacientes com MELD igual ou superior a 30 possuem um risco extremamente alto de mortalidade, que pode ultrapassar 50%, especialmente em cirurgias de grande porte.
Avaliação e Otimização Pré-operatória
O manejo perioperatório da icterícia começa com uma avaliação minuciosa do paciente. Isso inclui uma história detalhada, exame físico e testes laboratoriais direcionados para determinar a causa e a gravidade da icterícia. Testes de função hepática, incluindo bilirrubina sérica, fosfatase alcalina e transaminases, fornecem insights sobre o grau de disfunção hepática. Estudos de imagem, como ultrassonografia, tomografia computadorizada (TC) ou colangiopancreatografia por ressonância magnética (CPRM), são essenciais para identificar a causa subjacente, seja icterícia obstrutiva ou não obstrutiva. Em casos de icterícia obstrutiva, a drenagem biliar pré-operatória pode ser necessária para reduzir os níveis de bilirrubina, diminuindo assim o risco de complicações pós-operatórias. A colangiopancreatografia retrógrada endoscópica (CPRE) é frequentemente o procedimento de escolha para drenagem biliar em pacientes com icterícia obstrutiva devido a coledocolitíase ou malignidade.
Considerações Intraoperatórias
Durante a cirurgia, o manejo da icterícia requer uma abordagem multidisciplinar. Os anestesiologistas desempenham um papel vital na otimização do manejo de fluidos e na manutenção da estabilidade hemodinâmica, já que pacientes com icterícia são propensos à hipovolemia e desequilíbrios eletrolíticos. O estado de coagulação deve ser cuidadosamente monitorado, e qualquer coagulopatia corrigida pré ou intraoperatoriamente, pois pacientes com icterícia têm um risco aumentado de sangramento. A abordagem cirúrgica deve ser meticulosamente planejada, levando em conta a causa subjacente da icterícia. Por exemplo, em casos de icterícia obstrutiva maligna, a ressecção do tumor poderá ser necessária, enquanto em condições benignas como coledocolitíase, uma colecistectomia com exploração do ducto biliar pode ser realizada. Os cirurgiões devem estar preparados para gerenciar potenciais complicações, como vazamentos biliares, sangramentos por varizes e falência hepática pós operatória que podem ter consequências sérias em pacientes ictéricos.
Cuidados Pós-operatórios
O manejo pós-operatório de pacientes ictéricos concentra-se no monitoramento de complicações e no suporte à função hepática. O monitoramento próximo das enzimas hepáticas, níveis de bilirrubina e parâmetros de coagulação é essencial. A detecção precoce de complicações, como colangite, sepse ou disfunção renal, é crítica para intervenção oportuna. O suporte nutricional também é um componente-chave dos cuidados pós-operatórios. Pacientes com icterícia frequentemente têm status nutricional comprometido devido à má absorção ou anorexia. A alimentação enteral deve ser iniciada o mais cedo possível, com nutrição parenteral reservada para pacientes que não podem tolerar alimentação enteral.
Pontos-Chave
Avaliação Pré-operatória Abrangente: Avaliação minuciosa e otimização da função hepática e do estado de coagulação são essenciais para minimizar riscos perioperatórios em pacientes ictéricos.
Abordagem Multidisciplinar: O manejo efetivo de pacientes ictéricos requer colaboração entre cirurgiões, anestesiologistas e hepatologistas para atender às necessidades complexas desses pacientes.
Abordagem Cirúrgica Personalizada: A escolha da intervenção cirúrgica deve ser guiada pela causa subjacente da icterícia, com cuidadoso manejo intraoperatório para evitar complicações.
Vigilância Pós-operatória: Monitoramento contínuo e intervenção precoce para complicações são críticos para melhorar os resultados em pacientes ictéricos.
Conclusão
O manejo perioperatório da icterícia é um desafio complexo e multifacetado na cirurgia digestiva. Uma abordagem abrangente e multidisciplinar é crucial para otimizar os resultados dos pacientes. Ao compreender a fisiopatologia da icterícia, adaptar estratégias cirúrgicas às necessidades individuais dos pacientes e fornecer cuidados pós-operatórios vigilantes, os cirurgiões podem minimizar complicações e melhorar a recuperação. No Brasil, onde as doenças do trato biliar são comuns, os princípios do manejo perioperatório efetivo da icterícia são particularmente relevantes. Aderindo a essas diretrizes, as equipes cirúrgicas podem contribuir para melhorar os resultados dos pacientes e o avanço das práticas de cirurgia digestiva.
“Operar um paciente ictérico é como pilotar um avião através de uma tempestade; você deve estar preparado para turbulência a qualquer momento.” – Moshe Schein
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CuidadosPerioperatórios #ManejoDaIcterícia #CirurgiaDigestiva #EducaçãoCirúrgica #CirurgiaHepatobiliar
Manejo da Lesão da Via Biliar | Colecistectomia Segura
A lesão do trato biliar (LTB) permanece uma das complicações mais temidas na cirurgia digestiva, particularmente após a colecistectomia laparoscópica. Ao nos aprofundarmos neste tópico crítico, é essencial reconhecer que no Brasil, aproximadamente 60.000 colecistectomias são realizadas anualmente, com LTB ocorrendo em 0,3-0,5% dos casos. Essa porcentagem aparentemente pequena se traduz em centenas de pacientes enfrentando complicações potencialmente transformadoras de vida a cada ano.
O manejo da LTB é semelhante a navegar por um labirinto – complexo, desafiador e exigindo extrema precisão. A chave para o tratamento bem-sucedido está no reconhecimento precoce e intervenção rápida. Estudos demonstraram que atrasos no diagnóstico além de duas semanas podem comprometer significativamente os resultados.
Quando confrontado com uma suspeita de LTB, o primeiro passo é o encaminhamento imediato a um especialista hepatobiliar. No Brasil, onde o acesso a cuidados especializados pode ser geograficamente desafiador, as consultas de telemedicina tornaram-se cada vez mais valiosas, permitindo rápida contribuição especializada mesmo em áreas remotas.
A pedra angular do manejo da LTB é o diagnóstico preciso. A Colangiopancreatografia por Ressonância Magnética (CPRM) emergiu como o padrão-ouro, oferecendo visualização detalhada da anatomia biliar sem a invasividade da CPRE. Em um estudo realizado na Universidade de São Paulo, a CPRM demonstrou 95% de precisão na delineação da extensão e localização das lesões biliares.
Uma vez diagnosticado, a abordagem de tratamento depende de vários fatores, incluindo o tipo e extensão da lesão, o momento do diagnóstico e a condição geral do paciente. Para lesões menores, como vazamentos biliares do coto do ducto cístico, a colangiopancreatografia retrógrada endoscópica (CPRE) com colocação de stent pode ser suficiente. No entanto, para transecções ou estenoses de ductos principais, a reconstrução cirúrgica é frequentemente necessária.
O tratamento cirúrgico de escolha para LTBs maiores é a hepaticojejunostomia em Y de Roux. Este procedimento, quando realizado por mãos experientes, pode alcançar taxas de sucesso de até 90%. É crucial enfatizar que tentativas de reparo por não especialistas estão associadas a piores resultados e devem ser evitadas.
Pontos-Chave:
- Reconhecimento precoce e encaminhamento especializado são primordiais.
- CPRM é a modalidade diagnóstica preferida.
- A estratégia de tratamento depende do tipo de lesão, momento e fatores do paciente.
- Hepaticojejunostomia em Y de Roux é o padrão-ouro para lesões maiores.
- O acompanhamento a longo prazo é essencial, pois complicações podem ocorrer anos após o reparo.
Conclusões para a Prática da Cirurgia Digestiva: Como cirurgiões digestivos, devemos abordar a cirurgia do trato biliar com uma mistura de confiança e humildade. A prevenção continua sendo a melhor estratégia, alcançada através de técnica meticulosa e uso liberal da colangiografia intraoperatória. Quando ocorre uma lesão, o reconhecimento rápido e o encaminhamento apropriado podem fazer a diferença entre uma complicação gerenciável e um evento que altera a vida.
No Brasil, onde a regionalização dos cuidados especializados ainda está evoluindo, é crucial estabelecer caminhos claros de encaminhamento e utilizar recursos de telemedicina quando necessário. Ao fazer isso, podemos garantir que cada paciente receba o mais alto padrão de cuidados, independentemente de sua localização geográfica.
“O desafio na cirurgia não está no fazer, mas em saber quando fazer e, mais importante, quando não fazer.” – Moshe Schein
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#LesaoTratoBiliar #CirurgiaDigestiva #ComplicacoesLaparoscopicas #TecnicaHepaticojejunostomia #EducacaoCirurgica
Endoscopia Gastrointestinal
Os endoscópios flexíveis modernos são verdadeiros prodígios da ciência médica. Esses dispositivos tubulares, finos e altamente flexíveis, iluminados por poderosas fontes de luz, possuem canais que permitem irrigação, sucção e limpeza de lentes, além de possibilitar a coleta de amostras de tecido, injeção de substâncias e a introdução de dispositivos auxiliares, como clipes e stents. Desde sua introdução ampla, essas ferramentas transformaram dramaticamente o cenário da prática cirúrgica. Procedimentos menos invasivos, realizados endoscopicamente em vez de cirurgicamente, revolucionaram a prática médica. A introdução da gastrostomia endoscópica percutânea (PEG) por Ponsky, a colangiopancreatografia retrógrada endoscópica (CPRE) descrita por McCune, a utilização do endoscópio flexível por Sugawa para identificar a origem de sangramentos gastrointestinais superiores durante a laparotomia, e o uso do endoscópio por Youmans Jr. para tratar sangramentos gastrointestinais superiores, marcaram o início de uma nova era. Cirurgiões sem habilidades endoscópicas começaram a perceber que estavam despreparados para o futuro da cirurgia digestiva.
A Explosão da Prática Endoscópica
Uma vez que essas ferramentas aumentaram o rendimento diagnóstico e a localização precisa de lesões, como cânceres do trato intestinal e locais de sangramento gastrointestinal, a prática endoscópica experimentou uma explosão contínua, especialmente após o advento da endoscopia terapêutica. Durante as décadas de 1970 e 1980, enquanto muitos cirurgiões digestivos focavam nos desenvolvimentos cirúrgicos tradicionais e em suas práticas operatórias intensas, outros continuaram a busca por métodos cada vez menos invasivos para diagnóstico e tratamento de problemas comuns, como demonstrado em vários estudos.
Sangramentos gastrointestinais, pólipos intestinais e cálculos no ducto biliar comum tornaram-se alvos dessas inovações. Logo, os métodos endoscópicos de tratamento mudaram o cenário da prática cirúrgica. O desenvolvimento contínuo da endoscopia flexível empurrou os limites do tratamento para além da sala de operações, e outros especialistas passaram a reivindicar essa ferramenta e o conjunto de procedimentos desenvolvidos em torno dela como seus, numa tentativa de excluir os cirurgiões da prática desse “estado da arte” em benefício de seus pacientes. No entanto, a endoscopia gastrointestinal flexível deve seu desenvolvimento à cirurgia e permanece bem estabelecida em nossa disciplina.
Conceitos Gerais
É impossível fornecer mais do que uma introdução a um campo tão amplo como a endoscopia cirúrgica em um texto único. Existem obras inteiras dedicadas a cada um dos procedimentos endoscópicos flexíveis comumente empregados na prática clínica. A aquisição de habilidades endoscópicas requer exposição clínica direta, uma experiência imersiva e o uso de uma ferramenta validada para avaliar a competência após o treinamento ministrado por um endoscopista experiente.
A Importância da Endoscopia na Cirurgia Gastrointestinal
A inclusão da endoscopia gastrointestinal flexível na prática cirúrgica melhora o desempenho e os resultados das cirurgias gastrointestinais. Em seu nível mais básico, o endoscópio é uma ferramenta que, quando usada para inspecionar ao final de uma operação envolvendo reconstrução ou anastomose do trato gastrointestinal, confirma para os pacientes e cirurgiões que os objetivos da cirurgia foram alcançados de forma segura. Todos os cirurgiões que operam no trato gastrointestinal devem ter grande facilidade no uso de endoscópios para testar anastomoses quanto a vazamentos, inspecionar superfícies mucosas para isquemia e avaliar a adequação de procedimentos reconstrutivos, como a fundoplicatura de Nissen, ou a completude de dissecações importantes para resultados ótimos, como durante a miotomia esofágica para acalasia. A endoscopia intraoperatória tornou-se uma parte crucial da cirurgia gastrointestinal.
Cirurgiões gerais, por exemplo, há muito tempo encontraram na endoscopia cirúrgica uma parte importante de suas práticas, oferecendo serviços de triagem, diagnóstico e terapêutica que, de outra forma, não estariam disponíveis em suas comunidades no interior do Brasil. Uma publicação de 2005 revelou que os cirurgiões gerais realizavam mais procedimentos endoscópicos do que procedimentos operatórios nos EUA, o que era essencial para suas comunidades e práticas. Esses resultados demonstraram também que, enquanto cirurgiões digestivos em centros urbanos realizavam menos procedimentos endoscópicos do que seus colegas cirurgiões gerais em centros menores, o número de procedimentos de endoscopia gastrointestinal flexível realizados por cirurgiões urbanos também era substancial, reafirmando que a endoscopia continua sendo uma ferramenta importante para o cuidado do paciente cirúrgico em todas as situações.
Impactos Econômicos e a Relevância Futura
Independentemente do ambiente de prática, os cirurgiões devem ser incentivados a manter suas habilidades endoscópicas e incorporá-las à prática para o benefício de seus pacientes e comunidades. Em meio à incerteza sobre políticas futuras que orientarão o sistema de saúde e a formação médica, é sensato, do ponto de vista econômico, colocar endoscópios flexíveis nas mãos dos cirurgiões digestivos. Estudos sobre a força de trabalho em saúde sugerem que a combinação de capacidades de especialistas e a superação das barreiras tradicionais de cuidado podem ser mais eficientes e melhorar a qualidade e a rapidez do atendimento.
Cirurgiões que combinam seu extenso conhecimento e experiência no tratamento de condições e sintomas, como doença do refluxo gastroesofágico, hemorragia gastrointestinal, malignidade gastrointestinal, disfagia e dor abdominal, provavelmente proporcionarão uma abordagem mais eficiente em termos de custos e resultados para esses pacientes, quando envolvidos precocemente, devido ao amplo espectro de capacidades diagnósticas e terapêuticas disponíveis. Ao eliminar atrasos e consultas desnecessárias com outros especialistas, o cirurgião é capaz de montar rapidamente uma avaliação que beneficia o paciente de maneira econômica.
Incorporar a endoscopia gastrointestinal flexível na prática cirúrgica atende às necessidades de nossos pacientes hoje e será um conjunto de habilidades cada vez mais importante para as futuras gerações de cirurgiões. O endoscópio flexível emergiu como uma plataforma empolgante sobre a qual se basearão futuros procedimentos cirúrgicos minimamente invasivos. Considerem o impacto positivo da triagem colonoscópica eficaz e da ablação endoscópica para pacientes com esôfago de Barrett, por exemplo, e o uso da ressecção endoscópica de mucosa (EMR) ou da dissecção endoscópica submucosa (ESD) para aqueles com câncer precoce de reto ou esôfago. Abordagens cirúrgicas tradicionais continuarão a ser menos necessárias, e terapias menos invasivas, baseadas na plataforma de endoscopia gastrointestinal flexível, emergirão como novos padrões em nossa abordagem a muitos pacientes. Cirurgiões digestivos que não desenvolvem e mantêm suas habilidades em endoscopia gastrointestinal perderão a oportunidade de participar da próxima época de nossa especialidade.
Considerações Práticas e Procedimentos Específicos
Aqueles que não aprenderam endoscopia durante o treinamento devem fazer esforços especiais para adquirir esse conhecimento e ganhar experiência clínica. A busca por oportunidades de fellowship está disponível para cirurgiões que podem se afastar de sua prática, e programas individualizados de instrução e avaliação são possíveis, variando de local para local. A mentoria é um marco da comunidade cirúrgica, e cirurgiões interessados em treinamento adicional e educação contínua visando à obtenção de maestria em novas habilidades devem buscar arranjos de mentoria que funcionem melhor em seus ambientes individuais.
Por fim, embora seja uma tarefa impossível discutir em detalhes todas as técnicas endoscópicas básicas e avançadas, os procedimentos fundamentais que serão empregados pela maioria dos cirurgiões são a esofagogastroduodenoscopia (EGD) e a colonoscopia. Estes devem ser aprendidos e dominados para que os cirurgiões possam oferecer aos pacientes uma escolha ótima de procedimentos e excelentes resultados clínicos.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Transplante Hepático
O transplante é o tratamento ideal para pacientes com falência terminal de órgãos, proporcionando uma melhora significativa na qualidade de vida e na sobrevida. Em particular, o transplante hepático oferece a única opção terapêutica para pacientes com insuficiência hepática em estágio terminal. Pacientes com insuficiência renal terminal, por exemplo, beneficiam-se enormemente da sobrevida conferida pelo transplante em comparação com a diálise. Já o transplante de pâncreas permite que pacientes com diabetes tipo 1 se libertem das complicações crônicas da doença e da necessidade de injeções regulares de insulina.
Doação de Órgãos
Um dos maiores desafios no campo dos transplantes é a escassez de órgãos disponíveis para doação. Diversas estratégias foram desenvolvidas para mitigar esse problema, sendo exploradas mais detalhadamente neste contexto.
Doação de Órgãos de Doadores Falecidos A maioria dos doadores de órgãos são pacientes que foram diagnosticados com morte encefálica. Potenciais doadores incluem qualquer paciente profundamente inconsciente em um ventilador, após uma lesão cerebral grave e irreversível de etiologia conhecida, como hemorragia intracraniana ou trauma neurocirúrgico agudo. Após o diagnóstico de morte encefálica, é necessário obter o consentimento da família do potencial doador. A legislação sobre consentimento para doação de órgãos varia entre os países e tem sido tema de intenso debate.
Doação em Vida A motivação principal para o desenvolvimento de programas de doação renal em vida na década de 1990 foi a escassez de órgãos disponíveis de doadores falecidos. Hoje em dia, sabe-se que um transplante renal de um doador vivo oferece uma sobrevida superior, com 95% de sobrevivência do enxerto em um ano, em comparação com 90% dos casos de doação falecida, além de menor morbidade e mortalidade.
Aspectos Técnicos
Doação de Órgãos de Doadores Falecidos Após a confirmação da morte encefálica e obtenção do consentimento, inicia-se o procedimento cirúrgico para retirada dos órgãos. Os detalhes técnicos específicos variam, mas incluem a canulação da aorta inferior para permitir a perfusão dos órgãos com solução de preservação fria e a dissecção hepática cuidadosa, incluindo a divisão do ducto biliar comum e das artérias hepáticas.
Transplante Hepático O transplante hepático é geralmente realizado de forma ortotópica, ou seja, o fígado doente é removido e o enxerto é colocado no mesmo local. Existem dois métodos principais: a técnica clássica, que envolve a remoção do fígado doente em bloco com a veia cava inferior retro-hepática, e a técnica “piggy back”, que preserva o fluxo cavalar e é associada a menores tempos cirúrgicos e menor necessidade de transfusão de sangue.
Complicações e Desafios
As complicações incluem disfunção primária do enxerto, hemorragia, trombose vascular e rejeição precoce. A falta de órgãos doadores continua a ser um grande desafio, levando ao uso de fígados de doadores marginais e à prática de transplantes hepáticos de doadores vivos.
Outro desafio significativo é o aumento da incidência de hepatite viral, especialmente hepatite C (HCV) e B (HBV), que representam uma carga crescente sobre os recursos de saúde. A recorrência do HCV, em particular, tem um impacto significativo na sobrevida do enxerto e do paciente, com uma sobrevida de 5 anos em receptores HCV-positivos 10% inferior àqueles HCV-negativos.
Imunossupressão
O principal objetivo da imunossupressão é minimizar o risco de rejeição do enxerto com o menor número possível de efeitos colaterais, como infecções e malignidades. A imunossupressão profilática é iniciada imediatamente após o transplante e mantida a longo prazo. Os inibidores de calcineurina, como ciclosporina e tacrolimus, são os pilares da terapia de manutenção, mas estão associados à nefrotoxicidade significativa. A busca por regimes livres de inibidores de calcineurina, a tolerância imunológica e o manejo das infecções relacionadas à imunossupressão continuam a ser áreas de intensa pesquisa e desenvolvimento no campo dos transplantes hepáticos.
Nota Histórica
Sir Roy Calne, um dos pioneiros no campo dos transplantes, disse:
“The surgical treatment of organ failure has been one of the great achievements of the 20th century. The challenge of the future is to minimize the need for immunosuppression and extend the benefits of transplantation to a wider group of patients.”
Sua contribuição para o desenvolvimento da imunossupressão e dos transplantes de órgãos sólidos é inestimável, destacando a importância de combinar inovação tecnológica com cuidados centrados no paciente.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #TransplanteHepático #DoaçãoDeÓrgãos #CirurgiaHepática #Imunossupressão #SaúdeHepática
Manejo da Icterícia Perioperatória: Abordagens e Complicações
Introdução
A icterícia perioperatória representa um desafio significativo no manejo de pacientes cirúrgicos, especialmente no contexto das cirurgias do aparelho digestivo. Esta condição, caracterizada pela coloração amarelada da pele e mucosas devido ao acúmulo de bilirrubina, pode ter várias etiologias e complicações graves, incluindo insuficiência renal, infecção biliar, e coagulopatia. O reconhecimento precoce e a gestão adequada dessas complicações são cruciais para minimizar a morbidade e mortalidade associadas. Este artigo revisará os principais aspectos do manejo da icterícia perioperatória, oferecendo orientações práticas para médicos em formação e cirurgiões.
Complicações da Icterícia
- Insuficiência Renal (Síndrome Hepatorrenal) A insuficiência renal em pacientes com icterícia é frequentemente causada por uma combinação de infecção, desidratação e efeitos tóxicos diretos dos altos níveis de bilirrubina e outros metabólitos sobre os rins. Esta condição é particularmente perigosa em pacientes com mais de 65 anos e níveis elevados de ureia no sangue. O manejo eficaz inclui a correção da desidratação, o controle da infecção e a monitorização rigorosa da função renal.
- Infecção Biliar (Colangite) A colangite é uma complicação comum da icterícia obstrutiva, especialmente em pacientes com árvores biliares previamente danificadas. Gram-negativos, como Escherichia coli e Pseudomonas, são os patógenos mais frequentemente envolvidos. O manejo inicial inclui a administração de antibióticos intravenosos de amplo espectro e, em muitos casos, intervenções para desobstruir as vias biliares, como drenagem radiológica, CPRE (Colangiopancreatografia Retrógrada Endoscópica) ou, raramente, cirurgia.
- Coagulopatia Pacientes com icterícia apresentam síntese diminuída dos fatores de coagulação dependentes da vitamina K (fatores II, VII, IX, X), além de disfunção plaquetária, o que pode predispor a sangramentos perioperatórios. O manejo inclui a monitorização dos tempos de coagulação (TP e TTPA) e a administração de vitamina K intravenosa quando necessário.
- Imunossupressão Relativa A combinação de icterícia, infecção e diminuição da síntese proteica leva a uma imunossupressão relativa, predispondo os pacientes a infecções sistêmicas, como pneumonia, e comprometendo a cicatrização de feridas. A administração profilática de antibióticos e o suporte nutricional adequado são fundamentais para minimizar esses riscos.
Tratamento Agudo: Abordagens Gerais
- Equilíbrio Hídrico A correção da desidratação é uma prioridade. Em pacientes sem doença hepática pré-existente, pode-se administrar até 1000 mL de cristaloides intravenosos, com monitorização rigorosa do sódio em pacientes com doença hepática. O controle do débito urinário, muitas vezes através de cateter uretral, é essencial para avaliar a função renal.
- Tratamento da Infecção A febre em pacientes com icterícia deve ser investigada com culturas de sangue e o início imediato de antibióticos intravenosos, seguindo os protocolos locais. Intervenções para desobstrução biliar podem ser necessárias urgentemente para prevenir a progressão da infecção.
- Correção da Coagulação A monitorização dos tempos de coagulação deve ser realizada de rotina, com administração de vitamina K intravenosa em casos de prolongamento do TP. Isso é crucial para prevenir sangramentos intraoperatórios e complicações pós-operatórias.
- Nutrição Adequada Uma revisão dietética deve ser solicitada para garantir suporte nutricional adequado, preferencialmente por via enteral. Em casos graves, pode ser necessário o uso de sonda nasogástrica de calibre fino ou, raramente, gastrostomia ou jejunostomia cirúrgica.
Tratamento Agudo: Abordagens Específicas
- Procedimentos Endoscópicos (CPRE) A CPRE com esfincterotomia é frequentemente utilizada para extração de cálculos do ducto biliar comum e tratamento de estenoses ampulares. Em casos onde os cálculos não podem ser removidos facilmente, a inserção de stents pode ser necessária.
- Colangiografia Transhepática Percutânea (CTP) A CTP pode ser usada para inserção de stents ou drenagem externa temporária do sistema biliar obstruído, especialmente em combinação com a CPRE.
- Drenagem Cirúrgica Em casos raros, onde as intervenções menos invasivas falharam, pode ser indicada a drenagem cirúrgica, como a coledocoduodenostomia. No entanto, essa abordagem está associada a alta morbidade e mortalidade, sendo reservada para situações muito específicas.
Prognóstico e Fatores de Risco
O prognóstico em pacientes com icterícia aguda depende de vários fatores de risco adversos, incluindo idade superior a 65 anos, níveis elevados de ureia e bilirrubina plasmática, sepse descontrolada e disfunção multiorgânica. A presença de doença maligna subjacente também é um indicador prognóstico negativo.
Conclusão
O manejo da icterícia perioperatória exige uma abordagem multidisciplinar e uma vigilância constante para prevenir complicações graves. Intervenções oportunas e precisas podem reduzir significativamente a morbidade e melhorar os desfechos clínicos em pacientes com essa condição complexa. Como enfatizou o renomado cirurgião Moshe Schein: “A cirurgia é uma arte, mas o manejo do paciente crítico é a ciência que deve sustentá-la.”
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#IcteríciaPerioperatória #ManejoDaIcterícia #CirurgiaDigestiva #EducaçãoMédicaContinuada #ComplicaçõesCirúrgicas
Otimizando o Perioperatório na Cirurgia Hepatobiliopancreática: O Impacto do Protocolo ERAS
A cirurgia hepatobiliopancreática, devido à sua complexidade e às condições críticas dos pacientes que a necessitam, demanda uma abordagem perioperatória altamente especializada. Nos últimos anos, o protocolo ERAS (Enhanced Recovery After Surgery) emergiu como um dos mais significativos avanços na gestão perioperatória, especialmente em cirurgias de alta complexidade, como as de fígado, vesícula biliar e pâncreas. Este protocolo visa minimizar o estresse cirúrgico, acelerar a recuperação e reduzir complicações pós-operatórias, através de uma série de medidas baseadas em evidências científicas.
O estresse metabólico induzido pela cirurgia desencadeia uma cascata de respostas inflamatórias e neuroendócrinas que podem levar à resistência à insulina e ao catabolismo proteico. Esses fenômenos, centralizados na resistência insulínica, impactam negativamente várias vias metabólicas, contribuindo para a hiperglicemia e a perda de massa muscular, elementos que prolongam o tempo de recuperação e aumentam a morbidade. O protocolo ERAS, ao mitigar essas respostas, facilita a transição do metabolismo para um estado anabólico, promovendo a recuperação mais rápida e segura dos pacientes.
A Resistência Insulínica e Suas Implicações
O desenvolvimento de resistência à insulina durante o período perioperatório é um dos principais desafios enfrentados na cirurgia hepatobiliopancreática. Este estado, caracterizado por uma resposta biológica subnormal a concentrações normais de insulina, provoca um aumento na produção de glicose e uma redução na captação periférica desse nutriente. Essa hiperglicemia, se não adequadamente manejada, pode levar a complicações adicionais, como a formação de radicais livres e o aumento do estado inflamatório, que perpetuam e intensificam a resistência à insulina.
O protocolo ERAS, ao incorporar a suplementação de carboidratos no período pré-operatório, contribui para a diminuição do catabolismo proteico e para a melhoria da sensibilidade à insulina. Além disso, a analgesia epidural, frequentemente recomendada dentro desse protocolo, atua sinergicamente com a suplementação de carboidratos para reduzir ainda mais a resistência à insulina, proporcionando uma recuperação mais eficiente e menos dolorosa.
Benefícios do Protocolo ERAS na Cirurgia Hepatobiliopancreática
Estudos demonstram que a aplicação do protocolo ERAS em cirurgias hepatobiliopancreáticas não só reduz o tempo de internação, como também diminui a incidência de complicações pós-operatórias e melhora a qualidade de vida dos pacientes. Por exemplo, em pacientes submetidos a ressecção hepática, a adesão rigorosa aos componentes do ERAS mostrou uma redução significativa no tempo de hospitalização e nas complicações médicas sem aumento nas complicações cirúrgicas.
Em cirurgias pancreáticas, como a duodenopancreatectomia, o ERAS mostrou-se eficaz na redução do tempo de esvaziamento gástrico, permitindo uma realimentação precoce e uma recuperação mais rápida. Esses benefícios são ainda mais evidentes em pacientes idosos, que são particularmente vulneráveis aos efeitos deletérios do estresse cirúrgico.
Implementação e Adesão ao Protocolo ERAS
A implementação bem-sucedida do protocolo ERAS requer uma adesão meticulosa aos seus vários componentes, desde o preparo pré-operatório até as intervenções pós-operatórias. Entre as práticas recomendadas estão a administração de fluidos com base em metas, a prevenção de hipotermia, o controle adequado da dor e a mobilização precoce. A literatura atual destaca que a não adesão a esses princípios está associada a um aumento no tempo de internação e nas complicações.
A experiência inicial com o protocolo ERAS em cirurgias de ressecção hepática demonstrou que a maioria dos pacientes foi capaz de tolerar uma dieta já no primeiro dia pós-operatório, com uma redução significativa no tempo de internação e na taxa de readmissão. Esses resultados são corroborados por meta-análises que mostram menor morbidade, redução nos custos hospitalares e recuperação mais rápida da função intestinal.
Medidas do Protocolo ERAS Aplicadas à Cirurgia Hepatobiliar
O protocolo ERAS para cirurgias hepatobiliares é estruturado para reduzir o estresse perioperatório e promover a recuperação rápida e segura dos pacientes. As principais medidas incluem:
- Preparo Pré-operatório:
- Suplementação de Carboidratos: Administração de soluções de carboidratos, geralmente 2 a 3 horas antes da cirurgia, para reduzir a resistência insulínica e o catabolismo proteico. Isso ajuda a melhorar a resposta metabólica ao estresse cirúrgico e reduz a perda muscular.
- Educação do Paciente: Informar os pacientes sobre o processo cirúrgico e as expectativas pós-operatórias para reduzir a ansiedade e melhorar a adesão ao plano de recuperação.
- Gestão do Período Operatório:
- Fluidos e Nutrição: Utilização de fluidos com base em metas e administração de nutrição enteral precoce para manter o equilíbrio hídrico e promover a recuperação gastrointestinal.
- Controle da Dor: Implementação de técnicas de analgesia multimodal, como bloqueios regionais e analgesia epidural, para minimizar a necessidade de opioides e promover uma recuperação mais rápida.
- Manejo Pós-operatório:
- Mobilização Precoce: Incentivar a mobilização precoce dos pacientes para prevenir complicações como trombose venosa profunda e melhorar a função respiratória e gastrointestinal.
- Controle da Temperatura: Manter a normotermia durante e após a cirurgia para reduzir o risco de complicações relacionadas à hipotermia.
- Descontinuação Precoce dos Drenos: Remover drenos e cateteres tão cedo quanto possível para reduzir o desconforto e o risco de infecções.
- Realimentação e Recuperação:
- Reintrodução Precoce da Alimentação Oral: Permitir a introdução de líquidos e alimentos sólidos logo após a cirurgia, conforme tolerado, para estimular a função gastrointestinal e acelerar a recuperação.
- Monitoramento e Avaliação: Acompanhamento contínuo dos sinais vitais, níveis de glicose e outros parâmetros para ajustar o tratamento conforme necessário e garantir uma recuperação tranquila.
A adesão a essas medidas dentro do protocolo ERAS tem mostrado uma redução significativa no tempo de hospitalização, nas complicações e na recuperação funcional dos pacientes submetidos a cirurgias hepatobiliares.
Conclusão
O protocolo ERAS representa um avanço crucial na otimização do cuidado perioperatório em cirurgias hepatobiliopancreáticas, proporcionando uma recuperação mais rápida e segura para os pacientes. A aplicação rigorosa das diretrizes ERAS pode transformar a experiência cirúrgica, reduzindo complicações e melhorando os desfechos clínicos. À medida que mais cirurgiões adotam esse protocolo, espera-se uma melhoria contínua nos resultados cirúrgicos e na qualidade de vida dos pacientes.
Nota Histórica: “A cirurgia deve ser feita com a menor agressão possível ao paciente, para que o corpo possa se recuperar mais rápido e com menos complicações.” – William Stewart Halsted, pioneiro da cirurgia moderna.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#CirurgiaHepatobiliopancreatica #ProtocoloERAS #RecuperacaoAposCirurgia #MedicinaCirurgica #CuidadosPerioperatórios
Fundamentos e Avanços no Tratamento do Câncer Digestivo
O câncer é uma doença complexa caracterizada pelo crescimento descontrolado e desregulado de células, levando à formação de neoplasias malignas. No tratamento cirúrgico do câncer, o objetivo é remover os tumores e controlar a disseminação da doença, proporcionando ao paciente a melhor chance de sobrevivência e qualidade de vida.
Biologia do Câncer
O câncer se origina de alterações genômicas que promovem a replicação celular excessiva ou inibem a morte celular programada (apoptose). Essas mutações podem ativar oncogenes ou desativar genes supressores de tumor, resultando em crescimento celular desordenado. A identificação desses genes pode fornecer informações valiosas sobre a agressividade do tumor e ajudar na personalização dos tratamentos. Por exemplo, a amplificação do oncogene C-erbB-2 está associada a um prognóstico mais reservado no câncer de mama.
Tumores Benignos vs. Malignos
Os tumores benignos permanecem localizados e não invadem tecidos adjacentes. Em contraste, os malignos têm a capacidade de invadir e metastatizar para locais distantes, o que pode levar a complicações graves e à morte. O processo de invasão e metástase é mediado por alterações adicionais nas células cancerígenas, que facilitam a sua propagação para órgãos distantes.
Estatísticas Brasileiras
No Brasil, o câncer é uma das principais causas de morte. De acordo com o Instituto Nacional de Câncer (INCA), estima-se que em 2024 haja aproximadamente 700 mil novos casos de câncer no país. Entre os tipos mais comuns estão os cânceres de mama, próstata e colorretal. A detecção precoce e a intervenção cirúrgica são fundamentais para melhorar as taxas de sobrevivência.
Avanços no Tratamento Cirúrgico
A cirurgia continua a ser um pilar crucial no tratamento do câncer, especialmente quando realizada com técnicas modernas e precisão. A abordagem cirúrgica deve ser cuidadosamente planejada para garantir a remoção completa do tumor e minimizar os riscos de recidiva. O avanço em técnicas como a cirurgia minimamente invasiva e a cirurgia robótica tem permitido melhores resultados com menor impacto para os pacientes.
Aspectos Importantes na Prática Cirúrgica
- Cuidados Pré-operatórios: Avaliações completas e planejamento cuidadoso são essenciais para o sucesso da cirurgia.
- Habilidade Operatória: A execução precisa e a atenção aos detalhes são fundamentais para a remoção eficaz do tumor.
- Controle de Metástases: Monitoramento contínuo e tratamento das metástases são cruciais para o manejo a longo prazo do câncer.
- Recuperação e Reabilitação: O suporte pós-operatório e a reabilitação são importantes para a recuperação do paciente e manutenção da qualidade de vida.
Conclusão
A cirurgia oncológica é uma disciplina dinâmica que exige constante atualização e refinamento das habilidades. O entendimento da biologia do câncer e a aplicação de técnicas avançadas são fundamentais para melhorar os resultados dos tratamentos e proporcionar aos pacientes uma chance maior de sobrevivência e bem-estar.
“A medicina é um ofício que requer habilidades e dedicação constantes. Como disse Sir William Osler, ‘O médico deve ter a mente de um cientista, o coração de um humanista e a habilidade de um artesão’.”
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #OncologiaCirúrgica #TratamentoCâncer #CirurgiaDigestiva #CancerNoBrasil #AvançosMédicos
Fisiopatologia da Cirurgia Bariátrica: Um Olhar Aprofundado sobre os Mecanismos Metabólicos
Introdução
A primeira publicação a relatar a eficácia da cirurgia no tratamento da obesidade e das comorbidades relacionadas foi feita pela revista Surgery, Gynecology & Obstetrics, em 1955, observando a “melhora do diabetes mellitus após gastrectomia subtotal.” Desde então, a aceitação da cirurgia bariátrica como tratamento para obesidade severa impulsionou significativamente o estudo da fisiologia da perda de peso cirúrgica.
Mecanismos Clássicos de Perda de Peso
Inicialmente, os mecanismos predominantes por trás da cirurgia bariátrica eram a restrição calórica e a má absorção de nutrientes. Embora a redução na ingestão calórica e a consequente perda de peso sejam responsáveis por grande parte da melhora das comorbidades após a cirurgia bariátrica, evidências científicas recentes indicam que esses conceitos não explicam totalmente os efeitos metabólicos da cirurgia. De fato, os mecanismos vão além da perda de peso, incluindo efeitos na regulação do apetite pelo sistema nervoso central e melhorias na secreção e sensibilidade à insulina.
O Eixo Endócrino Enteroencefálico
Procedimentos como a gastroplastia vertical (GV) e a derivação gástrica em Y de Roux (RYGB) aumentam a saciedade e reduzem a fome. Durante a fase periprandial, a interação entre o trato gastrointestinal e os centros reguladores do cérebro ativa redes neurais complexas que modulam a ingestão alimentar. No sistema nervoso central, o hipotálamo é a área chave na regulação do apetite, utilizando um sistema complexo de sinalização neuronal anorexígena e orexígena.
Grelina e Peptídeo YY (PYY)
A grelina, conhecida como o hormônio da fome, é secretada pelas células P/D1 localizadas no fundo do estômago, aumentando significativamente antes das refeições e diminuindo rapidamente após. Estudos mostram que os níveis de grelina caem significativamente após a GV. Em pacientes que se submetem à RYGB, os resultados variam, mas um estudo recente de Svane e colegas forneceu dados mais definitivos, indicando que as áreas sob a curva (AUCs) pós-prandiais para grelina total e acilada são significativamente menores após GV e RYGB em comparação com controles.
O PYY, secretado pelas células L ao longo do intestino delgado e grosso em resposta à presença de nutrientes, exerce um efeito anorexígeno nos neurônios NPY. Estudos indicam que os níveis pós-prandiais de PYY são significativamente mais altos em pacientes após a RYGB do que após a GV ou em controles obesos.
O Eixo Endócrino Enteroinsular
A remissão ou melhora do diabetes mellitus tipo 2 é um dos principais benefícios da cirurgia bariátrica. Embora os mecanismos não sejam totalmente compreendidos, a ação melhorada da insulina, a função das células beta e o efeito modulador dos hormônios intestinais no eixo enteroinsular desempenham um papel significativo.
Peptídeo 1 semelhante ao Glucagon (GLP-1)
O GLP-1, liberado pelas células L do trato gastrointestinal distal, aumenta em resposta à presença de nutrientes. Em indivíduos obesos, há um atraso na liberação pós-prandial de GLP-1 e níveis circulantes significativamente reduzidos. O GLP-1 estimula a secreção de insulina pelo pâncreas, aumenta a sensibilidade das células pancreáticas à insulina e inibe a secreção de glucagon. Estudos mostram que o GLP-1 é consistentemente elevado após RYGB e GV, com uma magnitude significativamente maior na RYGB, evidenciando um efeito metabólico da cirurgia bariátrica independente da perda de peso.
Conclusão
A cirurgia bariátrica atua por meio de mecanismos complexos que vão além da simples restrição calórica e má absorção de nutrientes. A regulação central do apetite e as melhorias na ação da insulina e nos hormônios intestinais são cruciais para a eficácia da cirurgia bariátrica no tratamento da obesidade severa e suas comorbidades.
Nota Histórica
“A cirurgia bariátrica revela a profundidade das interações entre o corpo humano e a regulação metabólica, destacando a importância de abordagens integradas no tratamento da obesidade.” – Dr. Walter Pories
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaBariátrica #Obesidade #Metabolismo #SaúdeDigestiva #Medicina