Engenharia de Prompt na Educação Médica
Dissecando a Nova Fronteira Tecnológica na Cirurgia Digestiva
1. A Evolução do Estetoscópio ao Algoritmo
A prática médica contemporânea atravessa uma metamorfose digital que exige mais do que a simples adaptação: exige o domínio da técnica. A ascensão dos Modelos de Linguagem Gerativa (GLMs), como o ChatGPT e o Google Bard, não representa apenas a disponibilidade de novos bancos de dados, mas sim uma mudança sísmica na síntese do conhecimento clínico. Neste contexto, a Engenharia de Prompt emerge como a competência estratégica definitiva para o médico do século XXI. Conforme definido por Heston e Khun (2023), trata-se de uma abordagem sistemática de comunicação com IAs para obter resultados de alta precisão. Não se trata de uma conversa informal, mas de uma instrumentação precisa da inteligência artificial.
Para compreendermos o “salto qualitativo” desta ferramenta, basta observar a evolução técnica: o GPT-1 (2018) operava com 117 milhões de parâmetros; o GPT-4 (2023) é estimado em 1 trilhão. Essa expansão colossal mudou o paradigma da simples busca por informação (o modelo “indexador”) para a síntese complexa de conhecimento. Para o cirurgião, isso significa que a IA deixou de ser um dicionário para se tornar um consultor de lógica, exigindo que a instrução dada pelo médico seja tão precisa quanto o plano de clivagem em uma dissecção oncológica.
Esta transição da intuição para a estrutura técnica é o que separa o uso recreativo da IA da sua aplicação acadêmica e clínica de alto nível.
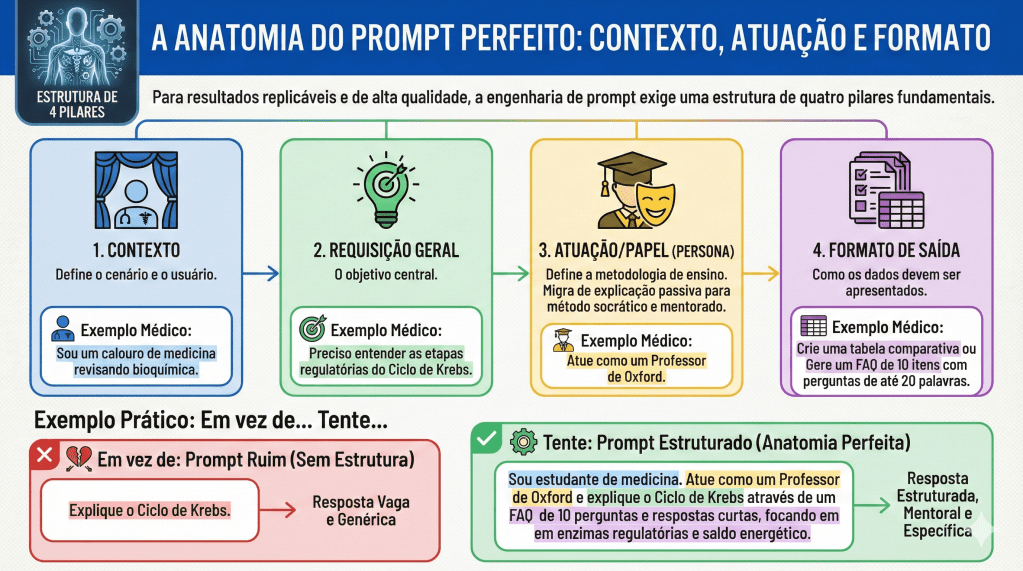
2. A Anatomia de um Prompt de Alta Precisão: Estrutura e Componentes
Na sala de operação, a improvisação é o terreno do erro; na Engenharia de Prompt, a vagueza é a raiz da alucinação. Estruturar uma entrada para a IA não é meramente fazer uma pergunta, mas sim redigir um protocolo de intenção. Podemos comparar a precisão de um prompt bem construído ao rigor técnico necessário em uma colecistectomia: cada componente tem seu “tempo cirúrgico” e função específica.
Para garantir resultados consistentes, um prompt estruturado deve conter quatro pilares fundamentais:
- Contexto: A descrição de quem está perguntando (ex: “Sou um preceptor de residência em cirurgia digestiva”).
- Solicitação Geral: O objetivo macro da interação (ex: “Necessito de uma revisão de condutas”).
- Persona/Papel: Como a IA deve se comportar (ex: “Atue como um Professor Titular de Gastroenterologia Cirúrgica”).
- Formato de Saída: A estrutura final do dado (ex: “Gere uma lista de verificação,” “tabela comparativa,” ou “resumo em tópicos”).
Comparativo de Eficiência: Prompts Vagos vs. Alta Precisão
| Tipo de Prompt | Exemplo Vago | Exemplo de Alta Precisão (Padrão Ouro) |
| Objetivo | Informação Geral | FAQ de Estadiamento Acadêmico |
| Entrada | “Fale sobre câncer gástrico.” | “Como Professor Doutor de Cirurgia, forneça um FAQ de 10 itens sobre o estadiamento do adenocarcinoma gástrico para residentes do R3. Foque no TNM 8ª edição, critérios de ressecabilidade e manejo perioperatório do paciente bariátrico. Entregue em formato de tabela.” |
| Resultado | Texto genérico e superficial. | Guia técnico, hierarquizado e pronto para discussão em round clínico. |
Essa estrutura permite que a IA realize uma triagem interna em seu vasto banco de parâmetros, ajustando o nível de complexidade para a realidade do interlocutor, seja ele um estudante de graduação ou um cirurgião experiente.
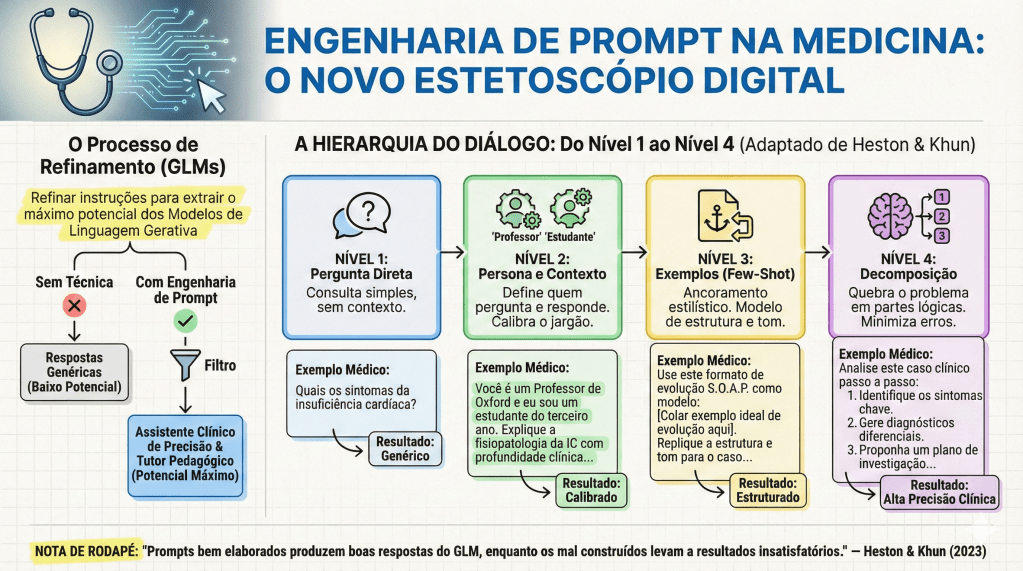
3. Níveis de Complexidade: Do Zero-Shot à Decomposição Lógica
No cotidiano acadêmico, a sofisticação da resposta da IA é diretamente proporcional à técnica de prompting utilizada. Podemos escalonar a interação em níveis que desafiam a capacidade de processamento do modelo:
- Zero-Shot vs. Few-Shot: O Zero-Shot é uma solicitação sem exemplos prévios. O Few-Shot é o fornecimento de modelos de comportamento dentro do prompt (ex: “Crie um caso clínico de isquemia mesentérica seguindo rigorosamente este modelo: [Exemplo]”).
- Hierarquia de Lawton (Níveis 1 a 4): Evoluímos de perguntas simples (Nível 1) até o Nível 4, definido como a desconstrução de solicitações complexas em componentes lógicos (Chain of Thought).
O impacto clínico mais relevante desta última técnica, ativada pelo comando “Pense passo a passo” (Think step by step), é a mitigação de erros catastróficos. Um exemplo clássico do texto de Heston e Khun (2023) ilustra isso: ao perguntar sobre um malabarista que tem 16 bolas, sendo que metade são bolas de golfe e metade das bolas de golfe são azuis, o GPT-3.0 pode falhar se responder instantaneamente. Ao ser instruído a pensar passo a passo, a IA decompõe o problema: total (16) -> metade são golfe (8) -> metade das de golfe são azuis (4). No ambiente cirúrgico, essa lógica é o que previne a iatrogenia em cálculos farmacológicos complexos ou em lógicas de estadiamento multinível.
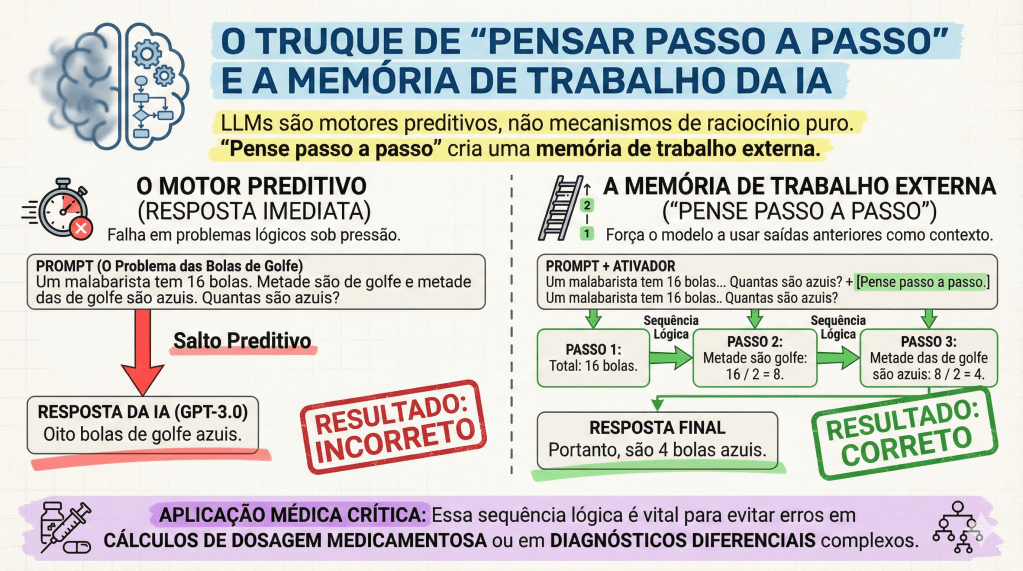
A eficácia do aprendizado, portanto, não reside em receber a resposta pronta, mas em observar o “raciocínio” da máquina, permitindo ao estudante identificar falhas lógicas e consolidar o conhecimento.
4. Aplicação no Ensino-Aprendizado e a Realidade Brasileira (Enare/Enamed)
No cenário brasileiro, marcado pela altíssima competitividade do Enare (Exame Nacional de Residência) e do Enamed, a IA deve ser encarada como um “cérebro periférico”. A densidade do conteúdo cirúrgico exige ferramentas que otimizem a densidade temporal do estudo.
Aplicações Práticas para o Estudante de Alto Desempenho:
- Mnemônicos Cirúrgicos: Criação de fórmulas personalizadas para critérios de gravidade em pancreatite aguda ou escalas de Alvarado.
- Simulação de Pacientes Realistas: Uso de GLMs para simular “Virtual Patients”, permitindo que o estudante treine a anamnese antes do contato real (conforme princípios da AAMC).
- Bancos de Questões De Novo: Geração de simulados inéditos baseados nos exames anteriores do MEC.
A realidade curricular está mudando drasticamente. Segundo dados do Curriculum SCOPE Survey (AAMC), houve um crescimento acentuado na inserção de IA nos currículos das escolas médicas entre 2023 e 2024. No Brasil, essa tendência impacta diretamente a competitividade: o candidato que domina a Engenharia de Prompt processa evidências científicas com uma agilidade que os métodos tradicionais de leitura passiva não conseguem acompanhar. Contudo, este potencial exige uma advertência: a tecnologia deve fortalecer a mente, não atrofiar o raciocínio clínico original.
5. Riscos, Alucinações e a Ética na Medicina Digital
A precisão cirúrgica exige o reconhecimento dos riscos. O maior perigo dos GLMs são as “alucinações”, onde a IA gera informações falsas com um tom de autoridade inquestionável, incluindo referências bibliográficas totalmente inventadas no formato Vancouver.
Checklist de Segurança de Dados e Integridade:
- Verificação de Citações: Jamais utilize uma referência gerada sem conferir o DOI ou a base primária.
- Privacidade: É imperativo nunca inserir dados identificáveis de pacientes reais em prompts de IA.
- Senso Crítico: O cirurgião nunca deve abdicar de sua responsabilidade ética em favor do algoritmo.
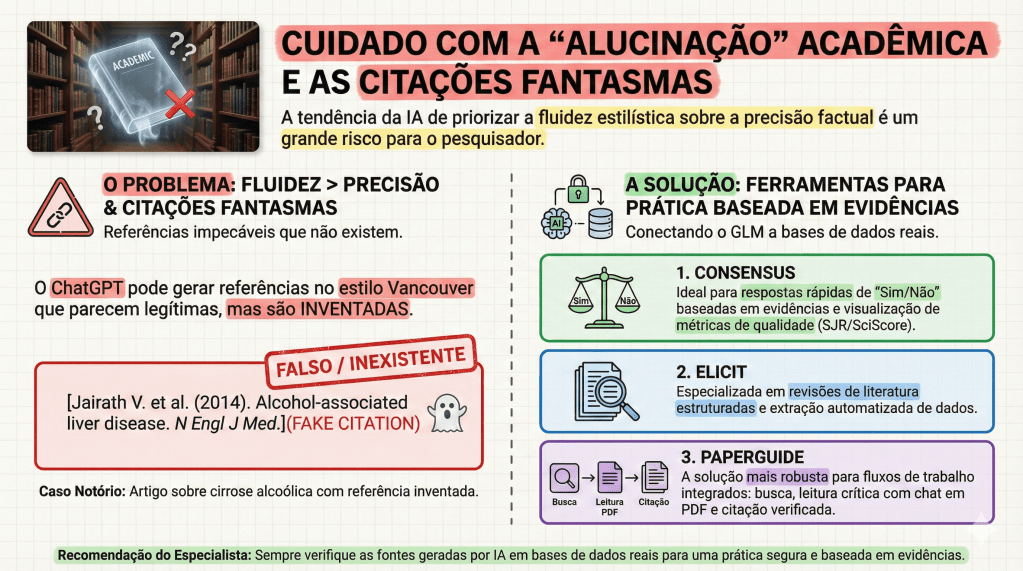
Para o fluxo de trabalho do pesquisador, é vital diferenciar as ferramentas. Modelos de chat puro (como o ChatGPT) são excelentes para síntese, mas para revisões sistemáticas, deve-se integrar ferramentas de evidência real como Elicit e Consensus. Especial destaque deve ser dado ao Paperguide: uma ferramenta “all-in-one” que, além de busca semântica, oferece suporte a múltiplos idiomas — uma vantagem estratégica para o estudante brasileiro que precisa transitar entre a literatura internacional e a prática local. O uso institucional da IA deve, portanto, ser pautado por uma cultura de ética inegociável.
6. Conclusões e Perspectivas Futuras
A Engenharia de Prompt deixará de ser um diferencial para se tornar um requisito básico, tão essencial ao cirurgião digestivo quanto o domínio da estatística básica ou do inglês técnico. Ela é a ponte entre a explosão de dados médicos e a aplicação prática à beira do leito. A mensagem central é clara: a IA deve ser utilizada para fortalecer a compreensão humana, mitigando a falha e ampliando o cuidado, sem jamais criar dependência ou o que chamamos de “pensamento fraco”. O futuro da nossa especialidade pertence àqueles que souberem interrogar a realidade — e a inteligência artificial — com a maior clareza e precisão.
#EngenhariaDePrompt #EducacaoMedica #CirurgiaDigestiva #IAnaMedicina #ResidenciaMedica
——————————————————————————–
“O sucesso da educação médica não reside apenas na transferência de fatos, mas na formação de uma mente capaz de interrogar a realidade com precisão.” — Adaptado dos princípios de William Osler
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
A Cirurgia Digestiva Atual
Princípios Fundamentais da Oncologia Cirúrgica Digestiva
Uma Abordagem Contemporânea e Baseada em Evidências
O Cenário Atual do Câncer Digestivo no Brasil
A Cirurgia do Aparelho Digestivo vive um momento de transformação sem precedentes. Não somos mais apenas “técnicos de ressecção”, mas parte integrante de uma complexa engrenagem multidisciplinar. A relevância deste tema é sublinhada pelos dados epidemiológicos alarmantes. Se no passado nos baseávamos em estimativas modestas, hoje a realidade é desafiadora: segundo a Estimativa 2023-2025 do Instituto Nacional de Câncer (INCA), esperam-se 704 mil casos novos de câncer por ano no Brasil.
Destaque-se que as neoplasias do trato gastrointestinal ocupam posições cimeiras. O câncer colorretal figura como o segundo mais incidente em mulheres e homens na maioria das regiões, com cerca de 45 mil novos casos anuais, seguido de perto pelo câncer de estômago (21 mil casos) e esôfago. Estes números não são apenas estatísticas; representam uma demanda crescente por cirurgiões oncológicos altamente qualificados, capazes de compreender não apenas a anatomia, mas a biologia tumoral.
A Biologia como Norte da Técnica Cirúrgica
Fisiopatologia e Disseminação
O entendimento clássico da cirurgia oncológica, herdado dos princípios de William Halsted no final do século XIX, baseava-se na premissa de que o câncer era uma doença puramente local que se disseminava centrifugamente. Embora a radicalidade (ressecção em bloco) permaneça um pilar, hoje compreendemos a doença como sistêmica desde fases precoces em muitos casos.
A disseminação ocorre por três vias principais que o cirurgião deve dominar:
- Linfática: Predominante em carcinomas (ex: adenocarcinoma gástrico e cólon).
- Hematogênica: Preferencial em sarcomas e carcinomas avançados (fígado e pulmões como sítios-alvo).
- Transcelômica (Peritoneal): Comum em neoplasias gástricas T3/T4, ovário e apêndice, exigindo estratégias específicas como a peritoniectomia.
O Princípio da Radicalidade e Margens (R0)
O objetivo primário da cirurgia oncológica curativa é a ressecção R0 (ausência de doença residual macroscópica e microscópica). A cirurgia R1 (doença microscópica residual) ou R2 (macroscópica) impacta drasticamente o prognóstico.
- Ressecção em Bloco: O tumor nunca deve ser violado. A peça deve ser removida envolta por tecido saudável, respeitando as fáscias anatômicas e os pedículos vasculares na sua origem.
- Linfadenectomia: Não serve apenas para estadiamento, mas tem papel terapêutico. No câncer gástrico, por exemplo, a linfadenectomia D2 é o padrão-ouro em centros especializados, associada a menor recidiva locorregional.
Neoadjuvância vs. Adjuvância
A decisão entre operar primeiro (upfront surgery) ou indicar terapia neoadjuvante é um dos grandes debates atuais.
- Vantagens da Neoadjuvância: Tratamento precoce de micrometástases, redução do tumor (downstaging) facilitando a ressecção R0 e teste in vivo da quimiossensibilidade. É o padrão atual para câncer de esôfago localmente avançado e câncer de reto médio/baixo.
- Vantagens da Adjuvância: Baseada no estadiamento patológico preciso (pTNM), evitando tratamento excessivo em estádios precoces.
Aplicação Prática na Cirurgia Digestiva
A prática moderna exige que o cirurgião diferencie dois conceitos cruciais frequentemente confundidos: Ressecabilidade e Operabilidade.
- Ressecabilidade: É uma característica do tumor (relação com estruturas vitais).
- Operabilidade: É uma característica do paciente (reserva funcional, comorbidades, status performance). Um tumor pode ser ressecável, mas o paciente inoperável.
O Papel da Citorredução e HIPEC
Para a carcinomatose peritoneal, historicamente considerada uma condição terminal, houve uma mudança de paradigma. Em neoplasias selecionadas (como pseudomixoma peritoneal, mesotelioma e alguns casos de câncer colorretal), a combinação de Cirurgia de Citorredução (Peritoniectomia) com Quimioterapia Intraperitoneal Hipertérmica (HIPEC) tem oferecido sobrevida em longo prazo, transformando uma doença fatal em uma condição crônica tratável.
Planejamento Multidisciplinar
O cirurgião oncológico não atua isolado. A discussão em Tumor Boards é mandatória. A indicação cirúrgica deve considerar a biologia molecular (ex: status do gene APC em colorretal, superexpressão de HER2 em gástrico) e a resposta a terapias sistêmicas.
Pontos-Chave para a Prática Cirúrgica
- Estadiamento Preciso: Nunca leve um paciente à sala sem um estadiamento completo. A laparoscopia diagnóstica é fundamental em tumores gástricos e pancreáticos para evitar laparotomias desnecessárias em casos de carcinomatose oculta.
- Margens Cirúrgicas: A margem circunferencial (radial) no câncer de reto e a margem proximal no câncer gástrico e esofágico são preditores independentes de sobrevida.
- Manuseio da Peça (“No-touch technique”): Evite a manipulação direta do tumor. A ligadura vascular prévia e a mobilização cuidadosa previnem a embolização tumoral intraoperatória.
- Documentação: O relatório cirúrgico deve detalhar as cadeias linfáticas dissecadas e as estruturas preservadas ou ressecadas, orientando o patologista e o oncologista clínico.
Perspectivas Futuras
A cirurgia digestiva na sua área de atuação oncológica evoluiu de amputações extensas para procedimentos de precisão, muitas vezes minimamente invasivos (laparoscópicos ou robóticos), sem perder a radicalidade oncológica. O futuro aponta para uma integração ainda maior com a biologia molecular e a imunoterapia. O cirurgião do futuro deverá ser, antes de tudo, um oncologista que opera: alguém que entende que o bisturi é apenas uma das armas, e que saber quando não operar é tão vital quanto a técnica operatória refinada.
Como nos ensinou o pai da cirurgia oncológica moderna:
“O cirurgião deve ser o médico do paciente oncológico, e não apenas o técnico que remove o tumor.” — William Stewart Halsted
Hashtags
#CirurgiaDigestiva #OncologiaCirurgica #EducaçãoMédica #ResidenciaCirurgia #CancerDigestivo
Gostou? ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat Online em nossa DM do Instagram.
A Importância da Competência em Endoscopia Flexível na Formação e Prática do Cirurgião do Aparelho Digestivo
Introdução
A endoscopia digestiva flexível transcende a sua definição clássica de método diagnóstico. Na contemporaneidade, ela se consolida como uma extensão essencial da propedêutica e da terapêutica cirúrgica. Historicamente, é imperativo recordar que a endoscopia é um campo desbravado por cirurgiões. Grandes marcos, como a polipectomia colônica (Dr. Hiromi Shinya), a ligadura elástica de varizes (Dr. Goffredo Steigman) e a gastrostomia percutânea (Dr. Jeffrey Ponsky), foram estabelecidos por mentes cirúrgicas que vislumbravam além da incisão convencional. No entanto, observa-se um fenômeno preocupante na formação médica atual: a delegação progressiva dessa competência quase exclusivamente à gastroenterologia clínica e aos Endoscopistas. Este artigo, direcionado a estudantes, residentes e pós-graduandos, visa reafirmar a premissa de que a habilidade endoscópica não é opcional, mas intrínseca à prática do cirurgião do aparelho digestivo de excelência. Discutiremos as bases técnicas, a aplicabilidade clínica e a necessidade premente de retomar o protagonismo nesta área.
Desenvolvimento: O Cirurgião e a Habilidade Endoscópica
A Curva de Aprendizado e a Visão Cirúrgica
A competência em endoscopia flexível depende da fusão entre conhecimento cognitivo e habilidade técnica (psicomotora). O cirurgião, habituado à manipulação tecidual e à anatomia tridimensional (seja por via aberta ou laparoscópica), possui, intrinsecamente, uma coordenação olho-mão refinada. Estudos demonstram que cirurgiões tendem a apresentar uma curva de aprendizado acelerada para procedimentos endoscópicos devido à sua familiaridade com a anatomia topográfica e patológica, permitindo uma transição fluida entre a visão bidimensional da tela e a realidade espacial do órgão.
O Cenário Brasileiro e a Demografia Médica
No contexto do Brasil, um país de dimensões continentais, a distribuição de especialistas é heterogênea. Segundo dados da Demografia Médica no Brasil (CFM/USP, 2023), a concentração de gastroenterologistas clínicos | endoscopistas é significativamente menor e mais centralizada em grandes capitais do que a de cirurgiões gerais. O cirurgião geral, muitas vezes, é o único provedor de saúde especializado em regiões remotas. Portanto, capacitar o cirurgião em endoscopia não é apenas uma questão de reserva de mercado, mas uma estratégia de saúde pública para garantir o rastreamento de neoplasias (como o câncer colorretal) e o atendimento de urgências (Hemorragia Digestiva Alta) em todo o território nacional.
Do “Cirurgião de Resgate” ao “Cirurgião Estrategista”
Tradicionalmente, o cirurgião é chamado apenas quando ocorre uma complicação endoscópica, como perfuração ou sangramento incontrolável. Este paradigma do “cirurgião de resgate” deve evoluir para o de “cirurgião estrategista”. Ao dominar a endoscopia, o profissional torna-se o capitão do navio terapêutico, capaz de indicar, executar e, se necessário, converter procedimentos com total autonomia e continuidade do cuidado (Continuity of Care), otimizando desfechos e minimizando a fragmentação do tratamento.
Aplicação na Cirurgia Digestiva
A integração da endoscopia na rotina cirúrgica pode ser categorizada em três momentos cruciais:
1. Endoscopia Pré-Operatória: O Planejamento
Na cirurgia oncológica gástrica e esofágica, a endoscopia realizada pelo próprio cirurgião permite uma avaliação precisa das margens tumorais, da extensão para a cárdia ou piloro, influenciando diretamente a decisão entre uma gastrectomia total ou subtotal. Na cirurgia bariátrica, a identificação prévia de hérnias hiatais, esofagites severas ou patologias gástricas altera o algoritmo de tratamento, contraindicando, por exemplo, uma gastrectomia vertical (Sleeve) em favor de um bypass gástrico em Y de Roux.
2. Endoscopia Intraoperatória: A Segurança
O uso transoperatório é uma ferramenta de segurança inestimável. Exemplos clássicos incluem:
- Cardiomiotomia de Heller: Confirmação da adequação da miotomia e teste de vazamento (air leak test) para exclusão de perfurações mucosas.
- Exploração de Vias Biliares: O uso do coledocoscópio flexível permite a visualização direta e a certeza da remoção completa de cálculos, superior à colangiografia em casos complexos.
- Localização de Lesões: Em cirurgias colorretais laparoscópicas, a tatuagem prévia pode ser imprecisa; a colonoscopia intraoperatória garante a ressecção do segmento correto.
3. Endoscopia Pós-Operatória e Manejo de Complicações
O cirurgião que realiza a endoscopia está melhor posicionado para tratar as complicações de seus próprios procedimentos ou de seus pares. O arsenal terapêutico inclui:
- Dilatação com balão de estenoses de anastomoses (gástricas ou colorretais).
- Tratamento de fístulas e deiscências pós-Sleeve ou Bypass com uso de próteses autoexpansíveis ou clips endoscópicos.
- Hemostasia de linhas de sutura sangrantes.
A Era da Cirurgia Sem Cicatrizes (NOTES e Endoterapia)
Caminhamos para a era da intervenção minimamente invasiva máxima. Procedimentos como o POEM (Peroral Endoscopic Myotomy) substituem a miotomia laparoscópica; o Endoscopic Sleeve Gastroplasty (ESG) surge como alternativa à cirurgia bariátrica convencional. O cirurgião do futuro deve dominar estas técnicas para oferecer o tratamento “estado da arte” aos seus pacientes.
Pontos-Chave para o Residente e o Cirurgião Jovem
- Necessidade de Treinamento: As sociedades cirúrgicas (como o CBC e a CBCD no Brasil) têm enfatizado a importância de currículos de residência que contemplem carga horária prática em endoscopia.
- Visão Integral: O domínio da luz luminal (endoscopia) e da cavidade peritoneal (laparoscopia/robótica) cria um cirurgião completo.
- Autonomia: A capacidade de diagnosticar, estadiar, tratar e resolver complicações sem depender de terceiros é o ápice da eficiência clínica.

Conclusão
A endoscopia flexível não é uma especialidade à parte, mas uma ferramenta cirúrgica, tal qual o bisturi ou a pinça laparoscópica. Para o cirurgião do aparelho digestivo, delegar essa competência é abdicar de uma parte fundamental da sua herança histórica e do seu futuro profissional. A formação médica deve encorajar a retomada deste espaço, garantindo que as novas gerações de cirurgiões sejam proficientes tanto na ciência da cirurgia quanto na arte da endoscopia. Como mentores e instituições de ensino, nosso dever é prover o acesso e a estrutura para que essa integração seja a norma, e não a exceção.
“Nenhum homem pode ser um grande cirurgião sem ser também um grande médico; e o inverso é igualmente verdadeiro no que tange ao diagnóstico e compreensão da fisiopatologia.” > — Adaptado de Theodor Billroth, pai da cirurgia gástrica moderna, refletindo a necessidade do conhecimento integral.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaDigestiva #EndoscopiaTerapeutica #ResidenciaMedica #CirurgiaGeral #EducacaoMedica
Lifelong Learning na Cirurgia: como a Aprendizagem Autorregulada Define o Cirurgião que Você Vai Ser
Introdução
A cirurgia é uma das áreas da medicina que mais muda ao longo do tempo. Técnicas, tecnologias, diretrizes e condutas são revisadas continuamente. Ninguém termina a residência “pronto para tudo”. O que diferencia o cirurgião que se mantém competente e atualizado ao longo da carreira não é apenas o que aprendeu na formação inicial, mas a capacidade de continuar aprendendo de forma ativa, intencional e estruturada.
Esse é o núcleo do conceito de Lifelong Learning: o compromisso de adquirir, revisar e integrar novos conhecimentos desde o primeiro dia de faculdade até o último dia de atividade profissional. E, na prática, o que sustenta isso é um conjunto de habilidades chamado aprendizagem autorregulada.
O problema: bons alunos, maus aprendizes
Grande parte dos estudantes que chegam à residência é formada por “altos desempenhos acadêmicos”. Mas muitos:
- atribuem sucesso e fracasso quase sempre ao professor, ao serviço ou ao tipo de prova;
- não conseguem descrever com clareza como estudam;
- acreditam que aprender é algo que “acontece com eles”, não algo que podem controlar.
Esse modelo funciona em um ambiente escolar tradicional, com provas previsíveis e conteúdo delimitado. Em cirurgia, não. No centro cirúrgico, na UTI ou no pronto-socorro, o cirurgião depende de outra coisa: da capacidade de identificar o que não sabe, de estudar com foco e de ajustar a própria prática a partir de resultados reais.
É aqui que entra a aprendizagem autorregulada.
O que é aprendizagem autorregulada?
Aprendizagem autorregulada é o conjunto de hábitos, estratégias e atitudes que fazem o aluno assumir o controle do próprio processo de aprendizagem.
Um aprendiz autorregulado:
- pensa sobre como aprende (metacognição);
- acredita que é capaz de melhorar com esforço e estratégia (autoeficácia realista);
- organiza o ambiente, o tempo e os recursos para aprender melhor (comportamento ativo).
Na prática, isso aparece em três dimensões:
1. Metacognitiva
- Define objetivos de aprendizado (“quero entender critérios de indicação de neoadjuvância no pâncreas”, “quero melhorar decisão em vesícula difícil”).
- Planeja como chegar lá (o que ler, que casos observar, que vídeos rever).
- Monitora se está, de fato, avançando.
- Se autoavalia com honestidade ao final.
2. Motivacional
- Liga esforço a desempenho.
- Não se vê como “bom” ou “ruim”, mas como alguém em processo de desenvolvimento.
- Usa erros como feedback, não como sentença.
3. Comportamental
- Seleciona ativamente casos, plantões e oportunidades que trazem aprendizado.
- Busca ajuda, feedback e coaching quando necessário.
- Usa estratégias de estudo estruturadas, não apenas leitura passiva.
O ciclo da aprendizagem autorregulada
Você pode enxergar esse processo como um ciclo contínuo:
- Planejamento (forethought)
- O que quero aprender?
- Por que isso é importante agora?
- Quanto tempo vou dedicar? Com que materiais?
- Execução (performance)
- Implementar o plano (leitura, vídeo, simulação, prática supervisionada).
- Monitorar em tempo real: estou entendendo? estou apenas decorando? estou aplicando?
- Reflexão (self-reflection)
- O que funcionou? O que não funcionou?
- O problema foi falta de esforço, estratégia inadequada, falta de recurso ou algo fora do meu controle?
- O que vou manter, o que vou mudar no próximo ciclo?
Quem atribui tudo a “azar”, “caso difícil”, “erro do serviço” sai mais fraco do caso.
Quem atribui a fatores ajustáveis (estratégia, preparação, decisão) sai mais forte, mesmo depois de um erro.
Ferramentas práticas para residentes e cirurgiões
1. Autoavaliação de como você aprende
Não é apenas “sou bom ou ruim”, mas:
- eu planejo o que estudar ou vou “apagando incêndio”?
- eu mudo de estratégia quando não entendo um tema?
- eu reviso os casos difíceis depois do plantão?
- eu procuro ativamente feedback objetivo sobre minha performance?
Transformar isso em rotina escrita (um caderno, um app, uma planilha) ajuda a tirar a aprendizagem do improviso e colocá-la em modo profissional.
2. Coaching cirúrgico
Coaching não é “mais uma aula”; é uma conversa estruturada para:
- definir objetivos de melhoria claros (ex.: decisão de conversão; planejamento de colecistectomia difícil; comunicação com a equipe);
- identificar pontos cegos (o que você não está vendo sobre a própria prática);
- desenhar um plano concreto de treinamento e estudo.
Ferramentas de vídeo-coaching (assistir a uma operação sua com um colega experiente e revisar decisões, tempos e manobras) têm efeito duplo: refinam a técnica e amplificam a sua metacognição.
3. Leitura inteligente: saindo do “sublinhar tudo”
Um exemplo prático é a estratégia SQ3R para capítulos e diretrizes:
- Survey (percurso) – passar rapidamente pelos subtítulos, tabelas, figuras.
- Question (perguntas) – transformar subtítulos em perguntas (“quando indicar intervalo apendicectomia?”, “como manejar abscesso apendicular?”).
- Read (leitura) – ler com foco em responder suas próprias perguntas.
- Recall (recordar) – fechar o texto e anotar o que lembra de cabeça.
- Review (revisar) – conferir no texto e corrigir lacunas.
É mais trabalhoso do que reler passivamente, mas a retenção é muito maior — e é isso que interessa na prática cirúrgica.
Aplicando isso na formação cirúrgica
Na rotina de um serviço de cirurgia, aprendizagem autorregulada se traduz em ações muito concretas:
- Antes do plantão: definir 1–2 objetivos de aprendizado (por exemplo, “revisar escore de Alvarado e conduta em apendicite complicada”).
- Durante o plantão: escolher conscientemente 1–2 casos para estudar em profundidade depois.
- Após a cirurgia: registrar rapidamente:
- o que foi bem,
- o que não foi,
- o que você precisa estudar para a próxima situação semelhante.
No nível do serviço, vale estimular:
- discussão de M&M com foco em análise de processo, não apenas em “culpa”;
- preceptores que verbalizam seu raciocínio e seus próprios erros;
- metas claras por ano de residência (o que se espera que o R1, R2, R3 saiba de fato).
Pontos-chave para o cirurgião que quer ser lifelong learner
- Assuma o comando do próprio aprendizado – ninguém fará isso por você.
- Planeje o estudo como planeja uma cirurgia – com objetivo, estratégia e checagem.
- Use erro e desconforto como combustível, não como fonte de paralisia.
- Busque feedback específico, não elogios genéricos.
- Padronize suas estratégias de leitura e revisão, fuja do improviso.
Conclusão
Formar um cirurgião tecnicamente competente é obrigatório.
Formar um cirurgião capaz de continuar aprendendo, se adaptando e se avaliando ao longo da vida é o verdadeiro diferencial.
Lifelong learning não é um slogan bonito de documento institucional.
É uma competência prática, treinável, que começa na residência, mas precisa acompanhar cada decisão, cada leitura, cada caso difícil.
Quanto mais cedo você organizar o próprio processo de aprender, mais preparado estará para os desafios que ainda nem existem hoje – mas que certamente farão parte da cirurgia de amanhã.
Hashtags (SEO)
#LifelongLearningEmCirurgia #AprendizagemAutorregulada #FormaçãoDoCirurgião #EducaçãoMédicaContinuada #ResidênciaEmCirurgia
Gostou❔ Deixe seu comentário ✍️, compartilhe com seus colegas e mande sua dúvida pelo 💬 Chat On-line em nossa DM no Instagram.
Neoadjuvância no Adenocarcinoma de Pâncreas: Evidências e Aplicações Clínicas
Introdução
O adenocarcinoma de pâncreas é uma das neoplasias mais agressivas do trato gastrointestinal, caracterizada por diagnóstico tardio, baixa ressecabilidade e alta taxa de recorrência. Apesar dos avanços técnicos e terapêuticos, a sobrevida global em 5 anos permanece inferior a 10%. A terapia neoadjuvante (quimioterapia com ou sem radioterapia antes da cirurgia) vem ganhando papel central, especialmente em tumores localmente avançados, borderline ressecáveis e, em casos selecionados, em tumores ressecáveis. Seu objetivo é tratar micrometástases precoces, aumentar taxas de ressecção R0 e selecionar pacientes com melhor biologia tumoral para cirurgia.
Racional da Neoadjuvância
- Controle sistêmico precoce: trata micrometástases antes da cirurgia.
- Seleção de pacientes: evita cirurgias em pacientes com progressão rápida da doença.
- Maior chance de completar quimioterapia: até 50% dos pacientes não recebem adjuvância após pancreatectomia devido à morbidade.
- Aumento da taxa de R0: margens negativas são fator prognóstico chave.
Evidências Recentes
- Borderline ressecável: ensaios mostram benefício claro. Regimes como FOLFIRINOX ou gemcitabina/nab-paclitaxel aumentam ressecabilidade e sobrevida global.
- Ressecáveis: ainda em estudo, mas meta-análises sugerem equivalência ou até superioridade em pacientes com alto risco prognóstico (ex.: CA 19-9 elevado).
- Radioterapia: pode melhorar controle local, mas seu papel isolado ainda é controverso.
O estudo PREOPANC (fase III, multicêntrico) demonstrou que quimiorradioterapia neoadjuvante não aumentou complicações maiores, fístula pancreática ou mortalidade pós-operatória, reforçando a segurança da estratégia.
Critérios para Indicar Neoadjuvância em Tumores Ressecáveis
- Marcadores de alto risco:
- CA 19-9 >150–250 U/mL
- Tumor ≥35 mm
- Albumina ≤3,5 g/dL
- Relação neutrófilo-linfócito ≥3,5
- Dupan-2 ≥750 U/mL
- Achados clínicos e radiológicos:
- Linfonodomegalia suspeita
- Invasão vascular incipiente
- Sinais sistêmicos de agressividade
- Preocupação com adesão ao adjuvante:
- Pacientes frágeis ou comorbidades que dificultem completar quimioterapia após cirurgia.
Taxa de Abandono da Neoadjuvância
- Varia entre 15–30% nos principais estudos.
- Motivos: toxicidade da quimioterapia, progressão tumoral, deterioração clínica ou recusa do paciente.
- Estratégia exige acompanhamento multidisciplinar próximo e suporte intensivo para reduzir perdas.
Segurança Cirúrgica
Estudos randomizados e coortes demonstram que a neoadjuvância não aumenta o risco de complicações pós-operatórias, incluindo fístula pancreática, infecção intra-abdominal e mortalidade hospitalar. Em alguns trabalhos, observou-se até redução da incidência de fístula pancreática clinicamente relevante.
Pontos-Chave para a Prática
- Padrão atual: recomendado em borderline ressecáveis.
- Ressecáveis: indicado em casos com fatores de alto risco.
- Regimes preferenciais: FOLFIRINOX (pacientes com bom performance status); gemcitabina/nab-paclitaxel em casos selecionados.
- Multidisciplinaridade é essencial: decisão deve envolver oncologia, cirurgia, radiologia e gastroenterologia.
Conclusão
A terapia neoadjuvante no adenocarcinoma de pâncreas representa um avanço significativo, transformando a abordagem tradicional baseada em cirurgia seguida de adjuvância. Atualmente, é padrão para tumores borderline ressecáveis, considerada em tumores ressecáveis com alto risco prognóstico, e investigada em ensaios clínicos como alternativa ao tratamento clássico. O futuro caminha para uma estratificação mais refinada baseada em biomarcadores, imagem funcional e resposta precoce ao tratamento, permitindo individualizar a neoadjuvância e maximizar o benefício oncológico.
“O futuro da cirurgia oncológica não é apenas retirar o tumor, mas entender a biologia da doença e intervir no momento certo.” — Veronesi
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#PancreaticCancer #Neoadjuvância #OncologiaCirúrgica #CirurgiaDigestiva #EducaçãoMédicaContinuada
Inteligência Artificial & Apendicite Aguda
Uso da Inteligência Artificial Generativa no Diagnóstico, Tratamento Cirúrgico e Avaliação de Prognóstico da Apendicite Aguda
Introdução
A apendicite aguda continua sendo a causa mais comum de abdome agudo cirúrgico no mundo, com incidência estimada de 100 a 150 casos por 100.000 habitantes ao ano. No Brasil, representa uma das principais causas de internação cirúrgica no SUS. Apesar de amplamente estudada e com tratamento bem estabelecido, a apendicite aguda ainda apresenta desafios clínicos, como o diagnóstico precoce, a decisão operatória e a estratificação de risco de complicações. Nesse contexto, a Inteligência Artificial Generativa (IAG) emerge como uma tecnologia disruptiva com potencial transformador na abordagem cirúrgica dessa condição.
Diagnóstico com Apoio de IA Generativa
O diagnóstico precoce da apendicite aguda depende da correlação de dados clínicos, laboratoriais e de imagem. A IAG, treinada com grandes volumes de dados de prontuários eletrônicos, imagens de tomografia e ultrassonografias, pode sintetizar essas informações em tempo real para gerar hipóteses diagnósticas com acurácia comparável — e, em alguns casos, superior — à avaliação humana isolada. Modelos generativos baseados em deep learning, como os transformers, são capazes de identificar padrões sutis de apresentação clínica atípica, sobretudo em populações vulneráveis, como crianças pequenas, idosos e gestantes. Um exemplo prático é o uso de sistemas que combinam texto livre do prontuário com imagens de abdome para gerar relatórios diagnósticos automatizados e sugerir scores clínicos (como Alvarado ou AIR score) com ajuste probabilístico personalizado, auxiliando o cirurgião na tomada de decisão.
Tratamento Cirúrgico Guiado por IA
A cirurgia laparoscópica é o padrão ouro no tratamento da apendicite aguda, mas a escolha do momento cirúrgico e a abordagem ideal ainda são decisões dependentes da experiência do cirurgião e das condições clínicas do paciente. A IAG pode ser integrada a sistemas de suporte intraoperatório, auxiliando em navegação cirúrgica assistida por imagem, sugestão de condutas intraoperatórias com base em bancos de dados operatórios, e até mesmo em treinamento em simulações realistas de apendicectomia via realidade aumentada e modelos generativos de anatomia personalizada.
Em cenários de medicina robótica, já há estudos utilizando IA generativa para gerar “scripts” de procedimentos otimizados e oferecer feedback em tempo real com base em dados históricos de performance técnica — promovendo cirurgias mais seguras, rápidas e com menor taxa de complicações.
Avaliação Prognóstica com IA Generativa
A estratificação de risco no pós-operatório é outro campo onde a IAG pode oferecer avanços concretos. A partir de redes neurais treinadas em desfechos de milhares de pacientes com apendicite, esses modelos podem prever probabilidades de complicações como abscesso residual, íleo paralítico ou necessidade de reabordagem, considerando variáveis clínicas, laboratoriais, intraoperatórias e demográficas. Além disso, ferramentas baseadas em IA podem gerar relatórios individualizados de prognóstico funcional, tempo estimado de retorno às atividades e risco de reinternação, permitindo ao cirurgião personalizar o plano de alta, acompanhamento ambulatorial e orientações ao paciente com maior precisão.
Pontos-Chave
- A IA generativa tem capacidade de analisar simultaneamente dados clínicos, laboratoriais e de imagem para melhorar o diagnóstico precoce da apendicite aguda.
- Pode ser integrada à decisão cirúrgica, tanto no pré quanto no intraoperatório, por meio de simulação, navegação assistida e análise de performance técnica.
- Modelos preditivos baseados em IA oferecem ferramentas objetivas para prognóstico pós-operatório personalizado, otimizando o seguimento do paciente.
- O uso de IAG deve ser encarado como ferramenta complementar ao raciocínio clínico do cirurgião, jamais como substituto da experiência e do julgamento médico.
- O avanço dessas tecnologias requer formação crítica e ética dos futuros cirurgiões, capacitando-os para liderar a incorporação segura e eficaz dessas ferramentas na prática assistencial.
Conclusão
A incorporação da Inteligência Artificial Generativa na cirurgia do aparelho digestivo representa um novo paradigma na medicina personalizada, baseada em dados e centrada no paciente. No caso da apendicite aguda — uma das mais frequentes emergências cirúrgicas —, o uso responsável e crítico da IAG pode aprimorar significativamente os pilares do cuidado: diagnóstico, decisão operatória e prognóstico. O cirurgião do futuro será, acima de tudo, um líder clínico capaz de integrar inteligência humana e artificial com sabedoria e discernimento ético.
“A tecnologia não substitui o cirurgião. Ela amplia sua visão, mas é o julgamento humano que decide a incisão.” — Sir John Black, ex-presidente do Royal College of Surgeons
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#InteligenciaArtificialNaMedicina #CirurgiaDoAparelhoDigestivo #ApendiciteAguda #DiagnósticoComIA #CirurgiaGuiadaPorDados
Colecistectomia Robótica
A colecistectomia, procedimento cirúrgico para remoção da vesícula biliar, pode ser realizada por diferentes abordagens, sendo as mais comuns a via laparoscópica (1985), a assistida por robô (1987) e a cirurgia convencional ou aberta (1882). Cada uma dessas técnicas tem vantagens e desvantagens em termos de custo, eficácia clínica e complexidade, o que torna a análise de custo-efetividade crucial para a escolha da abordagem mais adequada em cada caso.
Colecistectomia Laparoscópica (CVL)
A colecistectomia laparoscópica (CVL) é amplamente reconhecida como a técnica de escolha devido à sua eficácia, recuperação rápida e menor custo comparado a outras abordagens. Diversos estudos confirmam que a laparoscopia é a opção mais custo-efetiva para a maioria dos pacientes com doenças benignas da vesícula biliar, como a colelitíase, devido ao menor custo direto das etapas cirúrgicas.
Estudos de Custo-efetividade indicam que o custo variável direto para o cirurgião na execução de uma colecistectomia laparoscópica foi significativamente inferior ao de técnicas mais complexas. A via laparoscópica custou, em média, $929, enquanto a colecistectomia assistida por robô (ROBOSILS) alcançou o custo de $2,608. Isso demonstra que a laparoscopia tem uma vantagem substancial em termos de custo sem comprometer a qualidade do procedimento.
Colecistectomia Robótica
Por outro lado, a colecistectomia assistida por robô tem ganhado popularidade devido à promessa de maior precisão, visualização e controle durante a cirurgia. No entanto, sua viabilidade econômica tem sido amplamente discutida na literatura, com estudos demonstrando que, embora seja uma técnica segura, os custos hospitalares associados a ela são consideravelmente mais altos. Em um estudo de caso-controle, os custos totais hospitalares para a cirurgia robótica foram de $7,985.4, em comparação com $6,255.3 para a laparoscopia. A maior parte desses custos adicionais vem dos gastos com a amortização e os consumíveis do sistema robótico, que são significativamente mais caros. Outra análise revelou uma razão de custo-efetividade da cirurgia robótica de $1,795,735.21 por ano de vida ajustado pela qualidade, um valor muito acima dos limiares aceitáveis para a maioria dos sistemas de saúde. Além disso, um banco de dados nacional demonstrou que, enquanto a colecistectomia robótica pode oferecer benefícios como redução do tempo de internação, os custos globais continuam elevados devido aos custos variáveis e consumíveis associados ao uso da tecnologia robótica, fazendo com que essa técnica não seja necessariamente mais custo-efetiva, mesmo em contextos que poderiam sugerir vantagens clínicas.
Colecistectomia Convencional ou Abertia (Via Laparotômica)
A colecistectomia convencional, ou aberta, apresenta indicações específicas, sendo geralmente reservada para situações onde a abordagem laparoscópica não oferece segurança ou viabilidade adequada. Esta modalidade cirúrgica encontra suas principais indicações em casos de inflamação severa, particularmente na colecistite aguda complicada, onde o risco de complicações durante a laparoscopia se mostra elevado, bem como em pacientes com histórico de múltiplas intervenções abdominais prévias que resultaram em aderências extensas. A suspeita de malignidade da vesícula biliar também constitui indicação relevante para a abordagem aberta, dada a necessidade de acesso mais amplo para ressecção e avaliação adequada. Ademais, pacientes com condições médicas que contraindicam anestesia geral prolongada ou que apresentam comorbidades significativas com elevado risco cirúrgico podem ser considerados candidatos à abordagem convencional, especialmente quando se antecipa a possibilidade de conversão do procedimento laparoscópico. Em determinados grupos, como idosos ou portadores de hepatopatias avançadas, a escolha entre as abordagens laparoscópica e aberta demanda análise criteriosa, ponderando-se riscos e benefícios específicos de cada caso. Desta forma, a colecistectomia convencional mantém-se como opção cirúrgica fundamental para casos complexos ou de alto risco, nos quais a segurança do paciente constitui o principal determinante da escolha terapêutica.
Indicando a Melhor Abordagem para o Paciente
A escolha da abordagem cirúrgica para a colecistectomia pode ser influenciada por uma série de fatores, incluindo a condição clínica do paciente, as características da doença e os custos. A colecistectomia laparoscópica continua sendo a técnica de escolha para a maioria dos pacientes com doenças benignas da vesícula biliar devido à sua eficácia comprovada e menor custo. Além disso, estudos sugerem que a colecistectomia robótica pode ser considerada em casos específicos, como:
- Pacientes com doença hepática avançada, onde a probabilidade de conversão para cirurgia aberta é menor e o tempo de internação é reduzido.
- Contextos de treinamento cirúrgico, onde a precisão e a visualização aprimorada podem ser cruciais.
No entanto, mesmo nesses casos, é importante ponderar os custos adicionais envolvidos e os benefícios clínicos específicos que a cirurgia robótica pode oferecer, considerando que, em geral, as vantagens não são suficientes para justificar o alto custo.
Considerações Finais sobre a Abordagem Convencional e Robótica
Embora a colecistectomia robótica tenha algumas vantagens técnicas, ela não é superior em termos de desfechos clínicos quando comparada à laparoscopia, o que faz com que a escolha por esta última, em termos de custo-benefício, seja preferível na grande maioria dos casos. A colecistectomia laparoscópica oferece uma recuperação mais rápida, menor dor pós-operatória, menos complicações e melhores resultados estéticos, com menor tempo de internação. Além disso, a técnica laparoscópica convencional tem uma mortalidade operatória baixa e um risco de lesão do ducto biliar de aproximadamente 0,5%, valor que é três vezes maior que o encontrado na cirurgia aberta. Por outro lado, a colecistectomia robótica tem se mostrado vantajosa apenas em contextos específicos, como na redução da taxa de conversão para cirurgia aberta em colecistite aguda. Contudo, o risco aumentado de lesões do ducto biliar com a abordagem robótica é uma preocupação adicional que deve ser considerada.
Conclusão
Em resumo, enquanto a colecistectomia laparoscópica continua sendo a técnica de escolha padrão devido ao seu custo-benefício superior e resultados clínicos satisfatórios, a colecistectomia assistida por robô pode ser útil em casos específicos, como doença hepática avançada ou treinamento cirúrgico. No entanto, os custos elevados da técnica robótica não são amplamente justificados por melhorias nos desfechos clínicos, o que reforça a técnica laparoscópica como a abordagem mais custo-efetiva para a maioria dos pacientes.
Pontos-Chave
- Colecistectomia Convencional : Esta técnica é indicada em casos onde a abordagem minimamente invasiva não é viável, como em colecistite aguda complicada com fistulizações ou em pacientes com histórico de múltiplas cirurgias abdominais por laparotomia. No Brasil, cerca de 10% das colecistectomias ainda são realizadas de maneira convencional, de acordo com dados do DATASUS. O procedimento por via convencional apresenta uma taxa de complicações como lesão do ducto biliar em torno de 0.15%, porém, vem com um período de recuperação mais prolongado e uma maior dor pós-operatória.
- Colecistectomia Laparoscópica: Tornou-se o padrão-ouro para a maioria dos casos devido à sua menor invasividade, resultando em menor tempo de hospitalização e recuperação mais rápida. Estudos indicam que no Brasil, aproximadamente 90% das colecistectomias são laparoscópicas. No entanto, a laparoscopia ainda carrega um risco de lesão do ducto biliar que, embora baixo (cerca de 0.5%), é três vezes maior do que na técnica aberta.
- Colecistectomia Robótica: Oferece precisão e visualização 3D, mas com um custo significativamente mais alto. Dados recentes no Brasil mostram que a prática da cirurgia robótica está crescendo, embora ainda seja limitada devido ao custo e disponibilidade de equipamentos. A técnica robótica pode reduzir a necessidade de conversão para cirurgia aberta em pacientes com condições hepáticas complicadas, mas a incidência de lesão do ducto biliar é potencialmente maior, chegando a ser até 5 vezes mais alta do que na laparoscopia, segundo alguns estudos.
Aplicação na Cirurgia Digestiva
A escolha da técnica deve ser baseada na condição do paciente, na expertise do cirurgião e na disponibilidade de recursos. No contexto brasileiro, onde o acesso a tecnologia de ponta pode ser desigual, a laparoscopia tem sido a escolha preferencial por equilibrar custo e eficácia. Entretanto, a cirurgia robótica pode ser considerada em cenários específicos, como em pacientes com doença hepática avançada ou em instituições com investimento em tecnologia robótica.
- Custo: Laparoscópica < Convencional < Robótica.
- Segurança: Convencional e Laparoscópica com taxas comparáveis de complicações, embora com diferentes perfis de risco.
- Eficácia: Todas as técnicas são eficazes, mas a laparoscópica é a mais custo-efetiva para a maioria dos casos.
- Recuperação: Laparoscópica e Robótica oferecem recuperação mais rápida.
“Nós cirurgiões devemos compreender que a tecnologia é meramente um instrumento, não uma solução milagrosa, e sua aplicação deve ser ponderada com cautela, levando em conta o equilíbrio entre segurança, desfechos clínicos e custos assistenciais.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#Colecistectomia #Laparoscopia #CirurgiaRobótica #CustoEfetividade #SaúdeDigestiva
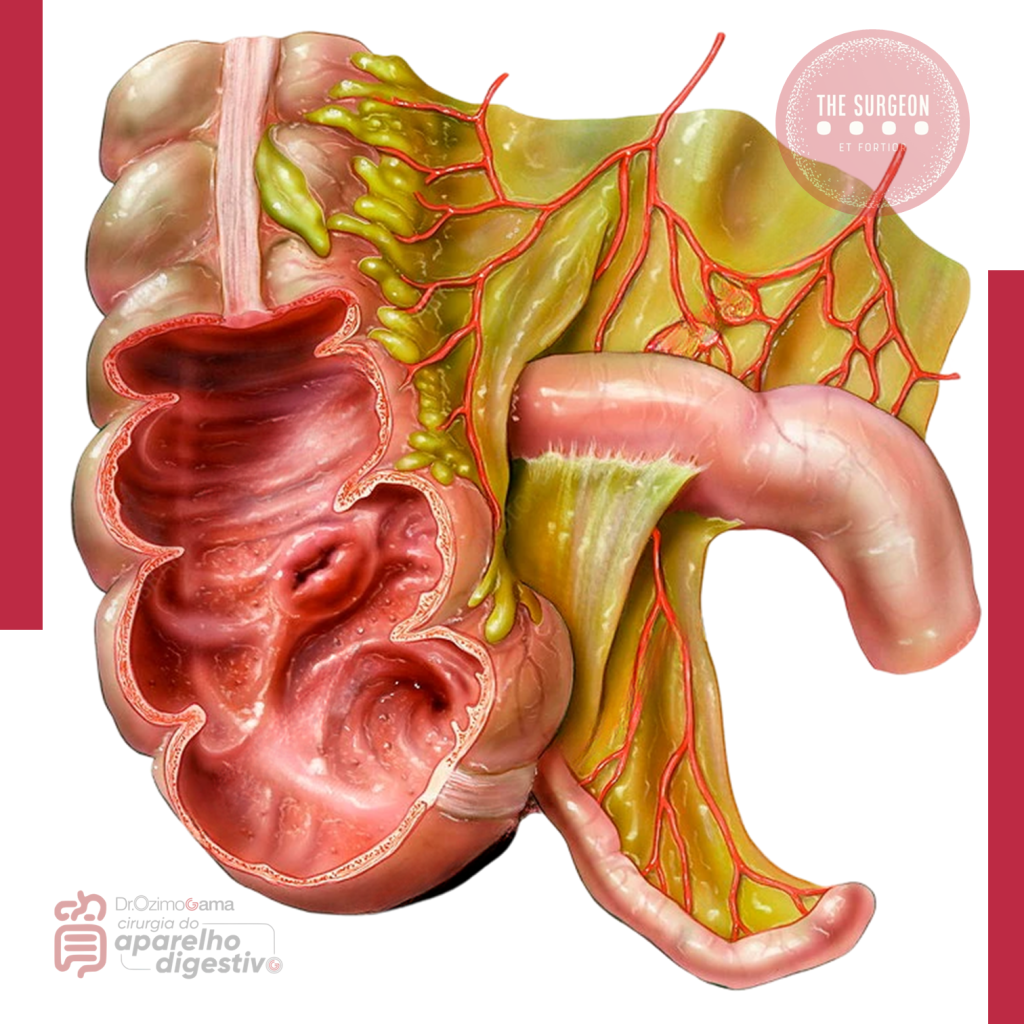
Qual a função do Apêndice Vermiforme?
Aspectos Morfofuncionais para a Prática Cirúrgica no Tratamento das Doenças do Aparelho Digestivo
Introdução
O apêndice vermiforme, um pequeno órgão tubular que se projeta da porção inicial do cólon, é frequentemente considerado um vestígio evolutivo de nossa anatomia. Por muitos anos, o apêndice foi visto como uma estrutura funcionalmente irrelevante, com muitos cientistas acreditando que ele não desempenhava papel significativo no organismo humano. No entanto, pesquisas recentes sugerem que o apêndice pode ter funções morfofuncionais importantes, especialmente relacionadas ao microbioma intestinal, à imunidade e à proteção contra infecções intestinais. Este texto visa revisar os aspectos morfofuncionais do apêndice vermiforme, abordando sua relevância clínica e as implicações para a cirurgia do aparelho digestivo, com ênfase nas considerações cirúrgicas que impactam a saúde intestinal dos pacientes.
Desenvolvimento
Estrutura Morfológica do Apêndice
O apêndice vermiforme é uma pequena projeção tubular que se conecta ao ceco, parte inicial do cólon. Em termos de estrutura, é caracterizado por uma extremidade distal fechada e uma mucosa rica em tecido linfático. A morfologia do apêndice pode variar consideravelmente entre as espécies, o que reflete uma adaptação evolutiva. Embora sua forma e tamanho sejam semelhantes nos humanos, a função dessa estrutura evoluiu de maneira distinta em diferentes mamíferos, sugerindo que o apêndice tem um papel importante na sobrevivência de várias espécies. Em humanos, o apêndice contém uma rica rede de células do sistema imune, como as células M, responsáveis por capturar patógenos e apresentar antígenos às células T. Essa função imunológica sugere que o apêndice pode atuar como um “campo de treinamento” para o sistema imunológico, fortalecendo a defesa contra agentes patogênicos.
Funções Funcionais: Microbioma e Imunidade
Recentes estudos indicam que o apêndice tem um papel essencial na manutenção da saúde intestinal e na proteção contra doenças. Uma das principais funções atribuídas ao apêndice é seu envolvimento na preservação da flora bacteriana intestinal benéfica. O apêndice serve como um “refúgio” para essas bactérias, permitindo que elas sobrevivam durante episódios de diarreia ou outras condições que comprometem o microbioma intestinal. Acredita-se que, após uma infecção gastrointestinal, as bactérias benéficas podem repovoar o cólon a partir do apêndice, ajudando a restaurar o equilíbrio microbiano.
Em estudos realizados com primatas, observou-se que os animais com apêndice intacto apresentavam menor incidência de diarreia grave em comparação com os que haviam passado por apendicectomia. Além disso, a remoção do apêndice foi associada a um aumento no risco de infecções graves, como infecções por Salmonella não tifoide, o que reforça a ideia de que o apêndice tem um papel imunológico crucial.
Outro aspecto importante do apêndice é sua contribuição para a resposta imune. As células M, encontradas em grande número na mucosa do apêndice, desempenham papel fundamental na detecção e eliminação de patógenos, funcionando como uma linha de defesa inicial no intestino. Além disso, o apêndice parece atuar como um centro de amadurecimento para células imunes, o que contribui para a vigilância contra infecções.
Apendicectomia e suas Implicações Clínicas
A apendicectomia, apesar de ser uma das cirurgias mais comuns no mundo, tem implicações de longo prazo que ainda são motivo de debate. A remoção do apêndice pode afetar o microbioma intestinal e a resposta imune do paciente, aumentando o risco de doenças como a síndrome do intestino irritável (SII), diabetes tipo 2, e até mesmo doenças autoimunes, como o lúpus eritematoso sistêmico. Estudos epidemiológicos demonstraram que indivíduos que passaram por apendicectomia possuem maior risco de desenvolver SII, uma condição associada a um desequilíbrio no microbioma intestinal, particularmente com a diminuição de bactérias benéficas como Butyricicoccus.
Além disso, a remoção do apêndice tem sido associada a um risco elevado de câncer colorretal, embora os dados ainda sejam inconclusivos. Em algumas populações, a apendicectomia foi relacionada a uma redução no número de células imunes, como as células T CD3+ e CD8+, que são fundamentais na detecção e eliminação de células tumorais. Essa diminuição da vigilância imunológica pode permitir que células malignas escapem da detecção.
Aspectos Cirúrgicos: Abordagem no Tratamento de Apendicite
A apendicectomia continua sendo a principal abordagem no tratamento da apendicite, especialmente em casos agudos com risco iminente de ruptura e peritonite. No entanto, a crescente evidência sobre os benefícios do apêndice para a saúde gastrointestinal tem levado à consideração de abordagens alternativas, como o uso de antibióticos para tratar a apendicite não complicada. Um estudo publicado no New England Journal of Medicine em 2020 mostrou que o tratamento com antibióticos pode ser tão eficaz quanto a cirurgia em alguns casos de apendicite, o que levanta a questão de que a remoção do apêndice nem sempre é necessária. Além disso, os cirurgiões devem estar cientes das implicações de longo prazo da apendicectomia. Pacientes que passaram por essa cirurgia podem precisar de monitoramento adicional para doenças intestinais, como a síndrome do intestino irritável e o câncer colorretal. A atenção ao microbioma intestinal e à saúde imunológica desses pacientes é fundamental.
Pontos-chave
- O apêndice não é um órgão vestigial, mas desempenha funções importantes, como proteção imunológica e preservação do microbioma intestinal.
- A apendicectomia pode ter efeitos a longo prazo, incluindo aumento do risco de doenças como síndrome do intestino irritável, diabetes tipo 2 e câncer colorretal.
- Estudos sugerem que o apêndice serve como “refúgio” para bactérias benéficas, ajudando na recuperação do microbioma após infecções intestinais.
- A remoção do apêndice pode afetar a resposta imune, diminuindo a vigilância contra patógenos e células tumorais.
- O tratamento da apendicite com antibióticos pode ser uma alternativa viável em alguns casos, evitando a remoção do apêndice.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A apendicectomia permanece uma intervenção essencial em casos de apendicite aguda, porém, com as evidências crescentes sobre as funções do apêndice, os cirurgiões devem considerar alternativas terapêuticas, como o uso de antibióticos, em casos de apendicite não complicada. Além disso, é fundamental que os cirurgiões considerem as implicações de longo prazo da remoção do apêndice, monitorando os pacientes para doenças intestinais, autoimunes e até mesmo câncer colorretal. O estudo aprofundado dos aspectos morfofuncionais do apêndice é crucial para otimizar a prática clínica e garantir um tratamento adequado e individualizado para os pacientes.
Estudo Anatômico do Apêndice Vermiforme
O apêndice vermiforme é uma estrutura anatômica localizada no intestino grosso, mais especificamente na junção do ceco. Embora seja considerado historicamente um órgão vestigial em termos de evolução, o apêndice desempenha funções relacionadas ao sistema imunológico e à preservação do microbioma intestinal. A seguir, descreveremos suas principais características anatômicas: tamanho, localização, vascularização, inervação, anatomia de superfície e relações anatômicas.
1. Tamanho e Forma
O apêndice vermiforme é um órgão tubular de tamanho variável, com comprimento que pode variar entre 5 e 25 cm, sendo que a média é de aproximadamente 10 cm. Sua forma é geralmente cilíndrica, embora possa apresentar variações em sua espessura e curvatura. Em algumas pessoas, o apêndice pode ser mais longo ou mais curto, e pode ter uma configuração mais espiralada, dependendo das características individuais.
2. Localização
O apêndice vermiforme está localizado na região inferior direita do abdômen, na junção entre o ceco e o cólon ascendente. Sua posição exata pode variar entre os indivíduos, mas, em geral, encontra-se na fossa ilíaca direita. A localização do apêndice pode ser classificada em quatro tipos principais, de acordo com a posição anatômica em relação ao ceco:
- Retrocecal: A posição mais comum, em que o apêndice fica atrás do ceco.
- Pélvico: Quando o apêndice se estende para a pelve.
- Subcecal: Abaixo do ceco.
- Mesocólica: Quando o apêndice está posicionado em direção à parede posterior do abdômen.
Em alguns casos raros, o apêndice pode se estender para o lado esquerdo do abdômen (apêndice esquerdo), o que é conhecido como situs inversus.
3. Vascularização
A vascularização do apêndice é fornecida pela artéria apendicular, um ramo da artéria ileocolica, que por sua vez é um ramo da artéria mesentérica superior. A artéria apendicular penetra no apêndice através de sua base, fornecendo sangue para a parede do órgão.
- Veias: As veias que drenam o apêndice seguem o trajeto das artérias e se unem para formar a veia ileocolica, que, por sua vez, drena na veia mesentérica superior, e esta se conecta com a veia porta.
A vascularização do apêndice é vital para a sua função e pode ser um fator importante em condições patológicas, como a apendicite, onde a obstrução da artéria apendicular pode levar a isquemia e necrose do tecido.
4. Inervação
A inervação do apêndice provém do plexo mesentérico superior, que é derivado da divisão autonômica do sistema nervoso. A inervação sensitiva e motora é mediada pelos nervos que seguem o trajeto da artéria apendicular.
- Nervos simpáticos: A inervação simpática do apêndice provém dos nervos esplâncnicos, que transportam fibras que contribuem para a motilidade e secreção do apêndice.
- Nervos parassimpáticos: As fibras parassimpáticas são originadas dos nervos vago e sacrais, sendo responsáveis pela regulação da motilidade intestinal.
A dor associada à apendicite, por exemplo, pode se originar da inervação visceral do apêndice, que pode ser sentida inicialmente na região periumbilical e depois se localizar no quadrante inferior direito do abdômen, à medida que a inflamação se torna mais pronunciada.
5. Anatomia de Superfície
Na anatomia de superfície, o apêndice vermiforme pode ser localizado por meio de alguns pontos anatômicos de referência no abdômen. A maneira mais comum de localizar o apêndice é pelo ponto de McBurney, que é o ponto médio entre a espinha ilíaca ântero-superior direita (EIAS) e o umbigo. Esse ponto geralmente corresponde à projeção da base do apêndice. O ponto de McBurney é utilizado como um guia durante a avaliação clínica de pacientes com suspeita de apendicite. Além disso, o apêndice pode ser visualizado durante exames de imagem, como a tomografia computadorizada (TC) e a ultrassonografia abdominal, que são métodos importantes para confirmar diagnósticos de apendicite e outras condições associadas.
6. Relações Anatômicas
O apêndice vermiforme apresenta várias relações anatômicas importantes, que podem influenciar a manifestação clínica de doenças associadas a ele, como a apendicite. As principais relações são:
- Ceco: O apêndice é uma extensão do ceco, a primeira porção do cólon. Ele se localiza na junção entre o ceco e o cólon ascendente.
- Íleo: O apêndice está localizado logo acima da válvula ileocecal, que separa o íleo do ceco.
- Paredes do Abdômen: O apêndice pode estar em contato com a parede posterior do abdômen, as alças intestinais, o cólon ascendente, a vesícula biliar (em algumas variações anatômicas) e até mesmo o fígado, dependendo da sua posição.
- Vasos Sanguíneos: A artéria apendicular e suas veias acompanham as estruturas mesentéricas do intestino grosso e se localizam nas camadas do mesoapêndice, uma dobra do mesentério que sustenta o apêndice.
Em casos de apendicite, essas relações anatômicas podem influenciar o padrão de dor e a evolução da doença. A dor inicial pode ser difusa devido à inervação visceral, mas conforme a inflamação se intensifica, a dor torna-se localizada no quadrante inferior direito, devido à peritonite parietal.
Considerações Finais
A anatomia do apêndice vermiforme é complexa e varia entre os indivíduos. Compreender a localização, vascularização, inervação e as relações anatômicas do apêndice é fundamental para a prática clínica, especialmente no contexto da apendicite e das decisões cirúrgicas, portanto como afirmou o renomado médico William Osler: “A medicina é uma arte, não uma ciência exata”. A compreensão contínua das funções do apêndice e a evolução das abordagens terapêuticas refletem a natureza dinâmica da prática médica, onde novas evidências moldam as decisões clínicas e cirúrgicas. O apêndice, longe de ser um órgão sem importância, revela-se cada vez mais como uma estrutura vital para a saúde intestinal e imunológica.
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#apendicectomia #saúdeintestinal #cirurgiadigestiva #microbiomaintestinal #medicinacontinuada
Fundamentos do Transplante Hepático
O transplante hepático é uma das intervenções mais complexas e, ao mesmo tempo, revolucionárias no tratamento de doenças hepáticas terminais. Este procedimento, que substitui o fígado doente por um fígado saudável, é crucial para muitos pacientes que sofrem de doenças hepáticas graves e progressivas, além de algumas condições metabólicas e neoplásicas. Para os estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, compreender os fundamentos do transplante hepático é essencial para atuar na linha de frente do tratamento avançado de doenças hepáticas. Neste artigo, abordaremos as principais indicações, critérios de seleção, técnicas cirúrgicas, imunologia, complicações, prognóstico e perspectivas futuras do transplante hepático.
Introdução
O transplante hepático tornou-se a única opção viável para pacientes com falência hepática irreversível, proporcionando uma sobrevida significativamente prolongada e melhor qualidade de vida. Desde a sua primeira realização em humanos, ele se consolidou como o tratamento padrão para diversas doenças hepáticas. No entanto, as limitações relacionadas à disponibilidade de doadores e as complexidades inerentes ao procedimento tornam-no um desafio tanto para médicos quanto para a sociedade.
Evolução Histórica
A história do transplante hepático iniciou-se nos anos 1960, quando o Dr. Thomas Starzl realizou o primeiro transplante bem-sucedido de fígado. Desde então, avanços significativos na imunossupressão e na técnica cirúrgica melhoraram dramaticamente os resultados. O desenvolvimento de drogas imunossupressoras, como a ciclosporina, foi crucial para reduzir a rejeição e aumentar a sobrevida dos pacientes. Hoje, o transplante hepático é realizado globalmente com taxas de sucesso que eram inimagináveis no início da prática.
Indicações de Transplante Hepático
O transplante de fígado é indicado principalmente para pacientes com falência hepática crônica ou aguda que apresentam risco de morte em curto prazo. As principais indicações incluem:
- Cirrose hepática avançada, incluindo cirrose hepática por hepatite viral crônica, cirrose biliar primária e doença hepática alcoólica;
- Hepatocarcinoma em fase inicial, que pode ter cura através do transplante em pacientes selecionados;
- Doenças metabólicas hereditárias, como a doença de Wilson e deficiência de alfa-1 antitripsina;
- Insuficiência hepática aguda, geralmente causada por hepatite fulminante.
Critérios de Seleção dos Receptores
A seleção de candidatos é orientada principalmente pelo MELD (Model for End-Stage Liver Disease) para adultos e o PELD (Pediatric End-Stage Liver Disease) para crianças, ambos sistemas de pontuação que avaliam a gravidade da doença hepática. Pacientes com MELD ≥ 15 geralmente são considerados elegíveis, enquanto aqueles com hepatocarcinoma devem atender aos critérios de Milão para serem listados. Além dos critérios médicos, os candidatos são avaliados em relação ao apoio familiar, aderência ao tratamento e estabilidade psicológica, pois esses fatores influenciam significativamente o sucesso pós-transplante.
Critérios de Seleção dos Doadores
Os doadores de fígado podem ser falecidos ou vivos. Os critérios para doadores falecidos incluem idade adequada, ausência de doença hepática e compatibilidade sanguínea com o receptor. Nos doadores vivos, além desses critérios, a saúde física e mental do doador é minuciosamente avaliada. A utilização de doadores vivos tornou-se comum em alguns países, sendo especialmente importante em regiões com baixa disponibilidade de doadores falecidos.
Contraindicações Relativas e Absolutas
Certas condições médicas são consideradas contraindicativas para o transplante hepático. Contraindicações absolutas incluem:
- Neoplasias extra-hepáticas não controladas;
- Insuficiência cardíaca ou pulmonar grave;
- Uso ativo de substâncias ilícitas. As contraindicações relativas, por outro lado, são avaliadas caso a caso, incluindo infecções controladas pelo HIV, cânceres tratados e comorbidades cardiovasculares que podem ser manejadas clinicamente.
Tipos de Transplante Hepático e Fundamentos Técnicos
Os transplantes hepáticos podem ser classificados como transplante de fígado total, reduzido, split-liver (dividido entre dois receptores), ou de doadores vivos. Nos transplantes de doadores vivos, segmentos específicos do fígado, geralmente o lobo esquerdo para crianças e o lobo direito para adultos, são removidos do doador e transplantados para o receptor. Cada tipo requer preparo técnico especializado e apresenta desafios próprios, especialmente em relação à preservação do fluxo sanguíneo e à minimização de complicações vasculares.
Principais Complicações
As complicações podem ocorrer tanto no pós-operatório imediato quanto no longo prazo. As principais incluem:
- Rejeição aguda e crônica do enxerto;
- Complicações vasculares, como trombose da artéria hepática e obstrução da veia porta;
- Complicações biliares, incluindo estenoses e fístulas;
- Infecções devido à imunossupressão prolongada.
Imunologia dos Transplantes: Tipos de Rejeição e Imunossupressão
A rejeição é um dos maiores desafios no transplante hepático e pode ser classificada em rejeição celular aguda, geralmente controlada por imunossupressão, e rejeição crônica, que leva à perda do enxerto. Os principais medicamentos imunossupressores incluem ciclosporina, tacrolimus e micofenolato de mofetila. A terapia é cuidadosamente ajustada para minimizar a rejeição e evitar efeitos adversos, como infecções oportunistas e cânceres secundários.
Prognóstico do Transplante: Sobrevida Global e do Enxerto
A sobrevida após o transplante hepático continua a melhorar, com taxas de 1 ano superiores a 90% e sobrevida média de 20 anos para pacientes transplantados na década de 1990. O prognóstico depende de múltiplos fatores, incluindo a gravidade da doença original, a idade do receptor e as complicações pós-operatórias. O acompanhamento vitalício é necessário para monitorar a função do enxerto e ajustar a imunossupressão.
Perspectivas Futuras
As inovações no transplante hepático incluem avanços na perfusão de órgãos, que permite avaliar e condicionar o fígado doado antes do transplante, e o potencial uso de xenotransplantes e engenharia de tecidos. Esses avanços visam aumentar a disponibilidade de órgãos e melhorar a longevidade dos enxertos. O desenvolvimento de técnicas para induzir tolerância imunológica também promete reduzir a necessidade de imunossupressão a longo prazo, melhorando a qualidade de vida dos transplantados.
Conclusão
O transplante hepático é um procedimento altamente complexo, mas fundamental para pacientes com doenças hepáticas terminais. Para estudantes e residentes, entender os critérios de seleção, o manejo das complicações e os fundamentos técnicos é essencial para a prática em gastroenterologia e cirurgia hepática. À medida que a medicina avança, a capacidade de tratar pacientes com insuficiência hepática melhora continuamente, levando a novos horizontes na área de transplantes.
“Liver transplantation provides an opportunity for these patients to reclaim a healthy life, free from the shadow of chronic liver disease.” – Thomas Starzl
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#TransplanteHepático #Medicina #CirurgiaDigestiva #SaúdeHepática #Imunossupressão
Como Eu Trato Colelitíase e Suas Complicações
Um Guia Prático para Estudantes de Medicina e Residentes de Cirurgia
A colelitíase, ou a formação de cálculos biliares na vesícula, é uma condição amplamente prevalente, especialmente no contexto do aumento da síndrome metabólica e do envelhecimento populacional. Cerca de 10% a 20% da população adulta pode desenvolver cálculos biliares, embora apenas 20% dessa população apresente sintomas ou complicações. Com mais de 1,2 milhões de colecistectomias realizadas anualmente nos Estados Unidos, a cirurgia continua sendo o tratamento padrão para colelitíase sintomática, com complicações potencialmente graves como a colecistite aguda, colangite e pancreatite biliar. No Brasil, estudos epidemiológicos indicam que a colelitíase afeta cerca de 15% da população adulta.
Introdução
A colelitíase se refere à formação de cálculos biliares no trato biliar, com maior prevalência na vesícula biliar. Esta condição pode ser assintomática ou associada a dor abdominal, chamada cólica biliar. A maioria dos pacientes permanece assintomática, mas, em alguns casos, podem surgir complicações graves, como colecistite aguda, colangite ou pancreatite. A escolha do tratamento depende da presença ou ausência de sintomas e complicações.
Diagnóstico e Classificação
O diagnóstico de colelitíase frequentemente é feito incidentalmente por ultrassonografia abdominal. Para pacientes com sintomas, a ultrassonografia tem uma acurácia de cerca de 95% na detecção de cálculos. Além disso, em casos mais complicados, exames como a colangiopancreatografia por ressonância magnética (CPRM) e a colangiopancreatografia retrógrada endoscópica (CPRE) podem ser usados para detectar cálculos no ducto biliar comum.
A classificação das complicações da colelitíase inclui:
- Colecistite aguda: Inflamação da vesícula biliar, geralmente causada por obstrução do ducto cístico por cálculos.
- Colangite: Infecção bacteriana da via biliar, associada à obstrução biliar.
- Pancreatite biliar: Inflamação do pâncreas causada por cálculos impactados no ducto biliar.
- Coledocolitíase: Presença de cálculos no ducto biliar comum.
Aplicação na prática da Cirurgia Digestiva
O manejo cirúrgico da colelitíase varia de acordo com a apresentação clínica do paciente. Para pacientes assintomáticos, a colecistectomia profilática não é indicada, exceto em casos de risco elevado, como na presença de vesícula em porcelana (associada ao câncer de vesícula biliar).
- Colelitíase sintomática: A abordagem cirúrgica padrão é a colecistectomia laparoscópica, preferencialmente realizada nas primeiras 72 horas após o início dos sintomas em casos de colecistite aguda. A colecistectomia tem uma taxa de mortalidade inferior a 1%, sendo extremamente eficaz na resolução dos sintomas.
- Coledocolitíase: Pacientes com coledocolitíase podem requerer uma abordagem multimodal, combinando a CPRE para remoção de cálculos no ducto biliar e colecistectomia subsequente. A laparoscopia também pode ser utilizada para explorar o ducto biliar comum, permitindo a retirada dos cálculos.
- Pancreatite biliar: A pancreatite causada por cálculos biliares requer estabilização inicial do paciente, com reposição volêmica e analgesia. A colecistectomia deve ser realizada na mesma internação para prevenir recorrências, exceto em casos de pancreatite grave com necrose pancreática, onde o cirurgião deve aguardar até a resolução do quadro inflamatório.
- Tratamento de emergência: Casos de colangite e pancreatite biliar requerem intervenção imediata, com drenagem biliar emergente via CPRE ou drenagem percutânea seguida de colecistectomia, dependendo do estado clínico do paciente.
Em casos mais raros, como a síndrome de Mirizzi ou o íleo biliar, intervenções complexas são necessárias. A síndrome de Mirizzi, caracterizada pela obstrução do ducto biliar comum por compressão extrínseca de um cálculo, pode requerer remoção cirúrgica e, às vezes, reconstrução da via biliar.
Pontos-Chave
- A ultrassonografia abdominal é o exame inicial mais adequado para o diagnóstico de colelitíase.
- A colecistectomia laparoscópica continua sendo o tratamento padrão para colelitíase sintomática e colecistite aguda.
- Pacientes com coledocolitíase e pancreatite biliar requerem uma abordagem multimodal, incluindo CPRE e colecistectomia.
- A colangite aguda é uma emergência médica e deve ser tratada com descompressão biliar urgente.
- No Brasil, estima-se que cerca de 15% dos adultos tenham colelitíase, com uma incidência crescente devido a fatores de risco como obesidade e diabetes.
Conclusão
O tratamento cirúrgico da colelitíase e suas complicações é bem estabelecido, com a colecistectomia laparoscópica sendo o padrão de tratamento para a maioria dos pacientes sintomáticos. Entretanto, é importante que os profissionais de saúde identifiquem as complicações precocemente e adaptem o tratamento à condição clínica do paciente. O uso da CPRE e da colecistectomia precoce reduzem significativamente as taxas de complicações graves, como pancreatite e colangite. Além disso, o manejo adequado da dor e o reconhecimento rápido das emergências, como a colangite, são essenciais para melhorar os desfechos clínicos.
Como o Dr. Steven Strasberg observou:
“A decisão cirúrgica em pacientes com doença do trato biliar deve ser orientada não apenas pelos achados de imagem, mas pela fisiopatologia subjacente e pelo quadro clínico individualizado.”
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
CirurgiaDigestiva #Colelitíase #TratamentoCirúrgico #PancreatiteBiliar #EducaçãoMédicaContinuada
Aprendizado pelo Contraste
Ressignificando os Eventos Adversos na Cirurgia Digestiva
Introdução
No campo da medicina, especialmente na cirurgia digestiva, lidar com eventos adversos é uma parte inevitável da prática clínica. Dado o grau de complexidade dos procedimentos e a vulnerabilidade dos órgãos envolvidos, complicações como fístulas, hemorragias ou infecções podem ocorrer, desafiando a habilidade do cirurgião. Embora esses momentos tragam desconforto e pressão, também oferecem oportunidades valiosas de aprendizado. Ressignificar os eventos adversos é uma abordagem que transforma desafios em crescimento técnico e emocional, resultando em uma prática mais segura e eficaz. Este artigo, voltado para estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia digestiva, explora o conceito de aprendizado pelo contraste e a importância de ressignificar as adversidades cirúrgicas. Discutiremos como essa mentalidade pode ser aplicada na prática, visando a melhoria contínua e a prevenção de complicações futuras.
Desenvolvimento
Eventos adversos, como complicações intraoperatórias ou pós-operatórias, são uma realidade que o cirurgião deve aprender a enfrentar. No Brasil, estima-se que cerca de 7% das internações hospitalares resultem em algum tipo de evento adverso. Na área cirúrgica, especialmente no aparelho digestivo, complicações como fístulas anastomóticas, infecções intra-abdominais e perfurações têm incidência significativa. Tais eventos, no entanto, não devem ser vistos exclusivamente como fracassos, mas como catalisadores para o aprimoramento técnico.
A ressignificação desses eventos é baseada no conceito de reframe (mudar a perspectiva). Adler, em seus estudos sobre psicologia individual, destacou que as dificuldades podem se transformar em oportunidades de desenvolvimento. Para o cirurgião digestivo, esse aprendizado pelo contraste, ou seja, aprender com os erros ou complicações, é essencial para aperfeiçoar suas habilidades técnicas e fortalecer a confiança no atendimento ao paciente.
Aplicação na Cirurgia Digestiva
Em procedimentos de alta complexidade, como ressecções intestinais, gastrectomias ou cirurgias hepáticas, os eventos adversos, apesar de serem inevitáveis em alguns casos, podem ser fontes de aprendizado profundo. A seguir, apresentamos cinco dicas práticas para ressignificar e aprender com esses eventos, transformando-os em oportunidades de aprimoramento:
- Analisar detalhadamente o evento adverso: Logo após a ocorrência de uma complicação, é fundamental revisitar o caso por completo. Analise cada etapa do procedimento, desde o pré-operatório até o intraoperatório. Identificar fatores como condições do paciente, técnica cirúrgica empregada e possíveis fatores de risco não previstos pode fornecer insights preciosos. Por exemplo, em uma cirurgia com fístula anastomótica (complicação que ocorre entre 2% e 12% dos casos de anastomose intestinal), revisar a técnica de sutura e as condições do paciente pode evitar futuras ocorrências.
- Debriefing com a equipe cirúrgica: O aprendizado não deve ser individual. Discuta abertamente o evento adverso com a equipe. Essa prática colaborativa permite que todos os membros aprendam com a experiência, reforçando práticas seguras e permitindo o ajuste de protocolos internos. Estudos mostram que equipes que realizam debriefings após complicações melhoram significativamente a coesão e a prevenção de novos erros.
- Aplicação de protocolos e checklists: Reforçar o uso de protocolos estabelecidos, como o ERAS (Enhanced Recovery After Surgery), tem se mostrado eficaz na redução de complicações cirúrgicas. Ao ressignificar um evento adverso, o cirurgião pode revisar quais protocolos foram seguidos e quais etapas foram negligenciadas. A introdução de checklists específicos para cada tipo de procedimento cirúrgico também pode ser uma ferramenta poderosa de prevenção.
- Investir em simulações e treinamentos específicos: Após um evento adverso, a prática deliberada em simulações cirúrgicas pode ajudar a melhorar as habilidades técnicas. Participar de treinamentos simulados, como em cursos de laparoscopia avançada, oferece a oportunidade de refinar técnicas em um ambiente seguro, aumentando a confiança e reduzindo a probabilidade de complicações futuras em cenários reais.
- Monitorar o impacto emocional: Além das questões técnicas, o impacto emocional de uma complicação deve ser considerado. Estudos brasileiros indicam que o burnout entre cirurgiões pode ser exacerbado por complicações cirúrgicas. Para prevenir a exaustão emocional, é essencial que o cirurgião reconheça a importância da saúde mental. Práticas como meditação, terapia e suporte emocional entre colegas podem ajudar a lidar com a pressão associada a eventos adversos.
Pontos-chave
- Revisão crítica e colaborativa: A análise sistemática e a troca aberta de informações sobre o evento adverso são fundamentais para garantir que os mesmos erros não se repitam.
- Prevenção com protocolos: O uso consistente de protocolos e checklists aumenta significativamente a segurança dos pacientes.
- Educação contínua: A participação em treinamentos e simulações reforça a habilidade técnica e a confiança, especialmente após um evento adverso.
- Saúde mental do cirurgião: É fundamental gerenciar o estresse e o impacto emocional das complicações, garantindo que o cirurgião mantenha o equilíbrio mental ao longo da carreira.
Conclusão
A ressignificação dos eventos adversos na prática cirúrgica não é apenas uma ferramenta de aprendizagem, mas uma atitude essencial para o crescimento contínuo. O sucesso de um cirurgião digestivo depende não apenas de sua habilidade técnica, mas de sua capacidade de aprender com os desafios, adaptando-se a cada nova experiência. Ao transformar dificuldades em oportunidades de melhoria, o cirurgião evolui não só em sua prática, mas também em sua resiliência emocional. Como afirmou Alfred Adler: “A maior força não vem de evitar os fracassos, mas de aprender com eles e seguir em frente“. Ressignificar eventos adversos é parte integrante do caminho de evolução para um cirurgião mais completo e resiliente.
Gostou❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags
#cirurgiadigestiva #eventosadversos #ressignificação #aprendizadocirurgico #educacaomedica
Cicatrização de Feridas
A cicatrização de feridas operatórias é um processo fundamental para o sucesso de qualquer intervenção cirúrgica, especialmente nas complexas cirurgias do aparelho digestivo. Este post visa explorar detalhadamente o processo de cicatrização, destacando os mecanismos biológicos envolvidos e sua aplicação prática na cirurgia digestiva, com enfoque em fornecer uma visão compreensiva para estudantes de medicina, residentes em cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo.
A Complexidade da Cicatrização em Cirurgias Digestivas
A cicatrização de uma ferida operatória é um fenômeno biológico essencial que visa restaurar a integridade tecidual após uma intervenção cirúrgica. Em cirurgias do aparelho digestivo, onde o risco de complicações infecciosas é elevado, entender as fases e os fatores que influenciam a cicatrização é crucial para otimizar os resultados e prevenir complicações como deiscências, infecções e formação de fístulas.
Fisiologia e Fases da Cicatrização Operatória
Hemostasia e Fase Inflamatória
Imediatamente após o trauma cirúrgico, ocorre a fase de hemostasia, na qual a vasoconstrição e a ativação da cascata de coagulação interrompem o sangramento. Esse processo não só previne a hemorragia como também forma uma matriz de fibrina, que serve como um arcabouço inicial para a cicatrização. A fase inflamatória segue imediatamente, durando entre 1 a 4 dias. Durante esse período, células inflamatórias como neutrófilos e macrófagos migram para o local da ferida, desempenhando um papel vital na fagocitose de detritos celulares e na liberação de citocinas que promovem a reparação tecidual.
Fase Proliferativa e Angiogênese
A fase proliferativa, que inicia após o terceiro ou quarto dia, envolve a migração e proliferação de fibroblastos, células mesenquimais e a formação de novos vasos sanguíneos—a angiogênese. Esses processos são críticos para a formação do tecido de granulação, que preenche a ferida e estabelece uma nova matriz extracelular rica em colágeno.
Remodelamento e Maturação
Finalmente, a fase de remodelamento, que pode se estender por meses, é caracterizada pela deposição de colágeno e reorganização da matriz extracelular. Nesta fase, o tecido cicatricial se fortalece, atingindo cerca de 80% da resistência do tecido original após seis meses.
Aplicação na Cirurgia Digestiva: Desafios e Abordagens
Na cirurgia do aparelho digestivo, as feridas operatórias apresentam desafios específicos devido ao alto risco de contaminação e infecção, especialmente em anastomoses intestinais. Segundo estatísticas do Ministério da Saúde, as infecções de sítio cirúrgico (ISC) estão entre as principais complicações pós-operatórias no Brasil, com uma incidência de aproximadamente 11,7% em cirurgias abdominais.
Fechamento Primário e Secundário: Escolhas Estratégicas
O fechamento primário, onde as margens da ferida são aproximadas diretamente, é ideal em cirurgias limpas, com baixo risco de infecção. No entanto, em situações onde há contaminação, como em ressecções intestinais com peritonite, o fechamento secundário, onde a ferida é deixada aberta para cicatrizar por segunda intenção, pode ser mais seguro.
Uso de Tecnologias Avançadas
O uso de produtos como hidrocolóides, hidrofibras e até mesmo fatores de crescimento recombinantes tem sido explorado para melhorar a cicatrização de feridas complexas em cirurgias digestivas. Estudos recentes indicam que esses tratamentos podem acelerar a formação de tecido de granulação e reduzir a taxa de complicações infecciosas, especialmente em pacientes com comorbidades como diabetes.
Pontos-Chave
- A cicatrização de feridas operatórias segue um processo ordenado de hemostasia, inflamação, proliferação e remodelamento.
- Nas cirurgias digestivas, o manejo adequado da cicatrização é crucial para prevenir complicações como infecções e deiscências.
- O fechamento primário é preferível em condições limpas, enquanto o fechamento secundário é recomendado em casos de alta contaminação.
- Avanços tecnológicos, como o uso de fatores de crescimento e novos materiais de curativos, oferecem promissoras abordagens para melhorar a cicatrização de feridas em cirurgias digestivas.
Aplicações na Prática Cirúrgica
A compreensão detalhada dos processos de cicatrização e a aplicação adequada das técnicas de fechamento e tratamento de feridas são essenciais para o sucesso em cirurgias do aparelho digestivo. Cirurgiões devem estar atentos às novas tecnologias e abordagens para otimizar os resultados pós-operatórios e reduzir as taxas de complicações, garantindo, assim, uma recuperação mais rápida e eficaz para seus pacientes.
Como bem disse o cirurgião pioneiro Joseph Lister: “A cicatrização das feridas é o teste do cirurgião.” A excelência no cuidado pós-operatório é tão vital quanto a habilidade na sala de cirurgia.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CicatrizaçãoCirúrgica #CirurgiaDigestiva #CuidadosPósOperatórios #CicatrizaçãoDeFeridas #MedicinaCirúrgica
Formação Acadêmica na Cirurgia do Aparelho Digestivo
“Não somente Cirurgiões…”
A formação acadêmica na cirurgia do aparelho digestivo é um tema de grande relevância para estudantes de medicina e residentes em cirurgia geral. Neste contexto, a importância do Mestrado e Doutorado profissionais se destaca como um pilar fundamental para o desenvolvimento de habilidades e competências necessárias para a prática cirúrgica de excelência. Este artigo busca explorar a formação acadêmica na cirurgia digestiva, abordando a importância da pesquisa, a aplicação prática dos conhecimentos adquiridos e as conclusões que podem ser aplicadas na prática clínica.
Introdução
A cirurgia do aparelho digestivo é uma especialidade que exige não apenas habilidades técnicas, mas também um profundo entendimento dos avanços científicos e tecnológicos. A formação acadêmica, especialmente por meio de programas de Mestrado e Doutorado profissionais, é essencial para preparar cirurgiões que possam enfrentar os desafios contemporâneos da medicina. Segundo dados da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), o Brasil tem visto um aumento significativo no número de programas de pós-graduação na área da saúde, refletindo a crescente demanda por profissionais qualificados.
Desenvolvimento
Mestrado e Doutorado Profissionais
Os programas de Mestrado e Doutorado profissionais foram criados para atender a uma demanda crescente por profissionais que possam aplicar o conhecimento científico em contextos práticos. O Mestrado profissional, regulamentado pela Lei n. 9.394 de 1996 e com diretrizes estabelecidas em 2009, visa a formação de profissionais com uma abordagem focada na aplicação prática do conhecimento. Este tipo de formação é particularmente relevante para cirurgiões, que frequentemente se deparam com desafios que exigem soluções inovadoras e práticas. O Doutorado profissional, por sua vez, tem ganhado espaço nas últimas décadas, refletindo uma tendência global. Em muitos países, essa modalidade já é uma realidade consolidada, com instituições de ensino superior oferecendo programas que integram pesquisa e prática. No Brasil, a criação de programas de Doutorado profissional é uma resposta à necessidade de aprofundar a formação de cirurgiões, permitindo que eles se tornem líderes em suas áreas de atuação.
Pesquisa Científica
A pesquisa é um componente crucial na formação do cirurgião, pois permite o desenvolvimento do raciocínio crítico e a atualização constante dos conhecimentos. Estudantes e residentes que se envolvem em projetos de pesquisa têm a oportunidade de aplicar o método científico à prática clínica, contribuindo para a melhoria dos cuidados de saúde. A produção científica brasileira na área da saúde tem avançado, mas ainda existem desafios a serem superados, como a aplicação prática dos novos conhecimentos em problemas relevantes da população. Estudos mostram que a pesquisa não apenas aprimora as habilidades técnicas dos cirurgiões, mas também os capacita a identificar e resolver problemas complexos no ambiente clínico. A incorporação de metodologias de pesquisa, como análise crítica e design thinking, pode levar a melhorias significativas na eficiência dos serviços de saúde.
Publicações
A publicação dos resultados de pesquisa é um aspecto crucial para o avanço da ciência e da medicina. Publicar em periódicos de alto impacto é uma forma de disseminar o conhecimento e contribuir para o progresso da área. O processo de revisão por pares garante a qualidade e a integridade dos estudos publicados, permitindo que os cirurgiões compartilhem suas descobertas com a comunidade científica. Além disso, a publicação de artigos científicos é uma maneira de os cirurgiões se estabelecerem como especialistas em suas áreas. A produção de conhecimento não se limita a artigos, mas pode incluir patentes, projetos técnicos e inovações que impactem diretamente a prática clínica. A diversidade de formatos para a apresentação de resultados de pesquisa é um reflexo da necessidade de adaptação às demandas do mercado e da sociedade.
Aplicação na Cirurgia Digestiva
Os conhecimentos adquiridos durante a formação acadêmica são diretamente aplicáveis na prática da cirurgia digestiva. O Mestrado e Doutorado profissionais capacitam os cirurgiões a desenvolver novas técnicas e processos, além de promover a inovação no atendimento ao paciente. A formação não se limita à teoria, mas inclui a aplicação prática em ambientes clínicos, onde os cirurgiões podem identificar e solucionar problemas reais. Por exemplo, a utilização de metodologias como design thinking e análise crítica de processos pode levar a melhorias significativas na eficiência dos serviços de saúde.
Pontos-chave
- Integração entre teoria e prática: A formação acadêmica deve equilibrar o conhecimento teórico com a experiência prática, permitindo que os cirurgiões se tornem profissionais completos.
- Desenvolvimento contínuo: A educação médica não termina com a graduação; a participação em programas de pós-graduação é vital para a atualização e o aprimoramento das habilidades.
- Contribuição para a saúde pública: Cirurgiões bem formados têm o potencial de impactar positivamente a saúde da população, desenvolvendo soluções inovadoras para problemas de saúde.
- Importância da pesquisa e publicação: A pesquisa e a publicação científica são fundamentais para o avanço da medicina e a melhoria da prática cirúrgica.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A formação acadêmica na cirurgia do aparelho digestivo, através de Mestrados e Doutorados profissionais, é essencial para o desenvolvimento de cirurgiões competentes e inovadores. A pesquisa e a aplicação prática dos conhecimentos adquiridos são fundamentais para enfrentar os desafios da medicina moderna. Com uma formação sólida, os cirurgiões não apenas melhoram suas habilidades técnicas, mas também se tornam agentes de mudança no sistema de saúde, contribuindo para a melhoria da qualidade de vida dos pacientes. A frase de J. Robert Oppenheimer, um dos grandes nomes da ciência, resume bem essa busca por excelência.
“A ciência não é apenas uma disciplina, mas uma forma de pensar, uma maneira de questionar o mundo ao nosso redor.”
ACESSE AQUI NOSSAS PUBLICAÇÕES
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.#FormaçãoCirurgiã #CirurgiaDigestiva #EducaçãoMédica #MestradoProfissional #InovaçãoEmSaúde
Falência Hepática Terminal: Aspectos Clínicos e Implicações Cirúrgicas
Introdução
A falência hepática terminal é uma síndrome clínica grave, comumente associada a doenças hepáticas crônicas, particularmente a cirrose. Ela abrange tanto formas agudas, como a hepatite fulminante, quanto a falência hepática aguda sobre crônica, levando a altas taxas de mortalidade. Essa condição se apresenta com uma constelação de sintomas e sinais indicativos de insuficiência hepática, destacando-se pela sua importância epidemiológica devido à sua frequência, impacto na morbidade e mortalidade, e ao consumo substancial de recursos de saúde.
No Brasil, a carga de cirrose causada pelo vírus da hepatite C ocupava a 22ª posição em 1990 em termos de Anos de Vida Perdidos (AVP). Em 2010, subiu para a 15ª posição, enquanto a cirrose induzida pelo álcool subiu da 32ª para a 25ª posição, destacando a crescente prevalência das principais causas de falência hepática crônica. As principais etiologias da cirrose incluem abuso crônico de álcool, infecção pelo vírus da hepatite C e esteato-hepatite não alcoólica (NASH). A falência hepática aguda, por sua vez, é desencadeada principalmente por infecção pelo vírus da hepatite A e hepatite medicamentosa.
Desenvolvimento
A cirrose representa o estágio patológico final de uma variedade de agressões hepáticas crônicas. Histologicamente, é caracterizada por fibrose extensa, acompanhada pela formação de nódulos regenerativos, levando à hipertensão portal e à falência hepática. O fígado é central para diversas funções vitais, incluindo a síntese de proteínas (albumina e fatores de coagulação), produção de glicose durante o jejum (gliconeogênese hepática), síntese de lipídios e lipoproteínas, e a biotransformação de substâncias endógenas (amônia, hormônios esteroides, bilirrubinas) e exógenas (drogas e toxinas).
O diagnóstico clínico da insuficiência hepática baseia-se principalmente na presença de fatores de risco para doença hepática crônica, sintomas gerais e neuropsiquiátricos, e achados de exame físico sugestivos de falência hepática. Ao contrário da insuficiência renal, onde marcadores quantificáveis como ureia e creatinina estão disponíveis, a insuficiência hepática é avaliada por meio de sintomas, achados físicos e marcadores indiretos de disfunção hepática, como hipoalbuminemia e tempo de protrombina prolongado.
Pacientes com cirrose podem se apresentar clinicamente com cirrose compensada ou descompensada. A cirrose compensada é frequentemente diagnosticada incidentalmente ou durante a investigação de sintomas inespecíficos como mal-estar geral, anorexia, perda de peso, fraqueza ou dispepsia. Em contraste, a cirrose descompensada se manifesta com icterícia, ascite, encefalopatia hepática ou hemorragia varicosa.
Aplicação na Cirurgia Digestiva
A falência hepática terminal impõe desafios significativos no manejo cirúrgico de pacientes com doenças digestivas. Os cirurgiões devem avaliar cuidadosamente o grau de disfunção hepática e seu impacto potencial nos resultados cirúrgicos. O transplante hepático continua sendo o tratamento definitivo para pacientes com falência hepática terminal; no entanto, o momento da cirurgia, a otimização pré-operatória e o manejo de complicações como hipertensão portal e coagulopatia são fundamentais. Os cirurgiões devem estar atentos a sinais clínicos como eritema palmar, telangiectasias, ginecomastia e atrofia testicular, que, embora não exclusivos da doença hepática, são altamente sugestivos de cirrose. Asterixis, ou “tremor das asas,” frequentemente indica doença hepática avançada e encefalopatia hepática, servindo como um marcador de mau prognóstico.
Pontos-Chave
- A falência hepática terminal, frequentemente resultante de doença hepática crônica, é uma condição crítica com alta morbidade e mortalidade.
- A cirrose é o resultado patológico comum de diversas agressões crônicas ao fígado, caracterizada por fibrose e nódulos regenerativos.
- O diagnóstico de insuficiência hepática é complexo, baseando-se em sinais clínicos, sintomas e marcadores indiretos da função hepática.
- Na prática cirúrgica, a falência hepática requer avaliação pré-operatória cuidadosa e manejo adequado, especialmente no contexto do transplante hepático.
- Sinais clínicos importantes incluem eritema palmar, telangiectasias, ginecomastia e asterixis, que ajudam no diagnóstico e prognóstico da doença hepática.
Conclusões Aplicadas à Prática Cirúrgica Digestiva
O manejo de pacientes com falência hepática terminal na cirurgia digestiva exige uma abordagem multidisciplinar, equilibrando os riscos e benefícios da intervenção cirúrgica. O transplante hepático, embora ofereça uma cura potencial, requer planejamento meticuloso e consideração de fatores específicos do paciente, como a gravidade da disfunção hepática e a presença de comorbidades. Os cirurgiões devem estar atentos às sutis manifestações clínicas da falência hepática e adaptar sua abordagem para otimizar os resultados dos pacientes.
Como disse Hipócrates: “Curar é uma questão de tempo, mas às vezes também é uma questão de oportunidade.” O mesmo se aplica ao manejo cirúrgico da falência hepática terminal — tempo e oportunidade são fundamentais.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#FalenciaHepatica #Cirrose #CirurgiaDigestiva #InsuficienciaHepatica #EducacaoMedica
Estilos de Mentoria na Cirurgia
Explorando as Diferenças e Aplicações
No campo da cirurgia, a mentoria desempenha um papel crucial no desenvolvimento profissional dos cirurgiões. Entretanto, entender as nuances entre os diferentes estilos e tipos de mentoria é fundamental para maximizar o impacto dessa relação. Kashiwagi descreve uma série de estilos de mentoria que podem ser aplicados de acordo com as necessidades específicas do mentor e do mentee. Este artigo explora esses estilos e discute como eles podem ser aplicados eficazmente na prática cirúrgica.
Introdução
A mentoria não é uma abordagem única. Diferentes estilos de interação entre mentor e mentee podem ser adotados dependendo dos objetivos da mentoria e das características individuais dos envolvidos. É importante diferenciar entre “tipos” e “estilos” de mentoria: enquanto os tipos referem-se ao escopo e à organização do programa de mentoria, os estilos referem-se ao processo real de interação entre mentor e mentee. Vamos nos concentrar nos principais estilos de mentoria descritos por Kashiwagi e suas implicações para a cirurgia.
Estilos de Mentoria
Dyad
O estilo mais tradicional de mentoria, a “Dyad”, envolve uma relação direta entre um mentor e um mentee. Neste modelo, geralmente é o mentee quem seleciona o mentor, permitindo um maior controle sobre o processo de mentoria. Este estilo é comum em ambientes onde há um número suficiente de mentores disponíveis e onde o mentee tem clareza sobre suas necessidades de orientação.
Peer
No estilo “Peer”, a mentoria ocorre entre indivíduos de idades, experiências e níveis hierárquicos semelhantes. Esse modelo é particularmente útil em contextos em que a mentoria hierárquica tradicional não é ideal ou em ambientes onde há uma escassez de mentores seniores eficazes e comprometidos. Na cirurgia, este estilo pode ser valioso para residentes que estão em fases semelhantes de treinamento, permitindo uma troca de experiências e apoio mútuo.
Facilitated Peer
Uma variação do modelo “Peer” é o “Facilitated Peer”, no qual um mentor sênior supervisiona o grupo de mentoria entre pares. Este estilo combina a abordagem colaborativa do peer mentoring com a orientação e supervisão de um mentor mais experiente, criando um equilíbrio entre autonomia e suporte.
Speed
O estilo “Speed” refere-se a uma interação única e breve entre mentor e mentee, geralmente com duração de 10 a 15 minutos, para determinar se uma relação de mentoria seria benéfica para ambas as partes. Esse estilo pode ser útil em conferências ou eventos profissionais, onde há oportunidade de realizar várias dessas interações rápidas, permitindo ao mentee explorar múltiplas possibilidades de mentoria.
Functional
No estilo “Functional”, o mentor é emparelhado com o mentee para fornecer orientação em um projeto específico. Este estilo é altamente focado e orientado para resultados, ideal para situações onde o mentee precisa de assistência em um aspecto particular de seu trabalho, como a condução de uma pesquisa ou o desenvolvimento de uma nova técnica cirúrgica.
Group
O estilo “Group” envolve a mentoria de um grupo de mentees por vários mentores seniores, possivelmente de diferentes áreas de especialização. Este modelo pode ser particularmente eficaz na cirurgia, onde diferentes aspectos de uma condição clínica complexa podem ser abordados por especialistas em áreas complementares, proporcionando uma formação mais holística para o mentee.
Distance
No estilo “Distance”, o mentor é recrutado de uma instituição geograficamente separada da do mentee. Com o avanço da tecnologia, este estilo de mentoria tem se tornado cada vez mais viável, permitindo que mentees acessem orientação de especialistas de renome mundial, independentemente da localização física. Na cirurgia, isso pode significar acesso a técnicas ou conhecimentos especializados que não estão disponíveis localmente.
Aplicação na Cirurgia
Na prática da cirurgia, a escolha do estilo de mentoria deve ser cuidadosamente considerada em função das necessidades do mentee e dos recursos disponíveis. Por exemplo, um residente em início de carreira pode se beneficiar mais de uma abordagem “Dyad”, enquanto um cirurgião mais experiente, procurando desenvolver uma nova área de especialização, pode preferir um estilo “Functional” ou “Group”. É igualmente importante reconhecer que, em muitos casos, diferentes estilos de mentoria podem ser combinados ao longo da carreira de um cirurgião. Por exemplo, um cirurgião pode começar com uma mentoria “Dyad” e, conforme progride, envolver-se em “Peer” mentoring ou até mesmo em uma mentoria “Distance” para ampliar seu conhecimento em áreas específicas.
Conclusão
Os estilos de mentoria descritos por Kashiwagi oferecem uma estrutura valiosa para cirurgiões que buscam orientação em diferentes fases de suas carreiras. Compreender essas opções e aplicá-las de forma estratégica pode ser a chave para o sucesso profissional e o desenvolvimento contínuo na cirurgia.
“O verdadeiro mentor não apenas transmite conhecimento, mas também inspira a busca constante pelo aprimoramento.” – William Osler.
Gostou? Deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande suas dúvidas pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #EstilosDeMentoria #Cirurgia #MentoriaMedica #DesenvolvimentoProfissional #EducaçãoContinuada
Desafios da Mentoria Cirúrgica
Como Escolher o Mentor Ideal?
A mentoria é um pilar fundamental na formação dos cirurgiões. Contudo, encontrar o mentor ideal que não só compreenda as nuances da cirurgia, mas que também esteja alinhado com os valores e expectativas do mentee, é um desafio que não pode ser subestimado. Neste artigo, abordaremos os principais fatores que podem impactar a relação entre mentor e mentee, explorando como esses desafios se manifestam na prática da cirurgia digestiva.
Introdução
A relação de mentoria na cirurgia é complexa e multifacetada, influenciada por diversas variáveis como a geração, gênero, raça, cultura, especialização, e o equilíbrio entre vida profissional e pessoal. Estes fatores podem afetar significativamente a eficácia da mentoria e, em última análise, o sucesso profissional do mentee. No Brasil, onde a diversidade cultural e a crescente inclusão de mulheres na medicina são realidades cada vez mais presentes, entender esses desafios é essencial para uma formação cirúrgica de excelência.
Desenvolvimento
Impacto das Gerações na Mentoria Cirúrgica
Cada geração traz consigo valores e expectativas diferentes, que podem influenciar a dinâmica da mentoria. Cirurgiões da geração Baby Boomer (nascidos entre 1944 e 1959) tendem a valorizar uma hierarquia rígida, com um foco forte no trabalho e no sucesso profissional. Em contraste, cirurgiões da Geração X (nascidos entre 1960 e 1980) valorizam a independência e o equilíbrio entre vida pessoal e profissional, enquanto os Millennials (nascidos entre 1981 e 2000) buscam mentores que sejam acessíveis e que os tratem como iguais, com um foco no feedback contínuo e na flexibilidade.
Gênero e Mentoria na Cirurgia Digestiva
A composição de gênero na medicina está mudando rapidamente. Em 2010, aproximadamente 50% dos estudantes de medicina no Brasil eram mulheres. Apesar disso, a ascensão das mulheres na cirurgia acadêmica ainda enfrenta barreiras significativas, como a falta de modelos femininos de sucesso e as dificuldades em equilibrar a carreira com a vida pessoal. Dados brasileiros mostram que, em 2022, apenas 15% das cirurgiãs ocupavam posições de destaque em hospitais universitários, indicando que o “teto de vidro” ainda é uma realidade a ser superada.
Diversidade Cultural e Raça na Mentoria
No Brasil, a diversidade cultural é uma característica marcante, refletida também na formação cirúrgica. No entanto, as minorias raciais ainda estão sub-representadas entre os cirurgiões acadêmicos. Estudos mostram que apenas 7% dos cirurgiões formados em programas de residência entre 2010 e 2020 pertenciam a minorias étnicas. Esta realidade destaca a importância de um mentor que compreenda e respeite as diferenças culturais e raciais, promovendo um ambiente inclusivo e de apoio.
Especialização e seus Desafios
A especialização em cirurgia digestiva trouxe consigo novos desafios na relação de mentoria. Enquanto no passado o cirurgião geral era responsável por uma ampla gama de procedimentos, hoje a tendência é a superespecialização. Isso pode gerar conflitos quando o mentor, possivelmente de uma geração anterior, possui uma visão mais generalista, enquanto o mentee busca uma formação mais especializada.
Equilíbrio entre Vida Profissional e Pessoal
A busca por um equilíbrio entre vida profissional e pessoal é um tema recorrente entre os cirurgiões mais jovens. A geração Millennial, em particular, valoriza o tempo de qualidade fora do trabalho tanto quanto o sucesso profissional. Essa mudança de paradigma pode ser um desafio na relação mentor-mentee, especialmente quando o mentor provém de uma geração que priorizava o trabalho em detrimento da vida pessoal.
Aplicação na Cirurgia Digestiva
Para o mentee em cirurgia digestiva, escolher um mentor ideal envolve mais do que buscar alguém com conhecimento técnico. É crucial considerar como os valores e as expectativas do mentor podem influenciar o desenvolvimento de sua carreira. A escolha deve ser estratégica, buscando não apenas orientação técnica, mas também apoio em aspectos como desenvolvimento profissional, equilíbrio entre vida pessoal e profissional, e compreensão das particularidades culturais e sociais do Brasil.
Pontos-Chave
- Entender as diferenças geracionais é fundamental para alinhar expectativas entre mentor e mentee.
- A igualdade de gênero na cirurgia ainda enfrenta desafios, sendo crucial que os mentores estejam conscientes dessas barreiras.
- A diversidade cultural e racial deve ser respeitada e promovida na mentoria, especialmente em um país como o Brasil.
- A superespecialização em cirurgia digestiva pode gerar conflitos, que devem ser abordados com clareza e abertura.
- O equilíbrio entre vida profissional e pessoal é cada vez mais valorizado, sendo importante que o mentor apoie essa busca.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A mentoria na cirurgia digestiva é um desafio que exige uma abordagem holística. O mentor ideal deve ser capaz de oferecer orientação técnica de alto nível, ao mesmo tempo em que respeita e apoia as necessidades individuais do mentee. No contexto brasileiro, onde a diversidade e a inclusão são realidades cada vez mais presentes, essa sensibilidade torna-se ainda mais crucial.
“Ensinar é aprender duas vezes.” – Joseph Joubert.
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e/ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #MentoriaCirurgica #CirurgiaDigestiva #EducaçãoMedica #CarreiraCirurgica #EquilibrioProfissional
Existe o mentor ideal?
O Mentor Ideal em Cirurgia Digestiva: Um Guia para Aspirantes a Cirurgiões
Na complexa jornada para se tornar um cirurgião habilidoso, a mentoria desempenha um papel fundamental. Para estudantes de medicina, residentes de cirurgia e pós-graduandos especializados em cirurgia digestiva, a escolha de um mentor pode impactar significativamente seu desenvolvimento profissional. Compreender as características de um mentor ideal é essencial nesse contexto.
Introdução
A mentoria na cirurgia, especialmente em áreas especializadas como a cirurgia digestiva, não se trata apenas de guiar um mentorado durante sua formação médica. É uma relação que molda o futuro tanto do mentorado quanto do mentor, promovendo um legado de excelência e inovação. Mas o que exatamente faz de um mentor alguém ideal neste campo exigente e em rápida evolução?
Desenvolvimento: Características Principais do Mentor Ideal
- Reconhecimento Profissional: O mentor deve ser um especialista reconhecido, respeitado tanto dentro quanto fora de sua instituição. Esse reconhecimento não apenas inspira o mentorado, mas também abre portas para redes e oportunidades valiosas. No Brasil, onde a demanda por cirurgiões digestivos qualificados é alta, a reputação profissional de um mentor pode proporcionar uma vantagem significativa na trajetória de carreira de um mentorado.
- Generosidade com Tempo, Conhecimento e Reconhecimento: O mentor ideal é generoso com seu tempo, compartilhando habilidades clínicas e técnicas enquanto oferece orientação em pesquisa e desenvolvimento profissional. Em um país onde o equilíbrio entre trabalho e vida pessoal é cada vez mais valorizado, especialmente entre as gerações mais jovens, um mentor que consiga gerenciar seu tempo de forma eficaz, dedicando-se ao sucesso do mentorado, é inestimável.
- Integridade e Liderança Ética: Um mentor deve ser honesto e ético, guiando o mentorado pelas complexidades da pesquisa clínica, do cuidado ao paciente e dos desafios profissionais. Isso inclui ajudar o mentorado a enfrentar os inevitáveis reveses, como propostas de pesquisa rejeitadas ou resultados clínicos inesperados, com resiliência e compromisso com a verdade e a prática ética.
- Disponibilidade e Acessibilidade: Interações regulares e significativas são essenciais. O mentor deve estar acessível tanto para reuniões agendadas quanto para discussões informais. Essa disponibilidade é particularmente crítica no ambiente de alta pressão do treinamento cirúrgico, onde conselhos rápidos e bem-pensados podem fazer uma diferença significativa.
- Consciência Social e Empatia: O ambiente cirúrgico moderno exige mentores que compreendam a importância de equilibrar uma carreira de sucesso com a vida pessoal. Isso é especialmente relevante no Brasil, onde as dinâmicas culturais e sociais podem influenciar as decisões de carreira e o equilíbrio entre vida profissional e pessoal.

Pontos-chave para Mentores na Cirurgia Digestiva
Equilíbrio entre Crescimento Profissional e Pessoal: Selecione mentores que compreendam e apoiem seus objetivos pessoais e seu equilíbrio entre vida profissional e pessoal.
Procure Mentores com Histórico de Sucesso: Busque mentores que tenham um histórico de mentorados bem-sucedidos e uma forte reputação profissional.
Valorize a Liderança Ética: A integridade de um mentor é tão importante quanto sua expertise. Escolha mentores que priorizem práticas éticas e o cuidado centrado no paciente.
Garanta Comunicação Regular: Estabeleça uma rotina de reuniões regulares e seja proativo ao buscar orientação.
Aplicação na Cirurgia Digestiva
No campo da cirurgia digestiva, a relação mentor-mentorado tem implicações únicas. A complexidade dessa especialidade exige mentores que não apenas possuam expertise técnica, mas também compreendam o cenário em constante evolução das técnicas cirúrgicas e do cuidado ao paciente. No Brasil, onde as doenças digestivas representam um grande problema de saúde pública, os mentores desempenham um papel crucial na formação de cirurgiões que possam enfrentar esses desafios com abordagens inovadoras e culturalmente sensíveis.
Mentoria como Catalisador de Excelência em Cirurgia Digestiva
A jornada para se tornar um cirurgião digestivo habilidoso é desafiadora e complexa. O mentor ideal é aquele que não apenas guia você pelos aspectos técnicos da cirurgia, mas também ajuda a enfrentar os desafios profissionais e pessoais que acompanham essa carreira. Como disse o Dr. William Osler: “A prática da medicina é uma arte, não um comércio; uma vocação, não um negócio; uma vocação na qual seu coração será exercido tanto quanto sua cabeça.” Essa sabedoria aplica-se igualmente à relação mentor-mentorado, onde o coração e a mente devem trabalhar juntos para cultivar a próxima geração de líderes cirúrgicos.
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
MentoriaCirúrgica #CirurgiaDigestiva #EducaçãoMédica #CarreiraCirúrgica #DesenvolvimentoProfissional
Quando a Residência terminar…
Mentoria Cirúrgica: Transição de Mentees para Colegas e os Desafios na Cirurgia Digestiva
No ambiente acadêmico e clínico, a mentoria desempenha um papel fundamental no desenvolvimento de futuros cirurgiões. Este processo, embora enriquecedor, carrega desafios significativos, especialmente no contexto da cirurgia digestiva. Neste artigo, vamos explorar a transição de mentees para colegas, os riscos associados à mentoria e como essa dinâmica se aplica ao campo cirúrgico digestivo.
Introdução
A mentoria é um pilar no desenvolvimento de médicos e cirurgiões. Ela fornece orientação, apoio e conhecimento prático, essenciais para a formação de profissionais competentes. No entanto, à medida que a relação entre mentor e mentee evolui, surge a necessidade de redefinir os papéis para evitar a estagnação e promover a autonomia do mentee. No campo da cirurgia digestiva, essa transição é crucial, dado o alto grau de especialização e responsabilidade envolvida.
Desenvolvimento
A mentoria eficaz passa por diferentes fases, adaptando-se às necessidades em evolução de ambos os lados. Inicialmente, o mentor guia o mentee com um envolvimento mais intenso, compartilhando conhecimentos e habilidades cirúrgicas específicas. Com o tempo, à medida que o mentee adquire mais confiança e competência, o papel do mentor se transforma, permitindo que o mentee assuma mais responsabilidades e tome decisões de forma independente.
Entretanto, essa transição pode ser desafiadora. Um estudo recente aponta que 30% dos residentes de cirurgia no Brasil enfrentam dificuldades ao tentarem se tornar mais independentes, muitas vezes devido a mentores que, mesmo inconscientemente, resistem a essa mudança. Isso pode levar a uma relação disfuncional, onde o mentee sente-se preso e o mentor, ameaçado.
Aplicação na Cirurgia Digestiva
Na cirurgia digestiva, onde procedimentos complexos como hepatectomias e pancreatoduodenectomias são rotina, a necessidade de uma mentoria bem estruturada é ainda mais evidente. A transição de mentee para colega é especialmente crítica neste campo, pois envolve a confiança mútua em habilidades técnicas e no julgamento clínico. Estatísticas mostram que cirurgiões que tiveram mentores eficazes têm 20% mais chances de sucesso em procedimentos complexos e 15% menos complicações pós-operatórias, comparados àqueles que não tiveram suporte adequado. Portanto, é imperativo que os mentores na cirurgia digestiva incentivem a autonomia, permitindo que seus mentees se tornem colegas capazes e confiantes.
Pontos-chave
- Transição Gradual: A mentoria deve evoluir para uma relação de colegas, promovendo a independência do mentee.
- Comunicação Aberta: Discussões francas e não-confrontacionais são essenciais para evitar conflitos.
- Evitar Dependência: O mentor deve evitar criar uma relação de dependência, promovendo o crescimento do mentee.
- Foco na Identidade Profissional: O objetivo é que o mentee desenvolva sua própria identidade profissional, e não se torne uma cópia do mentor.
- Segurança e Respeito: Manter limites profissionais claros é essencial para uma relação saudável e produtiva.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
A mentoria na cirurgia digestiva deve ser uma via de mão dupla, onde ambos, mentor e mentee, crescem juntos. Quando bem executada, essa relação não só contribui para a formação de cirurgiões altamente competentes, mas também fortalece o próprio mentor, que se beneficia do sucesso de seu antigo mentee agora colega.
Como dito por William Osler, “A prática da medicina é uma arte, não um ofício; uma vocação, não um comércio; uma vocação na qual o coração se exercita igualmente com a cabeça.” Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
MentoriaCirúrgica #CirurgiaDigestiva #EducaçãoMédica #TransiçãoProfissional #CirurgiaGeral
Semiologia Hepatobiliopancreática
Introdução
No intricado campo da cirurgia digestiva, dominar a semiologia das condições hepatobiliares e pancreáticas é fundamental. Esses sistemas, intimamente ligados a numerosos processos fisiológicos, apresentam desafios únicos tanto no diagnóstico quanto na intervenção cirúrgica. Como a pedra angular da prática cirúrgica, a compreensão e aplicação da semiologia clínica dentro desse contexto podem impactar significativamente os resultados dos pacientes. Este artigo visa proporcionar uma exploração detalhada da semiologia relacionada à cirurgia hepatobiliar e pancreática, enfatizando a importância das técnicas de exame físico e seu papel na orientação das decisões cirúrgicas.
Exame Físico na Semiologia Hepatobilipancreática
O exame físico continua sendo um pilar na avaliação de pacientes com doenças hepatobiliares e pancreáticas. Um exame abrangente envolve quatro técnicas principais: inspeção, palpação, ausculta e percussão. Cada uma fornece insights críticos que, quando interpretados corretamente, podem guiar etapas diagnósticas e terapêuticas adicionais.
- Inspeção: A avaliação visual inicial pode revelar sinais significativos, como icterícia, que pode indicar obstrução hepática ou biliar subjacente. Além disso, a presença de distensão abdominal ou massas visíveis pode sugerir hepatomegalia ou doença pancreática avançada. Angiomas em aranha, eritema palmar e ginecomastia podem indicar doença hepática crônica.
- Palpação: A palpação permite a avaliação do tamanho, consistência e sensibilidade dos órgãos. Compreender a anatomia superficial do fígado, vesícula biliar, pâncreas e baço é crucial para uma palpação precisa:
- Fígado: A anatomia superficial do fígado corresponde ao hipocôndrio direito, estendendo-se do quinto espaço intercostal até logo abaixo da margem costal. A palpação começa na fossa ilíaca direita, movendo-se para cima em direção à margem costal, permitindo a detecção de hepatomegalia ou nodularidade.
- Vesícula Biliar: Localizada na interseção da margem costal direita e da borda lateral do músculo reto abdominal, a vesícula biliar geralmente não é palpável, a menos que esteja aumentada. Sensibilidade à palpação nesta área, especialmente com a parada inspiratória (sinal de Murphy), sugere colecistite aguda.
- Pâncreas: O pâncreas está localizado profundamente no abdômen, atrás do estômago, e geralmente não é palpável. No entanto, a sensibilidade na epigástrico, particularmente com irradiação para as costas, pode indicar inflamação ou malignidade pancreática.
- Baço: O baço está localizado no hipocôndrio esquerdo, sob as costelas nona a décima primeira. Geralmente não é palpável, a menos que esteja aumentado.
- Ausculta: Embora menos enfatizada nas avaliações hepatobiliares e pancreáticas, a ausculta ainda pode oferecer informações valiosas. Por exemplo, a presença de um sopro hepático pode sugerir carcinoma hepatocelular ou malformações vasculares.
- Percussão: A percussão ajuda a determinar o tamanho do fígado e detectar ascite. A mudança de maciez e o sinal de fluido são sinais críticos de ascite significativa, frequentemente associados a doença hepática descompensada.
Manobras Físicas Específicas
Várias manobras especializadas são integrais ao exame físico do sistema hepatobilipancreático:
- Sinal de Murphy: Uma manobra clássica na avaliação da vesícula biliar, o sinal de Murphy é executado pedindo ao paciente para inalar enquanto o examinador aplica pressão no quadrante superior direito.
- Lei de Courvoisier: A palpação de uma vesícula biliar aumentada e indolor na presença de icterícia geralmente indica obstrução maligna do ducto biliar comum.
- Sinal de Ransohoff: Nódulos palpáveis na região umbilical estão associados a malignidade intra-abdominal, incluindo câncer pancreático.
- Sinais de Grey-Turner e Cullen: Esses sinais indicam pancreatite hemorrágica.
Aplicação na Cirurgia Digestiva
O exame físico na cirurgia HBP vai além do diagnóstico; é crucial no planejamento pré-operatório e na gestão pós-operatória. Por exemplo, a avaliação da função hepática através de parâmetros clínicos e bioquímicos influencia diretamente a tomada de decisão cirúrgica.
Pontos-Chave
- Importância da Detecção Precoce: Reconhecer sinais precoces de doenças HBP pode levar a intervenções oportunas, melhorando os resultados cirúrgicos.
- Julgamento Clínico: Integrar semiologia com imagem diagnóstica e testes laboratoriais aprimora o julgamento clínico.
- Abordagem Multidisciplinar: A gestão eficaz de condições HBP frequentemente requer uma abordagem multidisciplinar.
Conclusão
Na prática da cirurgia digestiva, especialmente nas áreas hepatobiliar e pancreática, uma compreensão profunda da semiologia clínica é indispensável. Esse conhecimento facilita não apenas diagnósticos precisos, mas também decisões cirúrgicas críticas, contribuindo para melhores resultados para os pacientes.
Pensamentos Finais Como disse o grande William Osler, “O bom médico trata a doença; o grande médico trata o paciente que tem a doença.” Na complexa área da cirurgia HBP, essa filosofia ressalta a importância da semiologia na prestação de cuidados centrados no paciente.
Gostou? Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Cirrose | Avaliação Cirúrgica
Decoding the Complexities of Cirrhosis Semiology: A Surgeon’s Perspective
Introdução
A cirrose hepática é uma condição que desafia tanto clínicos quanto cirurgiões devido à sua complexidade e progressão silenciosa. Caracterizada pela fibrose hepática e nodularidade, a cirrose resulta em um comprometimento estrutural e funcional significativo do fígado. A semiologia da cirrose envolve um conjunto de sinais e sintomas clínicos que, quando corretamente interpretados, podem direcionar o diagnóstico e a abordagem terapêutica. Este artigo examina a semiologia da cirrose sob uma lente cirúrgica, destacando a importância de um exame clínico minucioso na prática cirúrgica digestiva.
Desenvolvimento
A avaliação semiológica de um paciente com cirrose hepática é fundamental para a estratificação do risco cirúrgico e planejamento terapêutico. Clinicamente, a cirrose pode ser assintomática em suas fases iniciais, o que dificulta o diagnóstico precoce. No entanto, conforme a doença progride, os sinais clássicos começam a emergir, exigindo atenção detalhada.
- Icterícia: Um dos sinais mais evidentes, resulta do acúmulo de bilirrubina no sangue devido à disfunção hepatocelular. Em estágios avançados, a icterícia pode indicar insuficiência hepática significativa, sendo crucial para a decisão cirúrgica.
- Ascite: A presença de líquido na cavidade peritoneal é um sinal de hipertensão portal, frequentemente observado na cirrose avançada. A ascite refratária pode necessitar de paracentese ou até de intervenções cirúrgicas como derivação portossistêmica intra-hepática transjugular (TIPS).
- Encefalopatia hepática: Um sinal de insuficiência hepática grave, resultante do acúmulo de toxinas no cérebro devido à incapacidade do fígado de metabolizá-las. A presença de encefalopatia modifica drasticamente o prognóstico cirúrgico e pode contraindicar intervenções invasivas.
- Hepatomegalia e Esplenomegalia: A palpação abdominal pode revelar fígado e baço aumentados, indicando fibrose e hipertensão portal, respectivamente. A hepatomegalia pode ser seguida por atrofia em estágios terminais da doença.
- Telangiectasias e Eritema Palmar: Alterações vasculares na pele refletem o hiperestrogenismo e a disfunção hepática. Embora não sejam sinais específicos, são indicadores de uma doença hepática avançada.
- Ginecomastia e Hipogonadismo: Sinais de desequilíbrio hormonal que ocorrem devido à diminuição da função hepática na metabolização de hormônios sexuais.
Esses sinais, quando avaliados em conjunto com exames laboratoriais, como o perfil hepático, e de imagem, como ultrassonografia e elastografia, permitem uma avaliação abrangente da extensão da cirrose e da viabilidade cirúrgica.
Aplicação na Cirurgia Digestiva
Na prática cirúrgica digestiva, a compreensão da semiologia da cirrose é vital para evitar complicações perioperatórias. A presença de hipertensão portal, por exemplo, aumenta o risco de sangramento em procedimentos como hernioplastias e anastomoses gastrointestinais. A ascite e a coagulopatia exigem manejo pré-operatório rigoroso para minimizar riscos. Além disso, a avaliação do estado nutricional é crucial, pois a desnutrição é comum em pacientes cirróticos e afeta diretamente o desfecho cirúrgico.
A cirurgia de emergência em pacientes cirróticos apresenta desafios adicionais, como a dificuldade em prever a resposta à anestesia e o risco de infecções pós-operatórias. Estima-se que a mortalidade cirúrgica em pacientes cirróticos seja até cinco vezes maior que na população geral, dependendo da gravidade da doença e da complexidade da cirurgia.
Pontos-Chave
- A semiologia da cirrose é essencial para o diagnóstico e manejo cirúrgico, envolvendo sinais como icterícia, ascite e encefalopatia hepática.
- A estratificação do risco cirúrgico deve considerar a extensão da disfunção hepática e as complicações associadas à cirrose.
- O manejo cirúrgico de pacientes cirróticos requer uma abordagem multidisciplinar e cuidadosa para minimizar os riscos e melhorar os resultados.
Conclusões Aplicadas à Prática do Cirurgião Digestivo
O cirurgião digestivo deve estar atento à complexidade dos pacientes cirróticos, cuja condição exige uma abordagem terapêutica individualizada e frequentemente multidisciplinar. A semiologia, aliada a exames complementares, guia o planejamento cirúrgico, otimizando os resultados e minimizando complicações. O entendimento profundo desses sinais clínicos permite uma melhor seleção dos pacientes para intervenções cirúrgicas, promovendo maior segurança e eficácia nos tratamentos.
Como disse Hipócrates: “A arte da medicina consiste em distrair o paciente enquanto a natureza cuida da doença.” O papel do cirurgião é intervir quando necessário, mas sempre respeitando os limites impostos pela condição clínica do paciente.
Gostou ❔Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #CirurgiaDigestiva #Cirrose #SemiologiaMedica #SaudeHepatica #EducaçãoMédicaContinuada
Semiologia Cirúrgica Abdominal: O Alicerce para uma Cirurgia Precisa
Sir William Osler, um dos mais influentes médicos do século XIX e XX, afirmou:
“Ouça o seu paciente, ele está lhe dizendo o diagnóstico”.
Esta frase resume a importância do exame clínico e da semiologia na prática médica, destacando que a atenção aos detalhes e à história do paciente muitas vezes fornece as pistas mais valiosas para o diagnóstico.
Introdução
A semiologia cirúrgica abdominal é a base fundamental para a prática cirúrgica de qualidade. No campo da cirurgia do aparelho digestivo, onde a precisão é essencial, a habilidade de interpretar corretamente os sinais e sintomas apresentados pelos pacientes é crucial. A semiologia não apenas orienta o diagnóstico, mas também desempenha um papel vital na definição da estratégia cirúrgica, na escolha das técnicas apropriadas e na antecipação de possíveis complicações. Compreender a semiologia abdominal é, portanto, um pré-requisito indispensável para qualquer cirurgião que aspire à excelência em sua prática.
Fisiopatologia da Dor Abdominal e Sua Diferenciação
A dor abdominal é um sintoma frequente na prática clínica e pode ser um desafio diagnóstico devido à sua etiologia multifatorial. A compreensão da fisiopatologia da dor abdominal é fundamental para sua correta avaliação. A dor pode ser visceral, somática ou referida, cada uma com características clínicas distintas.
- Dor Visceral: Geralmente causada pela distensão ou inflamação de órgãos internos, como intestinos ou estômago. Essa dor é frequentemente mal localizada e descrita como uma sensação de cólica ou pressão.
- Dor Somática: Origina-se da irritação do peritônio parietal ou da musculatura abdominal, é bem localizada e tende a ser descrita como uma dor aguda e constante. Exemplos incluem a dor causada por apendicite ou peritonite.
- Dor Referida: Ocorre quando a dor originada em um órgão é percebida em uma área distante do local de origem. Um exemplo clássico é a dor no ombro esquerdo associada a condições como pancreatite ou colecistite.
Mecanismo Fisiopatológico
As zonas de Head são áreas da pele onde a dor pode ser referida a partir de órgãos internos devido à convergência de fibras nervosas viscerais e somáticas nos mesmos segmentos da medula espinhal. Quando um órgão interno, como a vesícula biliar ou o apêndice, é inflamado ou irritado, as fibras nervosas viscerais transmitem sinais de dor para a medula espinhal. Essas fibras convergem com fibras somáticas no mesmo nível da medula espinhal. Como o cérebro não distingue perfeitamente entre a dor visceral e somática, ele pode interpretar a dor visceral como se estivesse vindo da pele ou músculos inervados pelos mesmos segmentos da medula espinhal.
Colecistite Aguda
Na colecistite aguda, que é a inflamação da vesícula biliar, a dor é inicialmente localizada no quadrante superior direito do abdome, refletindo a localização anatômica da vesícula biliar. No entanto, devido ao envolvimento do nervo frênico, que compartilha origem segmentar com a vesícula biliar, a dor pode ser referida para o ombro direito. Esse fenômeno ocorre porque o nervo frênico, que inerva o diafragma, também é derivado dos segmentos cervicais (C3-C5) da medula espinhal, os mesmos que inervam a pele sobre o ombro.
Apendicite Aguda
Na apendicite aguda, a dor inicial geralmente é referida para a região periumbilical. O apêndice é inervado por fibras viscerais provenientes do plexo celíaco, cujas fibras nervosas entram na medula espinhal ao nível de T10. Por causa dessa inervação, o cérebro inicialmente localiza a dor no umbigo, que também é inervado pelo mesmo nível segmentar (T10). À medida que a inflamação do apêndice progride e envolve o peritônio parietal, a dor torna-se localizada no quadrante inferior direito do abdome, o que reflete a irritação somática mais precisa do peritônio.
A correta diferenciação desses tipos de dor é essencial para o cirurgião, pois direciona a investigação diagnóstica e, em última análise, a abordagem terapêutica.
Exame Físico Abdominal
O exame físico abdominal é composto por quatro etapas principais: inspeção, palpação, ausculta e percussão. Cada uma dessas etapas fornece informações críticas que ajudam a refinar as hipóteses diagnósticas iniciais e a definir a conduta cirúrgica.
- Inspeção: Envolve a observação detalhada do abdome em busca de sinais visíveis como distensão, cicatrizes, circulação colateral ou hérnias. A inspeção pode fornecer pistas importantes, como a presença de icterícia, que pode indicar obstrução biliar.
- Palpação: É realizada para avaliar a sensibilidade, a presença de massas e sinais de irritação peritoneal. A palpação suave e profunda pode revelar condições como hepatomegalia, esplenomegalia, ou a presença de massas abdominais.
- Ausculta: A ausculta dos ruídos intestinais é essencial para avaliar a motilidade gastrointestinal. A ausência de sons intestinais, por exemplo, pode indicar íleo paralítico, enquanto ruídos metálicos são sugestivos de obstrução intestinal.
- Percussão: Utilizada para avaliar a presença de líquidos, gases e o tamanho dos órgãos intra-abdominais. A percussão de áreas dolorosas também pode revelar sinais de peritonite.
Diagnóstico Semiológico das Hérnias Inguino-Cruais e Manobras Semiológicas Utilizadas
As hérnias inguino-crurais são uma condição comum na prática cirúrgica, especialmente em pacientes do sexo masculino. O diagnóstico clínico dessas hérnias depende de um exame físico minucioso e da realização de manobras específicas.
- Inspeção e Palpação: Na inspeção, o paciente deve ser examinado em posição ortostática e decúbito dorsal. A observação de abaulamento na região inguinal ao pedir para o paciente tossir ou realizar a manobra de Valsalva é um sinal indicativo de hérnia. Na palpação, a tentativa de reduzir a hérnia e a determinação do ponto de origem do abaulamento (inguinal ou femoral) são cruciais.
- Manobra de Valsalva: Esta manobra intensifica o abaulamento da hérnia, tornando-a mais evidente.
- Manobra de Landivar: Consiste em aplicar pressão digital sobre o anel inguinal profundo enquanto o paciente tosse. A protrusão na região inguinal indica uma hérnia indireta, enquanto a ausência de protrusão pode sugerir uma hérnia direta.
A diferenciação entre hérnias inguinais diretas e indiretas é importante para o planejamento cirúrgico, já que o tratamento pode variar conforme o tipo de hérnia.
Sinais Clínicos de Neoplasia Intra-Abdominal
As neoplasias intra-abdominais são uma preocupação constante na prática cirúrgica e podem se manifestar de várias maneiras. O reconhecimento precoce de sinais clínicos específicos pode levar a um diagnóstico mais rápido e a um melhor prognóstico.
- Perda de Peso Inexplicada: É um sintoma comum em pacientes com neoplasias malignas, especialmente as de localização gastrointestinal.
- Massa Palpável: Massas abdominais podem ser palpáveis, especialmente em neoplasias de grandes dimensões, como tumores do cólon ou do ovário.
- Ascite: A presença de ascite, especialmente quando acompanhada por nódulos peritoneais palpáveis (nódulos de Sister Mary Joseph), pode indicar carcinomatose peritoneal.
- Icterícia: A icterícia pode ser um sinal de neoplasias hepáticas ou de obstrução biliar por tumores como o carcinoma de pâncreas.
O diagnóstico clínico das neoplasias intra-abdominais frequentemente requer a integração de achados semiológicos com exames de imagem, como ultrassonografia e tomografia computadorizada, para uma avaliação completa.
Estigmas Clínicos de Hepatopatias e Hipertensão Portal
Os estigmas clínicos de hepatopatias e hipertensão portal são sinais que indicam a presença de doenças hepáticas crônicas e complicações associadas. O reconhecimento desses estigmas é crucial para a avaliação e manejo adequado dos pacientes.
- Circulação Colateral: A presença de circulação colateral na parede abdominal, especialmente na forma de “cabeça de medusa,” indica hipertensão portal.
- Eritema Palmar: Pode ser um sinal de insuficiência hepática crônica.
- Ginecomastia: O aumento das mamas em homens pode ser observado em hepatopatias avançadas devido ao desequilíbrio hormonal.
- Esplenomegalia: O aumento do baço é frequentemente associado à hipertensão portal e pode ser palpável no exame físico.
- Encefalopatia Hepática: Alterações no estado mental, incluindo confusão e letargia, são sinais de encefalopatia hepática, uma complicação grave da insuficiência hepática.
Esses estigmas clínicos, quando presentes, sugerem a necessidade de uma investigação aprofundada, incluindo exames laboratoriais e de imagem, para confirmar o diagnóstico de hepatopatia crônica e avaliar a presença de hipertensão portal.
Sinais Especiais
Além das etapas clássicas do exame físico, alguns sinais especiais desempenham um papel crucial no diagnóstico de condições cirúrgicas. Esses sinais são manifestações clínicas específicas que, quando presentes, podem sugerir patologias particulares.
- Sinal de Courvoisier: A presença de vesícula biliar palpável e indolor associada a icterícia sugere carcinoma da cabeça do pâncreas, e não cálculo biliar.
- Sinal de Cullen: Equimose peri-umbilical, frequentemente associada a pancreatite hemorrágica ou gravidez ectópica rota.
- Sinal de Grey Turner: Equimose nos flancos, também indicativa de pancreatite hemorrágica.
- Sinal de Rovsing: Dor no quadrante inferior direito do abdome durante a palpação do quadrante inferior esquerdo, indicativo de apendicite.
- Sinal de Murphy: Dor no quadrante superior direito exacerbada pela inspiração, sugestiva de colecistite aguda.
- Nódulo de Virchow: Presença de linfonodo palpável na fossa supraclavicular esquerda, frequentemente associada a carcinoma esofagogástrico avançado.
Pontos-Chave
- Importância da Semiologia: A avaliação semiológica é crucial para a formulação do diagnóstico e para a tomada de decisões cirúrgicas.
- Fisiopatologia da Dor Abdominal: Compreender a diferenciação entre dor visceral, somática e referida é fundamental para o diagnóstico correto.
- Exame Físico Minucioso: Inspeção, palpação, ausculta e percussão são etapas fundamentais que devem ser executadas com rigor e sistematicidade.
- Sinais Especiais: O reconhecimento de sinais especiais, como os de Courvoisier, Cullen, e Murphy, é essencial para a identificação de condições cirúrgicas específicas.
Conclusão
A semiologia cirúrgica abdominal continua a ser uma competência essencial na formação de cirurgiões do aparelho digestivo. O domínio dessa arte permite ao cirurgião conduzir intervenções mais seguras, eficazes e baseadas em uma compreensão aprofundada do quadro clínico do paciente. À medida que a tecnologia avança e novas técnicas minimamente invasivas emergem, a semiologia permanece como um pilar insubstituível da prática cirúrgica. Como bem afirmou William Halsted, um dos pioneiros da cirurgia moderna: “O melhor cirurgião é aquele que sabe quando não operar.” Essa sabedoria está intrinsecamente ligada a uma sólida formação semiológica.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags:
#CirurgiaAbdominal #SemiologiaCirúrgica #EducaçãoMédica #AparelhoDigestivo #CirurgiaGeral
Endoscopia Gastrointestinal
Os endoscópios flexíveis modernos são verdadeiros prodígios da ciência médica. Esses dispositivos tubulares, finos e altamente flexíveis, iluminados por poderosas fontes de luz, possuem canais que permitem irrigação, sucção e limpeza de lentes, além de possibilitar a coleta de amostras de tecido, injeção de substâncias e a introdução de dispositivos auxiliares, como clipes e stents. Desde sua introdução ampla, essas ferramentas transformaram dramaticamente o cenário da prática cirúrgica. Procedimentos menos invasivos, realizados endoscopicamente em vez de cirurgicamente, revolucionaram a prática médica. A introdução da gastrostomia endoscópica percutânea (PEG) por Ponsky, a colangiopancreatografia retrógrada endoscópica (CPRE) descrita por McCune, a utilização do endoscópio flexível por Sugawa para identificar a origem de sangramentos gastrointestinais superiores durante a laparotomia, e o uso do endoscópio por Youmans Jr. para tratar sangramentos gastrointestinais superiores, marcaram o início de uma nova era. Cirurgiões sem habilidades endoscópicas começaram a perceber que estavam despreparados para o futuro da cirurgia digestiva.
A Explosão da Prática Endoscópica
Uma vez que essas ferramentas aumentaram o rendimento diagnóstico e a localização precisa de lesões, como cânceres do trato intestinal e locais de sangramento gastrointestinal, a prática endoscópica experimentou uma explosão contínua, especialmente após o advento da endoscopia terapêutica. Durante as décadas de 1970 e 1980, enquanto muitos cirurgiões digestivos focavam nos desenvolvimentos cirúrgicos tradicionais e em suas práticas operatórias intensas, outros continuaram a busca por métodos cada vez menos invasivos para diagnóstico e tratamento de problemas comuns, como demonstrado em vários estudos.
Sangramentos gastrointestinais, pólipos intestinais e cálculos no ducto biliar comum tornaram-se alvos dessas inovações. Logo, os métodos endoscópicos de tratamento mudaram o cenário da prática cirúrgica. O desenvolvimento contínuo da endoscopia flexível empurrou os limites do tratamento para além da sala de operações, e outros especialistas passaram a reivindicar essa ferramenta e o conjunto de procedimentos desenvolvidos em torno dela como seus, numa tentativa de excluir os cirurgiões da prática desse “estado da arte” em benefício de seus pacientes. No entanto, a endoscopia gastrointestinal flexível deve seu desenvolvimento à cirurgia e permanece bem estabelecida em nossa disciplina.
Conceitos Gerais
É impossível fornecer mais do que uma introdução a um campo tão amplo como a endoscopia cirúrgica em um texto único. Existem obras inteiras dedicadas a cada um dos procedimentos endoscópicos flexíveis comumente empregados na prática clínica. A aquisição de habilidades endoscópicas requer exposição clínica direta, uma experiência imersiva e o uso de uma ferramenta validada para avaliar a competência após o treinamento ministrado por um endoscopista experiente.
A Importância da Endoscopia na Cirurgia Gastrointestinal
A inclusão da endoscopia gastrointestinal flexível na prática cirúrgica melhora o desempenho e os resultados das cirurgias gastrointestinais. Em seu nível mais básico, o endoscópio é uma ferramenta que, quando usada para inspecionar ao final de uma operação envolvendo reconstrução ou anastomose do trato gastrointestinal, confirma para os pacientes e cirurgiões que os objetivos da cirurgia foram alcançados de forma segura. Todos os cirurgiões que operam no trato gastrointestinal devem ter grande facilidade no uso de endoscópios para testar anastomoses quanto a vazamentos, inspecionar superfícies mucosas para isquemia e avaliar a adequação de procedimentos reconstrutivos, como a fundoplicatura de Nissen, ou a completude de dissecações importantes para resultados ótimos, como durante a miotomia esofágica para acalasia. A endoscopia intraoperatória tornou-se uma parte crucial da cirurgia gastrointestinal.
Cirurgiões gerais, por exemplo, há muito tempo encontraram na endoscopia cirúrgica uma parte importante de suas práticas, oferecendo serviços de triagem, diagnóstico e terapêutica que, de outra forma, não estariam disponíveis em suas comunidades no interior do Brasil. Uma publicação de 2005 revelou que os cirurgiões gerais realizavam mais procedimentos endoscópicos do que procedimentos operatórios nos EUA, o que era essencial para suas comunidades e práticas. Esses resultados demonstraram também que, enquanto cirurgiões digestivos em centros urbanos realizavam menos procedimentos endoscópicos do que seus colegas cirurgiões gerais em centros menores, o número de procedimentos de endoscopia gastrointestinal flexível realizados por cirurgiões urbanos também era substancial, reafirmando que a endoscopia continua sendo uma ferramenta importante para o cuidado do paciente cirúrgico em todas as situações.
Impactos Econômicos e a Relevância Futura
Independentemente do ambiente de prática, os cirurgiões devem ser incentivados a manter suas habilidades endoscópicas e incorporá-las à prática para o benefício de seus pacientes e comunidades. Em meio à incerteza sobre políticas futuras que orientarão o sistema de saúde e a formação médica, é sensato, do ponto de vista econômico, colocar endoscópios flexíveis nas mãos dos cirurgiões digestivos. Estudos sobre a força de trabalho em saúde sugerem que a combinação de capacidades de especialistas e a superação das barreiras tradicionais de cuidado podem ser mais eficientes e melhorar a qualidade e a rapidez do atendimento.
Cirurgiões que combinam seu extenso conhecimento e experiência no tratamento de condições e sintomas, como doença do refluxo gastroesofágico, hemorragia gastrointestinal, malignidade gastrointestinal, disfagia e dor abdominal, provavelmente proporcionarão uma abordagem mais eficiente em termos de custos e resultados para esses pacientes, quando envolvidos precocemente, devido ao amplo espectro de capacidades diagnósticas e terapêuticas disponíveis. Ao eliminar atrasos e consultas desnecessárias com outros especialistas, o cirurgião é capaz de montar rapidamente uma avaliação que beneficia o paciente de maneira econômica.
Incorporar a endoscopia gastrointestinal flexível na prática cirúrgica atende às necessidades de nossos pacientes hoje e será um conjunto de habilidades cada vez mais importante para as futuras gerações de cirurgiões. O endoscópio flexível emergiu como uma plataforma empolgante sobre a qual se basearão futuros procedimentos cirúrgicos minimamente invasivos. Considerem o impacto positivo da triagem colonoscópica eficaz e da ablação endoscópica para pacientes com esôfago de Barrett, por exemplo, e o uso da ressecção endoscópica de mucosa (EMR) ou da dissecção endoscópica submucosa (ESD) para aqueles com câncer precoce de reto ou esôfago. Abordagens cirúrgicas tradicionais continuarão a ser menos necessárias, e terapias menos invasivas, baseadas na plataforma de endoscopia gastrointestinal flexível, emergirão como novos padrões em nossa abordagem a muitos pacientes. Cirurgiões digestivos que não desenvolvem e mantêm suas habilidades em endoscopia gastrointestinal perderão a oportunidade de participar da próxima época de nossa especialidade.
Considerações Práticas e Procedimentos Específicos
Aqueles que não aprenderam endoscopia durante o treinamento devem fazer esforços especiais para adquirir esse conhecimento e ganhar experiência clínica. A busca por oportunidades de fellowship está disponível para cirurgiões que podem se afastar de sua prática, e programas individualizados de instrução e avaliação são possíveis, variando de local para local. A mentoria é um marco da comunidade cirúrgica, e cirurgiões interessados em treinamento adicional e educação contínua visando à obtenção de maestria em novas habilidades devem buscar arranjos de mentoria que funcionem melhor em seus ambientes individuais.
Por fim, embora seja uma tarefa impossível discutir em detalhes todas as técnicas endoscópicas básicas e avançadas, os procedimentos fundamentais que serão empregados pela maioria dos cirurgiões são a esofagogastroduodenoscopia (EGD) e a colonoscopia. Estes devem ser aprendidos e dominados para que os cirurgiões possam oferecer aos pacientes uma escolha ótima de procedimentos e excelentes resultados clínicos.
Gostou ❔ Nos deixe um comentário ✍️, compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Semiologia do Paciente Cirúrgico
Objetivos de Aprendizado
✓ Compreender os princípios de como realizar uma anamnese clara, realizar um exame físico adequado, apresentar os achados e formular um plano de manejo para diagnóstico cirúrgico.
✓ Entender a nomenclatura comum utilizada na cirurgia. Os estudantes que fazem parte da equipe cirúrgica, ao lidarem com seus pacientes, devem reconhecer os seguintes passos no manejo dos mesmos:
- Anamnese: Ouça atentamente a história do paciente.
- Exame Físico: Realize uma avaliação minuciosa.
- Registro de Notas: Documente os achados com precisão.
- Construção de Diagnóstico Diferencial: Pergunte-se: “Qual diagnóstico melhor explica este quadro clínico?”
- Investigações Complementares: Quais exames laboratoriais e de imagem são necessários para confirmar ou refutar o diagnóstico clínico?
- Manejo: Decida sobre o tratamento do paciente. Lembre-se de incluir a tranquilização, o alívio da dor e, na medida do possível, acalmar a ansiedade do paciente.
História Clínica e Exame Físico
O desenvolvimento de habilidades clínicas não pode ser subestimado. A dependência excessiva em investigações especiais e em imagens modernas (algumas das quais podem ser dolorosas e carregam seus próprios riscos e complicações) é renunciar às habilidades necessárias para se tornar um bom médico. Lembre-se de que o paciente estará apreensivo e, muitas vezes, com dor e desconforto. Atender a essas necessidades é a primeira tarefa de um bom médico.
A História Clínica
A história deve ser um reflexo preciso do que o paciente disse, e não sua interpretação. Faça perguntas abertas, como “Quando você estava bem pela última vez?” e “O que aconteceu depois?”, em vez de perguntas fechadas, como “Você tem dor no peito?”. Se você encontrar algo positivo, não mude de assunto até saber tudo sobre isso. Por exemplo: “Quando começou?”, “O que melhora e o que piora?”, “Onde começou e para onde foi?”, “Foi constante ou intermitente?”. Se o sintoma for caracterizado por sangramento, pergunte sobre o tipo de sangue, quando ocorreu, em que quantidade, se havia coágulos, se estava misturado com alimentos/fezes e se estava associado à dor. Lembre-se de que a maioria dos pacientes procura um cirurgião por causa de dor ou sangramento.
Tenha em mente que o paciente não tem conhecimento de anatomia. Ele pode dizer “meu estômago dói”, mas isso pode ser dor no peito inferior ou na região periumbilical – peça para ele apontar o local da dor. Tenha em mente que ele pode estar apontando para uma dor referida. Similarmente, não aceite “dor nas costas” sem esclarecer onde exatamente – sacro, coluna lombar, torácica ou cervical, ou talvez regiões lombares ou subescapulares. Ao se referir à ponta do ombro, esclareça se o paciente se refere ao acrômio; ao se referir à escápula, esclareça se é o ângulo da escápula. Tais locais de dor podem sugerir dor referida do diafragma e da vesícula biliar, respectivamente.
Muitas vezes, é útil considerar as vísceras em termos de sua embriologia. Assim, a dor epigástrica geralmente se origina de estruturas do intestino anterior, como estômago, duodeno, fígado, vesícula biliar, baço e pâncreas; a dor periumbilical é uma dor do intestino médio, proveniente do intestino delgado e do cólon ascendente, incluindo o apêndice; a dor suprapúbica é uma dor do intestino posterior, originada no cólon, reto e outras estruturas da cloaca, como a bexiga, o útero e as trompas de Falópio. A dor testicular pode também ser periumbilical, refletindo a origem intra-abdominal desses órgãos antes de sua descida para o escroto – nunca se deixe enganar pela criança com torção testicular que se queixa de dor no centro do abdômen.
O Exame Físico
Lembre-se da clássica sequência nesta ordem:
- Inspeção
- Palpação
- Percussão
- Auscultação
Aprenda a arte da inspeção cuidadosa e mantenha as mãos longe do paciente até concluir essa etapa. Observe o paciente de forma geral, como ele se deita e como respira. Ele está taquipneico devido a uma infecção pulmonar ou em resposta a uma acidose metabólica? Observe as mãos do paciente e sinta seu pulso. Pedir que ele caminhe pode revelar informações importantes em alguém com claudicação ou na avaliação da condição física geral.
Somente após uma inspeção cuidadosa você deve prosseguir para a palpação. Se estiver examinando o abdômen, peça ao paciente que tussa. Isso é um teste indireto de dor à descompressão e indica onde está o local de inflamação dentro da cavidade peritoneal. Lembre-se de examinar primeiro o lado “normal”, o lado que não é sintomático, seja no abdômen, mão, perna ou mama. Observe o paciente enquanto palpa. Se houver um nódulo, determine em qual plano anatômico ele está localizado. Está na pele, no tecido subcutâneo, na camada muscular ou, no caso do abdômen, na cavidade subjacente? O nódulo é pulsátil, expansivo ou móvel?
Escrevendo Suas Notas
Sempre registre seus achados de forma completa e precisa. Comece anotando a data e a hora da entrevista, e verifique se o nome do paciente está no topo da página e se estas são as notas corretas. Registre todos os achados, tanto negativos quanto positivos. Evite abreviações, pois podem significar coisas diferentes para pessoas diferentes; por exemplo, PID – você pode estar se referindo à doença inflamatória pélvica, mas a próxima pessoa pode interpretar como um disco intervertebral prolapsado. Use a terminologia cirúrgica correta.
Ilustre seu exame de forma clara com desenhos – use pontos de referência anatômicos e meça com precisão o diâmetro dos nódulos. Ao desenhar achados abdominais, utilize uma representação hexagonal. Uma linha contínua implica uma borda; o sombreamento pode representar uma área de sensibilidade ou o local onde a dor é sentida. Se puder palpar todo o contorno de um nódulo, desenhe uma linha para indicar isso; se puder sentir apenas a margem superior, desenhe apenas essa parte. Anote os desenhos com seus achados. No final das suas notas, escreva um resumo em um único parágrafo e faça um diagnóstico ou anote um diagnóstico diferencial. Delineie um plano de manejo e indique quais exames devem ser realizados, especificando quais você já providenciou. Assine suas notas e escreva seu nome, posição, e a hora e data legíveis abaixo.
Apresentação de Caso
O objetivo de apresentar um caso é transmitir aos seus colegas as características clínicas importantes, o diagnóstico ou diagnóstico diferencial, o manejo e as investigações do seu paciente. A apresentação não deve ser uma leitura das notas do caso, mas deve ser sucinta e objetiva, contendo achados positivos e negativos importantes. Evite usar palavras como “basicamente”, “essencialmente” ou “irrelevante”, que são supérfluas e sem sentido. Evite dizer que algo é “apenas” palpável – ou você pode sentir ou não. Decida-se. Ao final de uma boa apresentação, o ouvinte deve ter uma excelente imagem mental do paciente e dos seus problemas, o que deve ser monitorado e quais são os planos de manejo.
Conclusão
A estratégia cirúrgica envolve uma combinação de habilidades clínicas meticulosas, julgamento criterioso e uma abordagem sistemática para garantir o melhor cuidado ao paciente. Da anamnese detalhada ao exame físico preciso, cada etapa é crucial para um diagnóstico e manejo eficazes. Assim, a arte da cirurgia não reside apenas na técnica operatória, mas na compreensão e no respeito às necessidades e preocupações do paciente, garantindo um tratamento holístico e humanizado.
Gostou ❔ Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
Hashtags: #EstratégiaCirúrgica #Anamnese #ExameFísico #DiagnósticoDiferencial #ManejoCirúrgico
Princípios Anatômicos da Laparotomia Exploradora
Introdução
A laparotomia, termo utilizado para descrever qualquer acesso aberto à cavidade peritoneal, abrange incisões na linha média, bem como abordagens paramedianas e oblíquas. É o método tradicional de acesso para a maioria das cirurgias viscerais, ainda sendo a abordagem preferida em casos de trauma, emergências e cirurgias extensas. A laparotomia, além de permitir um acesso amplo e direto, requer uma compreensão detalhada dos princípios anatômicos e técnicos que a sustentam, garantindo a eficácia e segurança do procedimento.
Preparação Pré-operatória
A preparação para uma laparotomia começa com uma série de medidas essenciais que visam otimizar as condições cirúrgicas e a segurança do paciente:
- Anestesia Geral (GA): A maioria das incisões laparotômicas, exceto as menores na porção inferior do abdômen, requer anestesia geral para proporcionar relaxamento muscular adequado e analgesia.
- Tipagem sanguínea e reserva: Dependendo do procedimento planejado, é necessário realizar tipagem e reserva ou compatibilização cruzada de sangue.
- Consentimento informado: Garantir que o paciente tenha consentido para outros procedimentos que possam ser necessários durante a cirurgia.
Posicionamento e Configuração da Sala Cirúrgica
- Cateterização uretral: Recomendada para a maioria das laparotomias, especialmente se houver patologia abdominal inferior, para garantir a descompressão da bexiga.
- Sonda nasogástrica (SNG): Indicada em casos de obstrução intestinal superior, para reduzir o risco de aspiração durante a indução anestésica.
- Posicionamento da mesa cirúrgica: A posição supina é a mais comum para cirurgias viscerais abertas, como aquelas envolvendo intestino delgado, intestino grosso e estômago. Outras posições, como Lloyd-Davis (supina com leve flexão e abdução dos quadris), podem ser utilizadas para acesso ao períneo e reto.
Passos da Cirurgia
- Incisão cutânea: Realizada com bisturi ou diatermia de corte com eletrodo de ponta fina, conforme a abordagem cirúrgica escolhida.
- Incisão no tecido adiposo: Utiliza-se diatermia combinada para reduzir o risco de sangramento.
Acesso pela Linha Média
- Incisão na fáscia da linha média: Realizada na linha alba, onde as fibras fasciais cruzadas obliquamente são identificadas e expostas. A fáscia é elevada com pinças para gerar pressão intra-abdominal negativa e incisa de forma aguda.
- Extensão do acesso: Realizada com diatermia combinada na linha média.
Acesso Paramediano
- Incisão na fáscia da bainha do reto: Realizada verticalmente com diatermia combinada.
- Musculatura do reto: As fibras musculares são separadas minimamente, sem divisão muscular significativa.
- Incisão peritoneal: Realizada após elevação com pinças e incisão aguda.
- Extensão do acesso: Com diatermia combinada verticalmente.
Acesso Oblíquo (e.g., Gridiron, Subcostal)
- Incisão na fáscia da bainha do reto: Realizada de forma oblíqua com diatermia combinada.
- Musculatura: Para incisões menores, a separação das fibras pode proporcionar acesso adequado. Incisões maiores podem requerer divisão muscular com diatermia de coagulação.
Procedimentos Básicos
- Avaliação das vísceras não-alvo: Embora a importância dessa prática tenha diminuído com o advento da imagem pré-operatória (como a tomografia computadorizada), ainda é realizada em uma progressão lógica, avaliando-se o intestino delgado, omento, cólon transverso, baço, estômago, fígado, vesícula biliar, rins, bexiga, útero e ovários.
- Avaliação do órgão-alvo: Deve-se considerar a ressecabilidade, extensão da ressecção e mobilidade das estruturas a serem anastomosadas.
Princípios Chave da Laparotomia de Emergência
- Controle de sangramento: Deve-se inicialmente controlar o sangramento por meio de pressão com compressas, removendo-as gradualmente para identificar e tratar os locais de sangramento.
- Lesões viscerais múltiplas: Prioriza-se o controle e fechamento das lesões ao invés da restauração anatômica imediata, que pode ser postergada para procedimentos subsequentes.
- Contaminação: Todas as áreas de contaminação devem ser identificadas e tratadas, com irrigação copiosa e uso de drenos de grande calibre para áreas altamente contaminadas.
Fechamento
- Peritônio: Deve ser aproximado, se possível, para reduzir o risco de aderências.
- Fáscia: Sempre fechada, geralmente com suturas absorvíveis pesadas.
- Pele: Pode ser fechada com suturas subcuticulares ou interrompidas, ou com clipes.
Complicações Específicas
As complicações associadas à laparotomia incluem infecção da ferida, com incidência de 2 a 30%, dependendo da patologia, e hérnia incisional, que pode ocorrer em até 30% dos casos, especialmente em pacientes com sepse, desnutrição ou idade avançada.
Conclusão
A laparotomia exploradora é um procedimento fundamental na cirurgia abdominal, exigindo um conhecimento profundo da anatomia e uma abordagem técnica precisa para garantir o sucesso cirúrgico e a segurança do paciente. Desde a preparação pré-operatória até o fechamento da incisão, cada passo deve ser realizado com atenção aos princípios anatômicos e técnicos, prevenindo complicações e otimizando os resultados.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#LaparotomiaExploradora #CirurgiaAbdominal #EducaçãoMédicaContinuada #AnatomiaCirúrgica #ProcedimentosCirúrgicos
Manejo da Icterícia Perioperatória: Abordagens e Complicações
Introdução
A icterícia perioperatória representa um desafio significativo no manejo de pacientes cirúrgicos, especialmente no contexto das cirurgias do aparelho digestivo. Esta condição, caracterizada pela coloração amarelada da pele e mucosas devido ao acúmulo de bilirrubina, pode ter várias etiologias e complicações graves, incluindo insuficiência renal, infecção biliar, e coagulopatia. O reconhecimento precoce e a gestão adequada dessas complicações são cruciais para minimizar a morbidade e mortalidade associadas. Este artigo revisará os principais aspectos do manejo da icterícia perioperatória, oferecendo orientações práticas para médicos em formação e cirurgiões.
Complicações da Icterícia
- Insuficiência Renal (Síndrome Hepatorrenal) A insuficiência renal em pacientes com icterícia é frequentemente causada por uma combinação de infecção, desidratação e efeitos tóxicos diretos dos altos níveis de bilirrubina e outros metabólitos sobre os rins. Esta condição é particularmente perigosa em pacientes com mais de 65 anos e níveis elevados de ureia no sangue. O manejo eficaz inclui a correção da desidratação, o controle da infecção e a monitorização rigorosa da função renal.
- Infecção Biliar (Colangite) A colangite é uma complicação comum da icterícia obstrutiva, especialmente em pacientes com árvores biliares previamente danificadas. Gram-negativos, como Escherichia coli e Pseudomonas, são os patógenos mais frequentemente envolvidos. O manejo inicial inclui a administração de antibióticos intravenosos de amplo espectro e, em muitos casos, intervenções para desobstruir as vias biliares, como drenagem radiológica, CPRE (Colangiopancreatografia Retrógrada Endoscópica) ou, raramente, cirurgia.
- Coagulopatia Pacientes com icterícia apresentam síntese diminuída dos fatores de coagulação dependentes da vitamina K (fatores II, VII, IX, X), além de disfunção plaquetária, o que pode predispor a sangramentos perioperatórios. O manejo inclui a monitorização dos tempos de coagulação (TP e TTPA) e a administração de vitamina K intravenosa quando necessário.
- Imunossupressão Relativa A combinação de icterícia, infecção e diminuição da síntese proteica leva a uma imunossupressão relativa, predispondo os pacientes a infecções sistêmicas, como pneumonia, e comprometendo a cicatrização de feridas. A administração profilática de antibióticos e o suporte nutricional adequado são fundamentais para minimizar esses riscos.
Tratamento Agudo: Abordagens Gerais
- Equilíbrio Hídrico A correção da desidratação é uma prioridade. Em pacientes sem doença hepática pré-existente, pode-se administrar até 1000 mL de cristaloides intravenosos, com monitorização rigorosa do sódio em pacientes com doença hepática. O controle do débito urinário, muitas vezes através de cateter uretral, é essencial para avaliar a função renal.
- Tratamento da Infecção A febre em pacientes com icterícia deve ser investigada com culturas de sangue e o início imediato de antibióticos intravenosos, seguindo os protocolos locais. Intervenções para desobstrução biliar podem ser necessárias urgentemente para prevenir a progressão da infecção.
- Correção da Coagulação A monitorização dos tempos de coagulação deve ser realizada de rotina, com administração de vitamina K intravenosa em casos de prolongamento do TP. Isso é crucial para prevenir sangramentos intraoperatórios e complicações pós-operatórias.
- Nutrição Adequada Uma revisão dietética deve ser solicitada para garantir suporte nutricional adequado, preferencialmente por via enteral. Em casos graves, pode ser necessário o uso de sonda nasogástrica de calibre fino ou, raramente, gastrostomia ou jejunostomia cirúrgica.
Tratamento Agudo: Abordagens Específicas
- Procedimentos Endoscópicos (CPRE) A CPRE com esfincterotomia é frequentemente utilizada para extração de cálculos do ducto biliar comum e tratamento de estenoses ampulares. Em casos onde os cálculos não podem ser removidos facilmente, a inserção de stents pode ser necessária.
- Colangiografia Transhepática Percutânea (CTP) A CTP pode ser usada para inserção de stents ou drenagem externa temporária do sistema biliar obstruído, especialmente em combinação com a CPRE.
- Drenagem Cirúrgica Em casos raros, onde as intervenções menos invasivas falharam, pode ser indicada a drenagem cirúrgica, como a coledocoduodenostomia. No entanto, essa abordagem está associada a alta morbidade e mortalidade, sendo reservada para situações muito específicas.
Prognóstico e Fatores de Risco
O prognóstico em pacientes com icterícia aguda depende de vários fatores de risco adversos, incluindo idade superior a 65 anos, níveis elevados de ureia e bilirrubina plasmática, sepse descontrolada e disfunção multiorgânica. A presença de doença maligna subjacente também é um indicador prognóstico negativo.
Conclusão
O manejo da icterícia perioperatória exige uma abordagem multidisciplinar e uma vigilância constante para prevenir complicações graves. Intervenções oportunas e precisas podem reduzir significativamente a morbidade e melhorar os desfechos clínicos em pacientes com essa condição complexa. Como enfatizou o renomado cirurgião Moshe Schein: “A cirurgia é uma arte, mas o manejo do paciente crítico é a ciência que deve sustentá-la.”
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#IcteríciaPerioperatória #ManejoDaIcterícia #CirurgiaDigestiva #EducaçãoMédicaContinuada #ComplicaçõesCirúrgicas
SOCRATES: Avaliação Sistemática da Dor em Cirurgia Digestiva
Introdução
A dor é um dos sintomas mais comuns que levam os pacientes a procurarem atendimento médico, e a sua avaliação precisa é crucial, especialmente na prática cirúrgica. Para estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo, o domínio da avaliação da dor é fundamental para o diagnóstico e tratamento adequados. O acrônimo SOCRATES é uma ferramenta eficaz que auxilia na sistematização da história clínica da dor, permitindo uma compreensão detalhada e contextualizada do quadro clínico do paciente.
Desenvolvimento
O Acrônimo SOCRATES
- Site (Localização) O primeiro passo na avaliação da dor é determinar onde ela está localizada. A dor é localizada, regional ou generalizada? Em pacientes com doenças do aparelho digestivo, a dor pode ser localizada em regiões específicas, como o epigástrio em úlceras pépticas, ou pode ser mais difusa, como na peritonite. A localização precisa ajuda a orientar o diagnóstico diferencial e a escolha das investigações complementares.
- Onset (Início) O início da dor é gradual, rápido ou súbito? A dor é intermitente ou constante? Essas perguntas são essenciais para determinar a etiologia da dor. Por exemplo, uma dor súbita e intensa pode sugerir uma condição aguda e grave, como uma perfuração gastrointestinal, enquanto uma dor gradual pode estar associada a processos inflamatórios crônicos, como a pancreatite.
- Character (Característica) A dor é descrita como aguda, em pontada, surda, latejante, apertada ou dolorida? A caracterização da dor oferece pistas valiosas sobre a patofisiologia subjacente. Por exemplo, uma dor aguda e em pontada pode sugerir isquemia, enquanto uma dor surda e contínua pode indicar inflamação crônica.
- Radiation (Irradiação) A dor irradia para outras áreas? A irradiação da dor é um aspecto crucial na avaliação clínica. Na cirurgia digestiva, por exemplo, a dor de cólica ureteral pode irradiar para a virilha, a dor relacionada à irritação diafragmática pode irradiar para o ombro, e a dor de origem pancreática pode se estender para as costas.
- Associated Symptoms (Sintomas Associados) A dor vem acompanhada de outros sintomas, como náuseas, vômitos, disúria ou icterícia? A presença de sintomas associados pode direcionar o diagnóstico para causas específicas. A dor abdominal acompanhada de icterícia, por exemplo, pode indicar colestase ou pancreatite.
- Timing (Cronologia) A dor ocorre em algum momento específico? A dor está associada à alimentação, ao repouso ou ao esforço físico? A cronologia da dor pode ser um indicador importante da sua etiologia. Dor após a ingestão de alimentos gordurosos pode sugerir colecistite, enquanto a dor que piora à noite pode estar relacionada a úlceras duodenais.
- Exacerbating or Relieving Factors (Fatores Exacerbantes ou Aliviadores) O que agrava ou alivia a dor? A dor piora com a respiração profunda, movimento ou tosse, sugerindo irritação de nervos somáticos no peritônio? A melhora com compressas quentes pode indicar dor inflamatória profunda. Na prática cirúrgica, a identificação desses fatores é essencial para o manejo adequado da dor, tanto pré quanto pós-operatória.
- Surgical History (Histórico Cirúrgico) O histórico cirúrgico do paciente está relacionado à dor atual? Pacientes com cirurgias prévias podem apresentar dores relacionadas a aderências, recidivas ou complicações cirúrgicas, como abscessos ou hérnias.
Pontos-Chave
- SOCRATES é uma ferramenta prática e eficaz para a avaliação detalhada da dor em pacientes cirúrgicos.
- A sistematização da avaliação da dor ajuda a formular hipóteses diagnósticas precisas e orienta a investigação clínica.
- Na cirurgia digestiva, a aplicação correta do SOCRATES pode ser a chave para diagnósticos precoces e intervenções cirúrgicas oportunas.
Conclusão
A dor, um sintoma tão comum quanto desafiador, exige uma abordagem sistemática para ser compreendida e tratada corretamente. A aplicação do acrônimo SOCRATES na prática clínica diária pode transformar a avaliação da dor em uma ferramenta diagnóstica poderosa, especialmente em contextos cirúrgicos. Como bem observou o cirurgião e professor Harvey Cushing: “Um cirurgião que não pode operar não é um cirurgião, mas um cirurgião que não pode diagnosticar não é médico.”
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#AvaliaçãoDaDor #SOCRATESPain #CirurgiaDigestiva #EducaçãoMédicaContinuada #DorAbdominal
Dissecando os Tipos de Artigos Científicos
Introdução
No universo da pesquisa médica, a habilidade de avaliar criticamente a literatura científica é uma competência fundamental para cirurgiões, especialmente aqueles dedicados ao aparelho digestivo. Com a crescente quantidade de informações disponíveis, é vital que estudantes de medicina, residentes de cirurgia geral e pós-graduandos em cirurgia do aparelho digestivo possam identificar e interpretar os diferentes tipos de estudos científicos de maneira precisa. Este artigo visa oferecer uma visão abrangente sobre os principais tipos de artigos científicos, destacando suas características, vantagens e limitações, e aplicando esses conceitos à prática cirúrgica.
Desenvolvimento
Tipos de Estudo
- Estudo Randomizado Controlado (RCT) O RCT é considerado o padrão-ouro para avaliar a eficácia de tratamentos. Nele, os participantes são distribuídos aleatoriamente entre grupos de tratamento e controle, permitindo a comparação direta dos resultados. Contudo, esse tipo de estudo é caro e demorado, muitas vezes inviabilizando sua realização em larga escala. Na cirurgia digestiva, por exemplo, estudos como esses são cruciais para validar novas técnicas operatórias, mas a randomização pode ser um desafio devido à variabilidade dos casos clínicos.
- Estudo de Coorte Estudo prospectivo onde dois grupos (coortes) são acompanhados ao longo do tempo: um exposto ao tratamento e outro não. Embora mais barato que o RCT, esse estudo é suscetível a vieses, como o de seleção. No contexto cirúrgico, coortes podem ser utilizadas para avaliar prognósticos pós-operatórios, como o impacto de uma nova técnica cirúrgica em pacientes submetidos a ressecções pancreáticas.
- Estudo Caso-Controle Esse estudo retrospectivo compara pacientes com uma condição específica (casos) com aqueles sem essa condição (controles). É o método mais rápido e econômico para investigar causas, mas enfrenta o desafio de classificar corretamente os participantes como casos ou controles. Estudos desse tipo são frequentemente usados na cirurgia digestiva para investigar fatores de risco para complicações pós-operatórias, como infecções em cirurgias colorretais.
- Série de Casos Consiste em uma coleção de relatos de casos clínicos, geralmente sem grupo de controle. Embora útil para descrever novos tratamentos ou complicações raras, a série de casos tem limitações em termos de generalização dos resultados.
- Revisão Sistemática Diferente das revisões tradicionais, a revisão sistemática aplica métodos rigorosos e reprodutíveis para coletar e avaliar a literatura sobre uma questão clínica específica. Na cirurgia digestiva, revisões sistemáticas são fundamentais para consolidar evidências sobre abordagens cirúrgicas controversas, como o manejo de câncer gástrico.
- Meta-Análise Esta técnica combina os resultados de dois ou mais estudos primários, aumentando a significância estatística dos achados. Embora poderosa, a meta-análise pode obscurecer efeitos locais específicos, o que é relevante na cirurgia, onde a experiência e a habilidade do cirurgião podem influenciar os resultados.
Níveis de Evidência
Para cirurgiões, a compreensão dos níveis de evidência é essencial para a aplicação prática dos resultados da pesquisa. A hierarquia dos níveis de evidência vai de revisões sistemáticas de RCTs (Nível 1a) até a opinião de especialistas sem crítica explícita (Nível 5). Na prática cirúrgica, essas classificações ajudam a contextualizar a robustez dos dados disponíveis ao tomar decisões clínicas, especialmente em áreas onde a evidência de alto nível é escassa.
Pontos-Chave
- RCTs oferecem a evidência mais robusta, mas são caros e complexos.
- Estudos de coorte e caso-controle são mais acessíveis, mas apresentam maiores riscos de vieses.
- Revisões sistemáticas e meta-análises são fundamentais para consolidar a evidência, mas requerem um exame crítico para evitar a sobreinterpretação de dados.
Conclusão
Na prática da cirurgia digestiva, a capacidade de avaliar criticamente os tipos de artigos científicos e compreender os níveis de evidência é crucial para a tomada de decisões informadas. Ao dissecar essas categorias e aplicar seus conceitos, os cirurgiões podem assegurar que as melhores práticas são seguidas, beneficiando assim os pacientes. Como bem colocou Sir William Osler: “A medicina é uma ciência da incerteza e uma arte da probabilidade” – palavras que ressoam profundamente no dia a dia de quem lida com as incertezas da prática cirúrgica.
Gostou ❔Nos deixe um comentário ✍️ , compartilhe em suas redes sociais e|ou mande sua dúvida pelo 💬 Chat On-line em nossa DM do Instagram.
#CirurgiaDigestiva #MedicinaBaseadaEmEvidências #ArtigosCientíficos #CirurgiaSegura #EducaçãoMédicaContinuada